AURKA蛋白激酶在三阴乳腺癌干细胞形成血管拟态中的实验研究
2013-10-22孙保存刘铁菊赵秀兰李岩磊
刘 营 ,孙保存 ,2,刘铁菊 ,赵秀兰 ,李岩磊
(1.天津医科大学病理学教研室,天津300070;2.天津医科大学附属肿瘤医院病理科,天津300060)
乳腺癌是女性常见肿瘤之一,且许多国家乳腺癌发病率呈上升趋势[1]。每年大约有20万患者死于乳腺癌的转移,大约占全球每年新发乳腺癌患者的20%[2]。乳腺癌干细胞在乳腺癌复发和转移中起重要作用。AURKA是Aurora激酶家族成员之一,是一种癌基因,在乳腺癌干细胞发展、上皮间充质转变(epithelial-mesenchymal transition,EMT)和远处转移中起重要作用[3]。目前有关乳腺癌干细胞体外培养的研究较少,本实验探索用干细胞无血清悬浮培养法从常规培养的乳腺癌MDA-MB-231细胞中分离出乳腺癌干细胞球,RT-PCR检测干细胞转录因子c-myc、sox-2的表达情况,Western blot检测 AURKA蛋白激酶在常规培养细胞和乳腺癌干细胞球的表达是否存在差异,通过乳腺癌干细胞球三维培养和加入AURKA蛋白激酶抑制剂来判断AURKA蛋白激酶在乳腺癌干细胞球成血管能力的作用。
1 材料与方法
1.1 材料 人乳腺癌细胞系MDA-MB-231由本实验室保存。DMEM/F12(1∶1)培养基购自 Gibco 公司,表皮生长因子(epidermalgrowth factor,EGF)和碱性成纤维生长因子(basic fibroblast growth factor,bFGF)购自Pepro Tech公司,B27购自Gibco公司,兔抗人AURKA、β-actin、山羊抗兔IgG抗体购自北京中杉金桥生物公司。AURKA蛋白激酶抑制剂MLN8237购自Selleckchem公司。
1.2 方法
1.2.1 常规细胞培养 将乳腺癌MDA-MB-231细胞用含10%胎牛血清、青霉素100U/mL和链霉素100 U/mL的DMEM培养液,置于37℃﹑5%CO2培养箱中恒湿培养,待细胞长至90%融合时传代。
1.2.2 干细胞无血清悬浮培养 选取对数生长期的乳腺癌MDA-MB-231细胞胰酶消化,重悬于无血清培养基(DMEM/F12培养基、20μg/L EGF、20 μg/L bFGF、2%B27) 并计数调整细胞至 1×105个/mL,接种于6孔板中培养。隔天更换1次培养基或者添加生长因子,每天倒置显微镜下观察肿瘤干细胞球形成情况。待培养孔中的肿瘤干细胞球形状规则、体积较大后,吸取含有肿瘤干细胞球的培养液离心,弃上清,吹打成单细胞悬液按1∶2比例传代。取第三代肿瘤细胞球进行后续实验。
1.2.3 RT-PCR检测 利用Trizol提取试剂盒提取细胞总RNA,紫外分光光度计定量,将2μg总RNA逆转录成cDNA用于PCR反应。PCR反应结束后进行1%的琼脂糖凝胶电泳,电泳结果用凝胶成像分析仪拍照,图像用Photoshop软件进行条带灰度分析。人 c-myc引物为 F:5′-TACCCTCTCAACGACA GCAG-3′,R:5′-TCTTGACATTCTCCTCGGTG-3′;人 sox-2 引物为 F:5′-GGGAAATGGAGGGGTGCA AAAGAGG-3′,R:5′-TTGCGTGAGTGT GGATGGG ATTGGTG-3′;内参 GAPDH 引物为 F:5′-CCTGGC CAAGGTCATCCATGAC-3′,R:5′-TGTCATACCAG GAAATGAGCTTG-3′。
1.2.4 三维培养 按DMEM与Matrigel胶1∶1进行冰上混匀,后加至96孔板,50μL每孔,在37℃放置待胶凝。常规消化细胞计数后在已凝胶上层加细胞约1×104个,然后放置在37℃、5%CO2培养箱培养。利用倒置显微镜观察三维培养管道形成情况。
1.2.5 Western blot检测 加入细胞裂解液裂解细胞,提取细胞总蛋白,加样行10%聚丙烯酰胺凝胶电泳。将蛋白从SDS-PAGE胶转膜至PVDF膜,利用5%脱脂奶粉封闭,然后分别加入AURKA(1∶2 000)、β-actin(1∶1 000)一抗,在 37 ℃下作用 2 h;用 TBST漂洗3次,每次10min后与山羊抗兔IgG抗体(1∶2 000)反应,37℃作用2 h;然后用TBST漂洗,10 min/次,洗涤3次;在暗室避光X线胶片曝光,进行显影、定影、拍照。
1.2.6 给予AURKA蛋白激酶抑制剂三维培养 Matrigel胶与DMEM 1:1冰上混匀后,加至96孔板中,50μL每孔,37℃静置待胶凝。在胶上层加约1×104个细胞,给予 AURKA抑制剂 MLN8237 1 μmol/L,37℃、5%CO2培养箱培养。48 h后在倒置显微镜下观察其管道形成情况。
2 结果
2.1 乳腺癌干细胞球的生长情况 接种于含生长因子无血清培养液中的乳腺癌细胞,24 h后在倒置相差显微镜下可见较小的肿瘤干细胞球形成,数量较少,呈类圆形,形状不规则,大小不一,结构松散。培养至10~14 d,肿瘤干细胞球数量增多,形成由数十个至上百个细胞组成的成熟细胞球,呈悬浮生长,球体进一步增大,呈圆形或卵圆形,折光性强,细胞连接紧密。见图1。

图1 无血清悬浮培养获得的肿瘤干细胞球(×600)Fig 1 Stem cellsspheresobtained from the serum-free suspension culture(×600)
2.2 RT-PCR检测干细胞转录因子 乳腺癌MDA-MB-231细胞经干细胞无血清悬浮培养后,对获得的乳腺癌干细胞球进行RT-PCR检测干细胞转录因子c-myc、sox-2的表达情况。结果显示无血清悬浮培养获得的乳腺癌干细胞球较常规培养细胞高表达干细胞转录因子c-myc、sox-2。见图2。
2.3 Western blot检测AURKA蛋白激酶 对无血清悬浮培养获得的乳腺癌干细胞球和常规培养细胞进行Western blot检测AURKA蛋白激酶表达情况。实验结果表明:利用无血清悬浮培养获得的乳腺癌干细胞球中AURKA蛋白激酶表达升高。见图3。
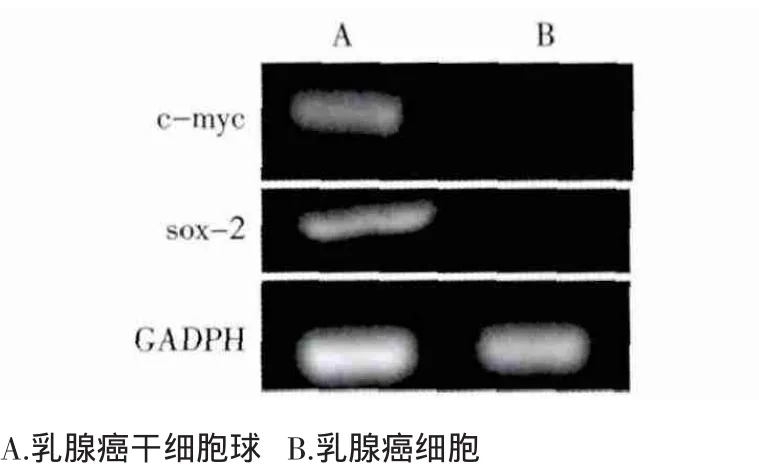
图2 RT-PCR检测干细胞转录因子c-myc、sox-2表达Fig 2 The expression of stem cell transcription factor status of c-m yc and sox-2were detected by RT PCR

图3 Western blot检测AURKA蛋白激酶在干细胞和常规培养细胞的表达Fig 3 The expression of AURKA protein kinase from stem and normal cellswere detected bywestern blot
2.4 AURKA蛋白激酶抑制剂对乳腺癌干细胞管道形成的影响 采用“ongel”三维培养法观察细胞管道形成能力。三维培养48 h后可见细胞呈梭状或多边形,伸出细长伪足,细胞相互连接形成大量管腔结构,见图4。加入AURKA蛋白激酶抑制剂后可见细胞聚集呈克隆状,形成管腔结构明显减少,见图5。

图4 乳腺癌干细胞三维培养(×100)Fig 4 Result of the breast cancer stem cells by three-dim ensional culture(×100)
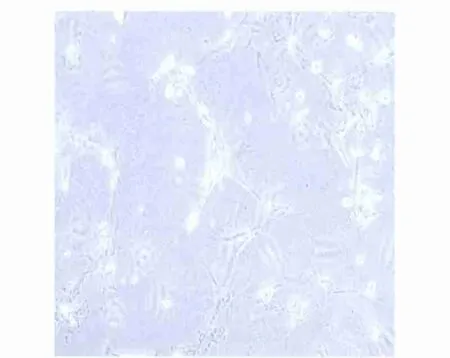
图5 加入AURKA蛋白激酶抑制剂后三维培养(×100)Fig 5 AURKA protein kinase inhibitor wereadded to the three dimension alculture(×100)
3 讨论
肿瘤组织中存在高致瘤性的肿瘤干细胞,其具有自我更新、多向分化、高致瘤性等特点,在肿瘤的形成和生长过程中起重要作用,被认为是肿瘤发生发展的根源[4]。肿瘤干细胞生物学行为研究对探索肿瘤的发生发展、诊断预后和治疗具有重要意义。乳腺癌组织和乳腺癌细胞株中已经证实存在具有干细胞样特性的肿瘤细胞群,但对乳腺癌干细胞体外培养的研究较少。干细胞无血清悬浮培养法是分离肿瘤干细胞的一种方法,肿瘤干细胞可在添加了生长因子(EGF、bFGF、B27)的无血清培养基中存活,生长因子EGF、bFGF促进细胞有丝分裂和抑制分化,B27为去除了分化剂的血清替代物,而非肿瘤干细胞则会在这种条件下逐渐凋亡。本实验探索用干细胞无血清悬浮培养法分离乳腺癌干细胞球,并对获得的乳腺癌干细胞球检测干细胞转录因子sox-2、c-myc表达,根据实验结果证实无血清悬浮培养法可从常规培养的乳腺癌细胞中获得乳腺癌干细胞球。
人AURKA激酶定位于20q13,属丝氨酸/苏氨酸激酶家族成员之一。AURKA蛋白激酶含有一个高度保守的氨基酸序列催化域,为胞质分裂的关键调节子。AURKA蛋白激酶调节中心体复制和分离,其表达降低可形成单极纺锤体,AURKA蛋白激酶高表达可导致中心体的扩增、纺锤体形成异常和基因组的不稳定性。体外研究证实AURKA蛋白激酶过表达导致细胞越过活化的纺锤体检查点,进入细胞有丝分裂后期,导致异常的细胞分裂、多核细胞和多倍体。AURKA蛋白激酶在恶性肿瘤的发生发展中起重要作用,已在多种恶性肿瘤中如食管癌、喉癌、肝癌、卵巢癌中证实AURKA高表达[5]。本研究发现AURKA蛋白激酶在乳腺癌干细胞球中较常规培养乳腺癌细胞高表达,提示AURKA蛋白激酶在乳腺癌干细胞自我更新和维持中起重要作用。最近的研究中使用果蝇中枢神经系统模型揭示了干细胞自我更新和分化的关键分子和机制。果蝇非典型蛋白激酶 C(D rosophila atypical protein kinase C,DaPKC)和定位于脑皮质的肿瘤抑制蛋白Lg1是成神经细胞不对称性分裂中的关键因子。中心体蛋白激酶AURKA为DaPKc不对称定位时所必需,成神经细胞顶端分裂时指示DaPKC和Lg1定位中AURKA激酶起重要作用。AURKA基因的突变可使果蝇成神经细胞数量增加,AURKA突变体能使成神经细胞外源性自我更新[6-8],但其具体机制尚有待进一步研究。
1999年Maniotis等发现了独立于肿瘤血管生成的全新的肿瘤血管模式,即血管生成拟态(vasculogenicmimicry,VM):在没有内皮细胞参与下肿瘤细胞通过自身变形和细胞外基质相互作用模仿机体血管生成而形成瘤细胞条索,血液在这种管道系统中流动[9-10]。VM可与宿主血管相连通,使肿瘤血液供应丰富。由于无内皮细胞屏障增加了血道转移的风险,故具有VM的肿瘤恶性度高,更易发生血道转移,预后差。现已证实乳腺癌中存在VM,具有VM的乳腺癌恶性程度更高,更易发生转移,预后更差[11]。有研究发现上皮间充质转变可促进VM的形成,上皮间充质转变细胞具有更强的穿透和浸润能力,可降解细胞外基质,引发血道转移,是肿瘤细胞向外扩散转移的起始步骤。AURKA在乳腺癌干细胞发展、EMT和远处转移中起重要作用,AURKA可诱导上皮间充质转变,促进乳腺癌细胞远处转移,抑制AURKA激酶可逆转EMT表型的表达[3]。本实验乳腺癌干细胞球三维培养可形成大量管腔结构,加入AURKA激酶抑制剂后,乳腺癌肿瘤干细胞球成血管能力减弱,因此,本研究认为AURKA激酶在乳腺癌干细胞上皮间充质转变和VM形成中起作用,具体调控机制还有待进一步研究,并有望成为抑制乳腺癌血管生成的治疗靶点。
综上所述,本研究提示AURKA激酶在乳腺癌干细胞自我更新和维持、上皮间充质转变和VM形成中起重要作用,可能成为乳腺癌治疗中抑制血管生成和转移的新的靶点,但其具体机制仍有待进一步研究。
[1]Chao Y L,Shepard CR,Wells A.Breast carcinoma cells re-express E-cadherin duringmesenchymal to epithelial reverting transition[J].MolCancer,2010,9:179
[2]Jemal A,Siegel R,Xu J,etal.Cancer statistics[J].CA Cancer J Clin,2010,60(5):277
[3]Acu ID,Liu T,Suino-Powell K,etal.Coordination of centrosome homeostasis and DNA repair is intact in MCF-7 and disrupted in MDA-MB 231 breastcancer cells[J].Cancer Res,2010,70(8):3320
[4]Hwang-VersluesW W,KuoW H,Chang PH,etal.Multiple lineages of human breast cancer stem/progenitor cells identified by profilingwith stem cellmarkers[J].PLoSOne,2009,4(12):e8377
[5]Baba Y,Nosho K,Shima K,etal.Aurora-A expression is independently associated with ehromosomal instability in colorectal cancer[J].Neoplasia,2009,11(5):418
[6]Shi Y,Sun G,Zhao C,etal.Neural stem cell self-renewal[J].Crit RevOncolHematol,2008,65(1):43
[7]Kim DW,Hirth F.Geneticmechanisms regulating stem cell selfrenewal and differentiation in the central nervous system of Drosophila[J].Cell Adh Migr,2009,3(4):402
[8]Wirtz-Peitz F,Nishimura T,Knoblich JA,etal.Linking cell cycle to asymmetric division:Aurora-A Phosphorylates the Par complex to regulate Numb localization[J].Cell,2008,135(1):161
[9]Liu T J,Sun BC,Zhao X L,etal.CD133+cellswith cancer stem cell characteristics associateswith vasculogenicmimicry in trilenegativebreastcancer[J].Oncogene,2013,32(5):544
[10]Lin P,Wang W,Sun B C,etal.Vasculogenic mimicry is a key prognostic factor for laryngealsquamous cell carcinoma:a new pattern ofblood supply[J].Chin Med J(Egl),2012,125(19):3445
[11]张冲,孙保存,张丹芳,等Twist1对人乳腺癌细胞E-cadherin表达及亚细胞定位的影响[J].中国肿瘤临床,2013,40(9):509
