趋化因子受体拮抗剂的研究进展*
2013-10-22吴剑涓
赵 刚,吴剑涓
(天津市环湖医院,天津 300060)
趋化因子(chemokines,chemoattractantcytokines)是一类由免疫或非免疫细胞分泌的结构相似的小分子蛋白,具有多种生物活性,能使细胞发生趋化运动(指细胞向高浓度刺激物方向的定向运动),其分子量为8~12 ku,到目前人类共发现44种趋化因子。趋化因子受体(chemokine receptor)是一类能与趋化因子相结合,表达于不同类型细胞上,具有七个跨膜区域结构的蛋白质,属于G蛋白偶联受体(GPCR)超家族,相对分子量约为40 ku,目前人类发现22个趋化因子受体。近年来,趋化因子及其受体的研究越来越受到重视,已经证明在炎症、肿瘤、自身免疫病、变态反应和艾滋病(AIDS)等疾病中均有趋化因子及其受体的参与,利用趋化因子受体拮抗剂与天然配体封闭趋化因子受体,成为国内外研究的热点。特别是近年来,以同源或异源寡聚体和变构体为靶点的药物研究得到重视[1,2]。本文将对趋化因子受体拮抗剂的研究进展进行扼要综述。
1 趋化因子和趋化因子受体
1.1 趋化因子及分类 趋化因子为70~120个氨基酸组成的分泌型蛋白质,其结构在氨基酸序列上具有4个保守的半胱氨酸(cysteine,C),根据趋化因子一级结构中靠近氨基酸(N端)的前2个C间是否插入其他氨基酸,可以将其分为四大类:①CXC趋化因子(α趋化因子,插入1个氨基酸残基);②CC趋化因子(β趋化因子,未插入其他氨基酸残基);③C趋化因子(γ-趋化因子,N端只有1个C);④CX3C趋化因子(δ-趋化因子,插入3个其他氨基酸残基)。迄今发现的CC趋化因子为CCL1~28,CXC趋化因子为CXCL1~16,CX3C趋化因子目前只有CX3CL1一个成员,C趋化因子有XCL1和XCL2两个成员[3]。
1.2 趋化因子受体及分类 趋化因子通过与相应的受体结合而发挥生物学效应。根据结合配体的不同,趋化因子受体可分为四类:①CXC趋化因子受体(CXCR);②CC趋化因子受体(CCR);③CX3C趋化因子受体(CX3CR);④XC趋化因子受体(XCR)。趋化因子与受体结合,具有不同的特异性。根据结合配体的特异性不同,趋化因子受体可分为三类:①特异性趋化因子受体,一种受体只能结合一种配体,例如CXCR4仅能与基质细胞衍生因子(SDF-1)即CXCL12结合并且与剂量呈正相关[4];②共享性趋化因子受体,一种受体能结合CC趋化因子家族或CXC家族中多个成员,但不能结合跨家族的趋化因子,大多数的趋化因子受体属于此类;③杂合性趋化因子受体,即既能与CC家族趋化因子结合,也能与CXC家族趋化因子结合,DARC(Duffy血型抗原,红细胞趋化因子受体)是此家族的唯一成员,DARC与人类免疫缺陷病毒(HIV)感染相关的趋化因子受体包括CXCR4和CCR5。
1.3 趋化因子的信号传导 绝大多数趋化因子能够激活G蛋白敏感的磷脂酶C,导致3,4,5-三磷酸激醇的产生和胞内Ca2+水平的升高。然而在某些细胞的趋化运动中,并检测不到Ca2+水平的升高,这提示可能有其他生化改变在趋化过程中起更为重要的作用。趋化因子与受体结合后的信号转导途径以白介素-8(IL-8)/CXCL8的研究最为深入,IL-8/CXCL8受体的α亚单位为百日咳毒素敏感的GαI[5]。当外环境中不存在IL-8时,G蛋白的三个亚单位呈聚合状态,α亚单位与GDP结合;当IL-8与受体结合时,GTP取代GDP,与α亚单位结合,同时形成游离的βγ二聚体,βγ二聚体活化两条主要信号传导途径中的酶为磷脂酶 Cβ2、β3(phospholipase Cβ2 andβ3,PLCβ2 and 3)和肌醇磷脂-3激酶(phosphatidylinositol-3-OH kinases,PI-3K)。PLC活化后,水解细胞膜上磷酸肌醇酯,产生三磷酸肌醇(IP3)和甘油二酯(DAG),IP3促使胞内储存钙的释放,引起胞内Ca2+浓度的快速升高,进而激活磷脂酶D等Ca2+-Ca调节蛋白激酶,DAG可激活蛋白激酶C(PKC)。PI-3K活化后,快速产生大量的3,4,5三磷酸激醇,活化蛋白激酶B(proteinkinaseB,PKB)。近来研究表明:βγ亚单位二聚体还能导致MAP激酶的活化,具体机制尚在研究之中;而α亚单位的作用不仅是通过与GTP或GDP的结合调控βγ亚单位二聚体而发挥间接作用,还能通过活化酪氨酸激酶而发挥作用。当GTP水解后,GαGDP与βγ二聚体重新结合,结束信号转导过程[6]。
2 趋化因子受体拮抗剂
趋化因子拮抗剂可封闭趋化因子和趋化因子受体的结合,对炎症、肿瘤、自身免疫病、变态反应、AIDS等疾病具有治疗作用。有统计表明,约30%的小分子药物是以G蛋白偶联受体为靶向的[7]。目前进入临床试验的趋化因子受体拮抗剂有45种,见表1。
2.1 CCR1拮抗剂 从2000年第一个进入临床试验的CCR1拮抗剂BX471开始,到目前共有8个,但只有ChemoCentryx公司开发的CCX354化合物还在进行以治疗类风湿关节炎为目的Ⅱ期临床试验[8],其余化合物的临床试验已经宣告失败,CCX354可阻断患者关节腔滑液中CCR1,减少炎性反应,防止关节损害,抑制炎性细胞浸润关节。现已开发的CCR1拮抗剂多以治疗类风湿关节炎(RA)和多发性硬化症(MS)为主。动物实验表明对上述疾病有一定效果,但临床试验还不是很满意。
2.2 CCR2拮抗剂 到现在已经有9个化合物进入临床试验阶段,其中有5个化合物临床试验宣告失败,有4个化合物还在进行中。①MLN1202是Millennium公司开发,该公司长期致力于趋化因子受体拮抗剂的研发,已经开发出多个拮抗剂,目前MLN1202化合物用于RA和MS治疗。在一项随机、双盲和安慰剂对照Ⅱ期临床试验中,观察到MLN1202显著降低C反应蛋白水平,其结果优于对照组,并且未观察到严重不良反应事件,现已在美国展开多个临床中心试验[9]。②CCX140是ChemoCentrys公司开发,在啮齿动物模型试验中显示出其具有降低血糖作用,在以治疗Ⅱ型糖尿病为目的的Ⅱ期临床试验中,结果显示治疗组与安慰剂组有显著差别,可使空腹血糖下降、糖化血红蛋白降低,并且患者耐受性良好,安全性高,目前还在继续开展更多的临床试验[10]。③CCX872同为ChemoCentrys公司开发,该公司宣布此化合物进入Ⅰ期临床试验,用于治疗糖尿病肾病(DN),患者耐受性良好,未见严重不良反应。④BMS-741672为百时美施贵宝公司研发,可降低糖化血红蛋白,用于治疗Ⅱ型糖尿病[11],目前还在进行Ⅱ期临床试验。目前研究表明,CCR2拮抗剂可能在治疗糖尿病领域开创出新的治疗方法。
2.3 CCR3拮抗剂 目前开发进入临床试验的CCR3拮抗剂共有6个,但有4个已经停止临床试验,还在进行的有:①ASM8由法玛西亚公司研发,可以抑制过敏性炎性物质释放,抑制β链的白介素-3、白介素-5和单核细胞,临床试验表明,其用于治疗轻度哮喘安全有效,患者耐受性良好[12];②BMS-639623由百时美施贵宝公司在杜邦公司开发的化合物DPC168基础上,对其结构进行改造而研发的新化合物。其可以减少肺部嗜酸性粒细胞数量,减少过敏原,稳定肺组织肥大细胞膜,抑制过敏介质释放,并减少CYD2D6代谢酶的灭活作用,改善药动学特征[13],用于治疗哮喘疾病,现进入Ⅰ期临床试验。从开发结果分析,CCR3拮抗剂在哮喘疾病治疗领域应用较多,为哮喘疾病开创了新的治疗途径。
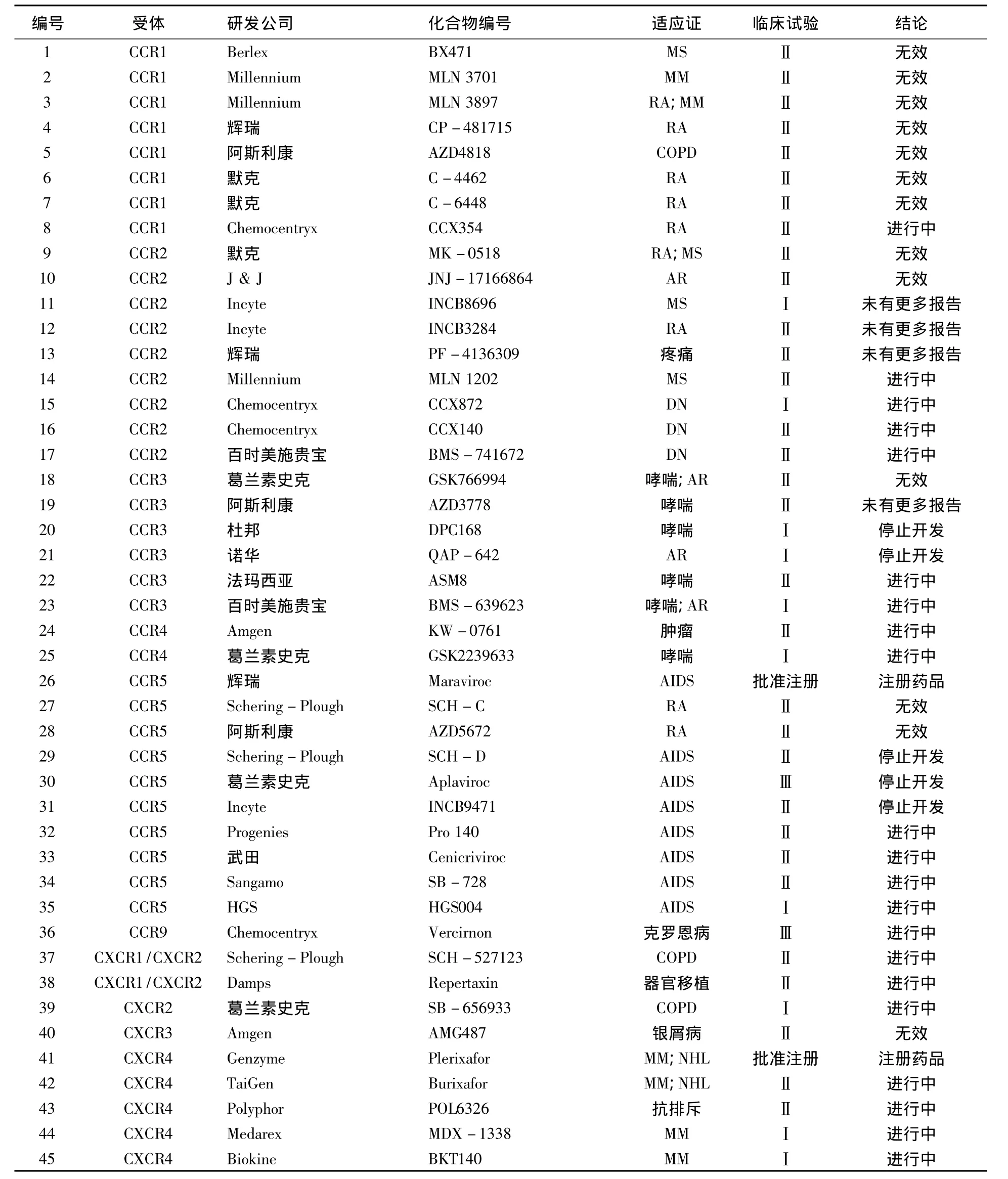
表1 进入临床试验的趋化因子受体拮抗剂
2.4 CCR4拮抗剂 基础研究表明CCR4不仅引起过敏性炎症反应,还引起人类T淋巴细胞Ⅰ型病毒感染[14],目前对CCR4拮抗剂的研究较少,现只有2个进入临床试验化合物。①KW-0761单克隆抗体,由Amgen公司研发,通过选择性结合CCR4,抑制CCR4参与的信号传导通路,阻断趋化因子介入的细胞转移、T细胞增殖和血管形成。此外该化合物可诱导抗体对CCR4产生依赖细胞毒作用,用于治疗复发CCR4阳性成人T细胞白血病淋巴瘤和外周T细胞淋巴瘤,目前Ⅱ期临床试验还在进行中[15]。②GSK2239633是葛兰素史克公司研发,已进入Ⅰ期临床试验,用于治疗过敏性哮喘研究,相关的临床试验还在继续进行[16]。
2.5 CCR5拮抗剂 虽然CCR5被认为是自身免疫性疾病的源头,例如RA和MS等,但近来研究表明CCR5协同参与HIV感染,导致HIV侵入宿主细胞,单核细胞/巨噬细胞嗜性的病毒株利用CCR5侵染细胞,因此目前所研发CCR5拮抗剂都用于HIV治疗。马拉诺维(Maraviroc)由辉瑞公司研发,是具有高度选择性CCR5拮抗剂,抗HIV活性强,对HIV病毒各个亚型都有活性,但对G亚型活性低。临床试验表明,本药口服生物利用度高,半衰期为17 h,不呈剂量依赖,对CCR5嗜性HIV潜伏期患者给予单一短期治疗后,患者体内病毒载荷量明显降低,患者耐受性好,未见严重不良反应,停药10 d后,病毒载荷量仍受到抑制,只需5~7 d服药一次,无须频繁用药。临床试验显示,该药具有较好的有效性和安全性[17],并于2007年通过美国FDA审批,成为第一个上市抗 AIDS的 CCR5拮抗剂药品[18]。
目前还在继续试验的CCR5拮抗剂有:①Pro140是Progenies公司研发,用于治疗HIV感染患者,单次静脉给药后可使病毒活性降低100倍,并且能维持10 d,未发现严重不良反应,患者耐受性良好[19]。进一步研究显示,Pro140采取皮下注射也可产生与静脉给药类似相同治疗作用,而皮下给药方式更方便病人自我治疗。②Cenicriviroc(TAK-652)武田公司研发,选用高温超导方式并通过化学结构修饰获得活性强、结构稳定、口服生物利用度较高的化合物TAK-652,可以阻断 CCL3与 CCR5结合,同时也能阻断 CCL2与CCR2结合,对分离的HIV毒株活性强,目前正在进行Ⅱ期临床试验[20]。③SB-728为Sangamo公司研发一种新型CCR5拮抗剂,通过修改CCR5基因编码,使趋化因子受体失去正常功能,可阻断HIV传播,目前正在进行Ⅱ期临床试验[21]。④HGS004是HGS公司研发人类IgG4单克隆抗体,对CCL3、CCL4和CCL5三个配体都有高度选择性,对HIV病毒有强大抑制作用,Ⅰ期临床试验显示该化合物是安全的,患者耐受良好[22]。
2.6 CCR9拮抗剂 研究发现在胸腺细胞、小肠淋巴细胞和上皮淋巴细胞存在CCR9,能与CCL25结合,表现在克罗恩病患者外周血液中T淋巴细胞显著增加CCR9/CCL25的表达[23]。Chemocentryx公司经长期研究开发出的化合物CCX282(Vercirnon),可抑制细胞中趋化因子CCL25与受体CCR9结合,阻止炎性细胞转移消化道过程中CCR9功能,阻断CCR9传递信号,消除存在肠道的炎性细胞。动物实验表明,该药对于回肠克罗恩病和溃疡性结肠炎小鼠模型有效,在为期4周中重度克罗恩病Ⅱ期临床试验中显示,每日1次给药0.25 g,患者耐受性良好,在多个疗效终点均优于对照组[24],目前已获准进行Ⅲ期临床试验。
2.7 CXCR1/CXCR2拮抗剂 人们在研究布洛芬时发现其具有较强的CXCL8抑制作用,从而使研究人员开发出新的化合物Repertaxin。该化合物具有抑制趋化因子CXCL8作用,但不是通过与趋化因子结合而发挥作用,机制尚不清楚。目前在进行Ⅱ期临床试验,用于器官移植后缺血再灌注[25]。另有报道,该化合物还可以治疗乳腺癌,动物实验发现其可抑制肿瘤的生长和转移,近期将在中晚期乳腺癌患者中展开临床试验[26]。
Schering-Plough公司研发的新化合物 SCH-527123根据构效关系分析为CXCR1/CXCR2双重拮抗剂[27],可抑制中性粒细胞和过氧化酶释放 CXCL1和CXCL8,而在其他不匹配的受体间无此作用;可逆性结合CXCR1和CXCR2,并具有饱和性,动物实验显示可以阻塞肺中性粒细胞和间质细胞增生,在臭氧刺激气道的健康受试者试验中,显示可降低痰液中性粒细胞计数,降低白介素8和过氧化酶,受试者耐受性良好,未见严重不良反应[28]。
2.8 CXCR2拮抗剂 葛兰素史克公司在早期研发可选择性阻断CXCL8的化合物SB225002基础上,经过化学结构改造,用卤素氟和氯取代溴,并引入磺酰基团而合成新的化合物SB656933,该化合物抑制CXCR2作用强,对CXCR1作用弱,可抑制中性粒细胞CD11b上调节和形状变化,在使用臭氧所致气管炎的健康志愿受试者的试验中显示,可选择性抑制CXCR2,减少炎症反应,2~100 mg剂量范围内患者耐受性良好,未见严重不良反应,呈现剂量依赖性减少气道炎症反应[29],目前还在进行临床试验。
2.9 CXCR3拮抗剂 目前CXCR3拮抗剂研究较少,只有Amgen公司研发的AMG487进入临床试验,用于自身免疫性疾病银屑病治疗[30],但结果显示与安慰剂相比没有任何区别,由于没有观察到疗效而终止该化合物开发。
2.10 CXCR4拮抗剂 在大多数白细胞亚群中,包括T淋巴细胞、B淋巴细胞、单核巨噬细胞和嗜中性粒细胞均存在CXCR4,与CXCL12(SDF-1)结合产生表达。值得注意是CXCR4是嗜T性HIV病毒入侵宿主细胞必需之物。但是先前的研究显示,单纯用于AIDS治疗时该药毒副作用较大,并且口服生物利用度差,目前已停止此方面的研究。而更多的研究显示此类拮抗剂主要用于肿瘤化疗和抗排斥反应方面,现已经有1个化合物成为注册药品正式上市,还有多个化合物正在进行临床试验。①Plerixafor(商品名Mozobil)Genzyme公司研发第一个CXCR4拮抗剂[31],通过抑制CXCR4可迅速动员骨髓中干细胞从骨髓分化出来,增加血液循环数量,改善非霍奇金淋巴瘤(NHL)患者体内的白细胞数量,同时可以消除骨髓中癌细胞(这些细胞是多发性骨髓瘤复发主要因素),因而可以有效治疗此种癌症。目前该化合物完成Ⅲ期临床试验[32],并在2008年美国FDA正式批准该化合物为注册药品,用于非霍奇金淋巴瘤和多发性骨髓瘤(MM)治疗。②TG-054(Burixafor)TaiGen公司研发,未公开化学结构,研究显示对CXCR4作用强,Ⅰ期临床试验显示单剂量给予本品可增加移植患者血液中干细胞数量,并且还与Mozobil作对比试验,开展了单一疗法临床研究,目前此化合物正在进行Ⅱ期临床试验用于治疗MM和NHL。③POL6326是Polyphor公司研发,持有被称为蛋白质抗原类似物专利技术,具有CXCR4拮抗作用[33]。本品已经在英国完成74例健康受试者Ⅰ期临床试验,显示具有良好耐受性和安全性,目前正在MM患者化疗后并进行自体造血干细胞移植者中展开Ⅱ期临床试验。④还有2个化合物正在进行Ⅰ期临床试验,MDX-1338(Medarex公司)和 BKT140(Biokine公司),具有CXCR4拮抗作用,用于治疗MM研究。
3 趋化因子受体拮抗剂的发展方向
3.1 以变构体为靶点的拮抗剂 最近的研究表明,趋化因子拮抗剂实际使用未达到预期效果,可能与趋化因子受体存在变构体或立体异构体有关。研究提示趋化因子与受体的结合至少涉及到两个“位点”。第一步,受体细胞外环的N末端与趋化因子核心球形区域的相互作用;第二步,是趋化因子N末端信号区与受体的跨膜区和细胞内环的相互作用。研究提示[34],Plerixafor可以阻断CXCL12的N末端与CXCR4受体的相互作用,而不能阻断两者作用的“第一步”。更多的研究证实拮抗剂可与胞浆内袋状结构相结合。
3.2 以同源或异源寡聚体为靶体的拮抗剂 当前的共识是,趋化因子受体通常形成同源或异源寡聚体。在考虑该因素后,设计趋化因子受体拮抗剂就会变得更加复杂,相关的调节机制包括配体介导的跨膜抑制和跨膜活化、受体去敏感化和受体内化等,如CXCR4/CXCR7异源二聚体与多种肿瘤相关,但对该异源二聚体的了解比对任何一个单体的了解要少得多。通过使用Plerixafor特异性阻断CXCR4受体发现,CXCR7可以调节CXCR4的功能[35]。另有研究发现,白细胞表达CCR2、CCR5和CXCR4的同源和异源二聚体,使用特异性拮抗剂Plerixafor后,在表达全部三种受体的细胞中,趋化因子结合其他受体的能力受到抑制[32,36]。
总之,趋化因子受体拮抗剂在治疗炎性反应和自身性免疫性疾病方面仍不失为一个有效的方法。尽管有一些临床试验失败,但仍然要保持谨慎乐观的态度,当有能力更清楚地了解疾病的生理病理过程,进行更多的动物试验后,就有可能设计出更有效的趋化因子受体拮抗剂,为治疗炎症、肿瘤、自身免疫病、变态反应和AIDS等疾病提供有效治疗药物。
1 Proudfoot A E I,Power C A,Schwarz M K.Anti- chemokine small molecule drugs:a promising future[J].Expert Opinion on Investigational Drugs,2010,19(3):345
2 Andrews G,Jones C,W reggett K A.An intracellular allosteric site for a specific class of antagonists of the CC chemokine G protein-coupled receptors CCR4 and CCR5[J].Mol Pharmacol,2008,73(3):855
3 Smit J J,Lukacs N W.A closer look at chemokines and their role in asthmatic responses[J].Eur J Pharmacol,2006,533:277
4 曹雪涛.免疫学前沿进展[M].北京:人民卫生出版社,2009:311
5 Wise E,Duchesnes C,Allen R,et al.Small molecule receptor agonists and antagonists of CCR3 provide insight into mechanisms of chemokine receptor activation[J].Biol Chem,2007,282:27935
6 Schwartz T,Frimurer T,Holst B,et al.Molecular mechanism of 7TM receptor activation a global toggle switch model[J].Annu.Rev.Pharmacol Toxicol,2006,46:481
7 Congreve M,Langmead C,Marshall F.The use of GPCR structures in drug design[J].Adv Pharmacol,2011,62:1
8 Dairaghi D,Zhang P,Wang Y,et al.Pharmacokinetic and pharmacodynamic evaluation of the novel CCR1 antagonist CCX354 in healthy human subjects:implications for selection of clinical dose[J].Clin Pharmacol Ther,2011,89:726
9 Gilbert J,Lekstrom - Himes J,Donaldson D,et al.Effect of CC chemokine receptor 2 CCR2 blockade on serum C-reactive protein in individuals at atherosclerotic risk and with a single nucleotide polymorphism of the monocyte chemo attractant protein -1 promoter region[J].Am J Cardiol,2011,107:906
10 Hanefeld M,Schell E,Gouni- Berthold I,et al.Oral chemokine receptor 2 antagonist CCX140-B shows safety and efficacy in type 2 diabetes mellitus[J].Diabetes,2011,60:A85
11 Carter P,Brown G,King S,et al.Discovery of an orallybioavailable CC chemokine receptor 2 antagonist derived from an acyclic diaminoalcohol backbone[J].Bioorg Med Chem Lett,2012,22:3311
12 Imaoka H,Campbell H,Babirad I,et al.TPI ASM8 reduces eosinophil progenitors in sputum after allergen challenge[J].Clin Exp Allergy,2011,41:1740
13 Santella J,Gardner D,Yao W,et al.From rigid cyclic templates to conformationally stabilized acyclic scaffolds.Part I:the discovery of CCR3 antagonist development candidate BMS-639623 with picomolar inhibition potency against eosinophil chemotaxis[J].Bioorg Med Chem Lett,2008,18:576
14 Pease J,Horuk R.Chemokine receptor antagonists:Part 1[J].Expert Opin.Ther.Pat.2009,19:39
15 Ishida T,Joh T,Uike N,et al.Defucosylated anti- CCR4 monoclonal antibody(KW-0761)for relapsed adult T-cell leukemia-lymphoma:a multicenter phase II study[J].Clin Oncol,2012,30:837
16 Procopiou P,Ford A,Graves R,et al.Lead optimisation of the N1 substituent of a novel series of indazole arylsulfonamides as CCR4 antagonists and identification of a candidate for clinical investigation[J].Bioorg Med Chem Lett,2012,22:2730
17 Steven F L van Lelyveld,Annemarie M J Wensing,Andy I M Hoepelman.The MOTIVATE trials:maraviroc therapy in antiretroviral treatment-experienced HIV -1-infected patients[J].Expert Rev Anti Infect Ther,2012,10(11):1241
18 Lieberman-Blum S S,Fung,H B,Bandres J C.Maraviroc:a CCR5 -receptor antagonist for the treatment of HIV -1 infection[J].Clin Ther,2008,30:1228
19 Jeffrey M,Melanie A,Jacob P,et al.Anti-HIV-1 Activity of Weekly or Biweekly Treatment with Subcutaneous PRO 140,a CCR5 Monoclonal Antibody[J].Infect Dis,2010,201(10):1481
20 Lalezari J,Gathe J,Brinson C,et al.Safety,efficacy,and pharmacokinetics of TAK-652,a CCR5/CCR2 antagonist,in HIV -1-infected,treatment- experienced,CCR5 antagonist- naive subjects[J].Acquired Immune Defic Syndr,2011,57:118
21 Urnov F,Rebar E,Holmes M,et al.Genome editing with engineered zinc finger nucleases[J].Nat,Rev Genet,2010,11:636
22 Lalezari J,Yadavalli G,Para M,et al.Safety,pharmacokinetics,and antiviral activity of HGS004,a novel fully human IgG4 monoclonal antibody against CCR5,in HIV -1 - infected patients[J].Infect Dis,2008,197:721
23 Saruta M,Avanesyan A,Fleshner P,et al.Phenotype and effector function of CC chemokine receptor 9-expressing lymphocytes in small intestinal Crohn’s disease[J].Immunol,2007,178:3293
24 Walters M,Wang Y,Lai N,et al.Characterization of CCX282,an orally bioavailable antagonist of the CCR9 chemokine receptor,for treatment of inflammatory bowel disease[J].Pharmacol Exp Ther,2010,335:61
25 Callisia Clarke,Satoshi Kuboki,Nozomu Sakai,et al.CXC Chemokine Receptor-1 is Expressed by Hepatocytes and Regulates Liver Recovery After Hepatic Ischemia/Reperfusion Injury[J].Hepatology,2011,53:261
26 Ginestier C,Liu S,Diebel M,et al.CXCR1 blockade selectively targets human breast cancer stem cells in vitro and in xenografts[J].Clin.Invest,2010,120:485
27 Raminder Aul,Sheena Patel,Susan Summerhill,et al.LPS challenge in healthy subjects:An investigation of neutrophil chemotaxis mechanisms involving CXCR1 and CXCR2[J].Immunopharmacology,2012,13:225
28 Nair P,Gaga M,Zervas E,et al.Safety and efficacy of a CXCR2 antagonist in patients with severe asthma and sputum neutrophils:a randomized,placebo - controlled clinical trial[J].Clinical& Experimental Allergy,2012,42:1097
29 Lazaar A,Sweeney L,MacDonald A,et al.Tal-Singer R SB-656933 a novel CXCR2 selective antagonist,inhibits ex vivo neutrophil activation and ozone - induced airway inflammation in humans[J].Clin Pharmacol,2011,72:282
30 Tonn G,Wong S,Wong S,et al.An inhibitory metabolite leads to dose-and time-dependent pharmacokinetics of AMG 487 in human subjects after multiple dosing[J].Drug Metab.Dispos,2009,37:502
31 De Clercq E.The AMD3100 story:the path to the discovery of a stem cell mobilizer(Mozobil)[J].Biochem.Pharmacol,2008,77:1655
32 Dipersio J,Micallef I,Stiff P,et al.Phase III prospective randomized double-blind placebo-controlled trial of plerixafor plus granulocyte colony-stimulating factor compared with placebo plus granulocyte colony-stimulating factor for autologous stem- cell mobilization and transplantation for patients with non - Hodgkin’s lymphoma[J].Clin Oncol,2009,27:4767
33 Filomena de Nigrisa,Concetta Schiano,Teresa Infante.CXCR4 Inhibitors:Tumor Vasculature and Therapeutic Challenges[J].Anti- Cancer Drug Discovery,2012,7:251
34 Kofuku Y,Yoshiura C,Ueda T,et al.Structural Basis of the Interaction between Chemokine Stromal Cell-derived Factor-1/CXCL12 and Its G -protein-coupled Receptor CXCR4[J].Journal of Biological Chemistry,2009,284(50):35240
35 Kalatskaya I,Berchiche Y A,Gravel S,et al:AMD3100 is a CXCR7 ligand with allosteric agonist properties[J].Mol Pharmacol,2009,75(5):1240
36 Brave M,Farrell A,Ching Lin,et al.FDA review summary:Mozobil in combination with granulocyte colony-stimulating factor to mobilize hematopoietic stem cells to the peripheral blood for collection and subsequent autologous transplantation[J].Oncology,2010,78:282
