HGF、C-Met和VEGF在子宫癌中的表达及其临床意义
2013-10-19尹华伟
尹华伟
·论著·
HGF、C-Met和VEGF在子宫癌中的表达及其临床意义
尹华伟
目的检测HGF、C-Met和VEGF蛋白在子宫癌中的表达情况,分析三者在子宫癌的发生、发展、转移和侵袭等方面的作用,为判断子宫癌的预后及基因靶向治疗提供理论及实验依据。方法选取我校附属医院2009年12月至2010年8月期间收集的子宫癌手术患者35例,取其癌组织标本作为研究组;取35例子宫肌瘤患者的组织标本为对照1组;同时选取35例门诊手术患者中正常子宫组织标本作为对照2组,对照检测HGF、C-Met和VEGF蛋白的表达,比较它们在子宫癌组织、子宫肌瘤组织和正常组织中的表达情况。结果HGF在子宫癌中的阳性表达为71.43%(20/35),显著高于子宫肌瘤组8.57%(3/35)和正常子宫组2.86%(1/35),P<0.01;C-Met在子宫癌中的阳性表达为51.43%(18/35),显著高于子宫肌瘤组织8.57%(3/35)和正常组织5.71%(2/35),P<0.01;VEGF在35例正常组织中呈微弱表达或不表达,仅有1例有阳性表达,占百分比为2.86%,而在35例子宫癌组织中有29例为蛋白阳性表达(82.86%,P<0.01),子宫肌瘤组织中VEGF蛋白的阳性表达率与正常组织无显著性差异,P>0.05。结论HGF、C-Met和VEGF蛋白在子宫癌中的表达显著上调,其过度表达可能为子宫癌的促发因素之一,与患者的预后密切相关。
子宫癌;肝细胞生长因子;肝细胞生长因子受体;血管内皮生长因子
子宫癌是妇科最常见的恶性肿瘤之一,占妇科肿瘤的10%~20%,据世界卫生组织估计80年代全世界子宫癌每年新发病例为45.9万,而中国则为13.15万,约占新发病例总数的1/3。而且,近年来世界各国资料均显示子宫癌有年轻化和子宫颈腺癌发病率上升的趋势。肿瘤的发生与发展是近年来国内外研究的热门课题,尤其是多种因子在肿瘤的发生、发展和血管再生中的作用日益受到重视。大量研究证实恶性肿瘤的发生、发展和侵袭、转移涉及到多基因、多因素及多分子水平的过程,是一系列复杂的级联式反应[1]。国外研究表明,在肿瘤细胞的侵袭、转移过程中,肝细胞生长因子(hepatocyte growth factor, HGF)发挥了非常重要的作用。HGF是由间质细胞分泌的一种多效性生长因子,其生物活性由单一受体C-Met 蛋白所介导,C-Met表达于多种上皮细胞上,两者结合后,在调控组织和血管再生、胚胎发育以及损伤修复等过程中有重要作用[2,3]。并且HGF/C-Met参与多种细胞因子的调控,血管内皮生长因子(vascular epithelial growth factor,VEGF)即是其中之一。肿瘤血管生成有多种调控因子,VEGF是高度特异的促血管内皮细胞有丝分裂素,并且是目前已知的作用最强的一种促血管生长因子[4], VEGF表达水平高低反映了肿瘤血管内皮细胞增殖、迁徙和血管构建的水平。HGF可通过3-磷脂酰肌醇激酶途径诱导VEGF的表达和分泌,从而促进肿瘤血管的形成[5]。目前国内外尚无HGF、C-Met、VEGF和子宫癌关系的研究和报道,为了解HGF、C-Met和VEGF与子宫癌发生、发展及预后的关系,本研究采用免疫组织化学方法(PV二步法)检测HGF、C-Met和VEGF蛋白在子宫癌中的表达情况并探讨其临床意义。
1 资料与方法
1.1临床资料 收集35例我校附属医院2009年12月至2010年8月期间收治的子宫癌患者行根治性手术后所留取的标本,所有患者术前6个月内均未使用过激素治疗,未经化疗和放射治疗,也无其他严重的内外科疾病。均经病理检查确诊,有详细的病理资料和临床记录。每一例组织离体后迅速用生理盐水冲洗掉血迹,用无菌手术刀在肿瘤中心部位切取癌组织,经复习HE切片,再次光镜诊断后,用10%多聚甲醛固定,常规脱水、透明、石蜡包埋,5 μm厚切片。另取35例同时间内收治的子宫肌瘤患者的组织标本为对照1组,35例门诊手术患者中正常子宫内膜组织标本为对照2组,同样制备石蜡切片,收起备用。
1.2方法
1.2.1主要试剂 兔抗人HGF多克隆抗体(工作浓度1∶200)、兔抗人C-Met多克隆抗体(工作浓度1 ∶ 300)、兔抗人VEGF多克隆抗体(工作浓度1 ∶ 200)、免疫组织化学(PV-9000二步法)山羊抗兔二抗试剂盒和DAB显色试剂盒均购于北京中杉金桥生物技术有限公司。
1.2.2检测方法 采用免疫组织化学PV-9000二步法。切片常规脱蜡,梯度水化,PBS(pH7.4)冲洗3 min×3次,0.01 mol/L柠檬酸缓冲液微波炉加热修复抗原,PBS冲洗3 min×3次,3%过氧化氢去离子水室温孵育10 min,以阻断内源性过氧化物酶活性,PBS冲洗3 min×3次,分别滴加HGF、C-Met和VEGF一抗工作液,放入湿盒,4℃冰箱孵育过夜,次日取出室温放置30 min,PBS冲洗3 min×3次,滴加二抗,室温孵育20 min,PBS冲洗3 min×3次,DAB染色,苏木素复染,返蓝,中性树胶封片。所有染色均在相同条件下进行,各组均留取一张切片作HE染色。用已知阳性的甲状腺癌组织切片作为阳性对照,PBS液代替一抗作阴性对照,重复以上步骤。
1.3结果判定 结合阳性对照片中典型阳性细胞的着色特征,在排除边缘效应、刀痕等非特异性染色干扰因素的前提下,将实验片上胞膜出现棕黄色着色和(或)胞浆出现棕黄色颗粒的细胞判定为阳性染色细胞。参照 Tetsuji Yamamotoa[6]等的免疫组织化学染色评分法,采用阳性细胞百分率的半定量法来判定染色结果,同时记录阳性染色标本的百分率。选择具有代表性的5个典型高倍视野(×400),每个视野内随机计数100个细胞,共计500个细胞。阳性细胞百分率用分值表示:0=不表达,1=<10%,2=10%~50%,3=>50%。每张片子5个视野的阳性细胞百分率平均分值为该标本的最后染色分值。最后平均染色分值为0~1的标本记为染色阴性标本,平均分值>1的记为染色阳性标本。所有结果均由两位病理医师独立评定,结果判读经两位主任病理医师审核确认。
1.4统计学方法 采用SPSS 14.0统计软件包对实验数据进行统计分析处理,子宫癌组织组、子宫肌瘤组织组和正常组织组之间,HGF、C-MET和VEGF染色分值比较采用秩和检验,HGF、C-MET和VEGF染色阳性标本百分率比较采用卡方检验,以P<0.05为差异有统计学意义,P<0.01为差异有统计学意义。
2 结果
2.1免疫组织化学染色结果 HGF蛋白阳性染色为肿瘤组织间质细胞及肿瘤细胞的细胞质中有棕黄色或棕褐色颗粒沉着,无背景着色。C-Met和VEGF 蛋白阳性染色定位于肿瘤细胞胞质内和(或)细胞膜上,被染成棕黄色,无背景着色。
2.2三组比较结果 HGF在子宫癌中的阳性表达为71.43%(20/35),显著高于子宫肌瘤组8.57%(3/35)和正常子宫组2.86%(1/35),P<0.01;C-Met在子宫癌中的阳性表达为51.43%(18/35),显著高于子宫肌瘤组织8.57%(3/35)和正常组织5.71%(2/35),P<0.01;VEGF在35例正常组织中呈微弱表达或不表达,仅有1例有阳性表达,占百分比为2.86%,而在35例子宫癌组织中有29例为蛋白阳性表达(82.86%,P<0.01),子宫肌瘤组织中VEGF蛋白的阳性表达率与正常组织无显著性差异,P>0.05。HGF阳性标本百分率结果见表1,三组平均表达率比较见图1。
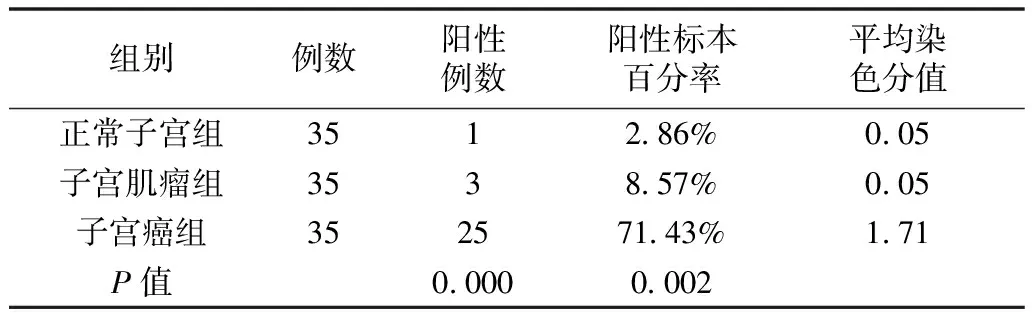
表1 对照组与肿瘤组HGF阳性标本百分率和染色分值比较
图1组间表达水平变化趋势图
3 讨论
肝细胞生长因子(hepatocyte gowth factor,HGF)是Nakamura[7]从部分肝切除的大鼠血浆中分离出的一种能强烈刺激肝细胞生长的细胞因子,又被称为扩散因子或分散因子(scatter factor,SF)。它由间质细胞产生,可通过旁分泌或自分泌方式作用于邻近细胞,与细胞表面受体C-Met结合并激活该受体的酪氨酸激酶活性,从而促进肝细胞、上皮细胞、内皮细胞、黑色素细胞、造血细胞及多种肿瘤细胞的有丝分裂、迁移以及形态发生,并参与组织再生、伤口愈合、胚胎发育及血管形成等多种生理过程。HGF和(或) C-Met在许多恶性肿瘤如肺癌、肝癌、胰腺癌、乳腺癌、结肠癌、宫颈癌、卵巢癌的发生发展中发挥的重要作用已得到证实[8]。
C-Met蛋白是一种具有酪氨酸激酶活性的跨膜蛋白,是由原癌基因C-Met编码表达的一种膜受体,被认为是HGF的唯一受体。C-Met与HGF结合后组成信号通路而发挥作用,如促进细胞增殖、迁移、形态改变以及促进肿瘤血管增生等[9]。过度表达HGF可诱导C-Met受体酪氨酸激酶自体磷酸化、经细胞内蛋白级联反应,激活Met-Ras-MAPK等信号转导途径、破坏细胞黏附分子和细胞骨架的连接作用,促进细胞增殖、分化、移动和侵袭以及促进新生毛细血管形成,这些均利于肿瘤的发生和发展。
血管内皮生长因子(vascul endothelial growth factor,VEGF)是血管内皮细胞特异性的多肽因子,有刺激血管内皮细胞增生、增加血管通透性、诱导新生血管生成的作用。是目前发现的最强刺激血管生成因子之一,也是作用最强的血管通透性因子,其作用是组胺的50000倍。VEGF在炎症反应、创伤愈合、肿瘤生长等多种生理病理过程中发挥着重要作用,特别是在肿瘤新生血管形成和和血道转移中的作用已成为热点并得到广泛证实。
Enc等[10]应用HGF与VEGF联合培养发现毛细血管样结构的数量明显超过单独应用VEGF培养,表明HGF与其受体C-Met结合可上调VEGFmRNA的表达。Dong[11]认为,HGF/C-Met信号途径主要通过PI3和MEK这两个关键激酶途径各自独立作用,上调促进转移的细胞因子IL-8和VEGFs的表达水平,促进肿瘤转移,导致预后恶化。Xin等[12]通过转基因方法证实HGF和VEGF在促进新生血管形成方面具有协同作用。
本研究采用免疫组织化学PV法检测了子宫癌组织中HGF、C-Met和VEGF蛋白的表达,结果表明,子宫癌组织中HGF、C-Met和VEGF蛋白的阳性表达率均显著高于子宫良性肿瘤组织和正常对照子宫组织(P<0.01);而且在子宫癌组织中,18例同时阳性或强阳性表达HGF与C-Met,二者表达呈平行趋势,提示HGF/C-Met自分泌环在子宫癌的发生发展过程中可能发挥一定作用,HGF使其特异性受体C-Met基因活性增强,C-Met蛋白过度表达,并通过与HGF结合而发挥作用,促进肿瘤的恶性演进。
以上结果说明,HGF、C-Met蛋白的高表达与子宫癌的发生和进展、侵袭和转移关系密切。可能的机制为异常增加的HGF激活C-Met蛋白,导致多种底物蛋白的酪氨酸磷酸化,经瀑布式的磷酸化反应,通过MAPK、PI3 k等信号传导通路,将信号逐级放大,转入细胞核内的转录机构[13],促进细胞的异常增殖,抑制细胞凋亡,导致子宫癌的发生。血管形成和细胞外基质ECM的降解是肿瘤形成和转移的基础,HGF异常高分泌可促进血管内皮生长因子VEGF的上调,促进肿瘤组织血管的生成;通过诱导细胞骨架结构重排、黏附分子激活、细胞外基质降解,促进肿瘤组织的浸润和转移。
综上所述,HGF、C-MET和VEGF在子宫癌组织中均有阳性表达,可能与子宫癌的生物学行为相关,它们相互作用,共同影响子宫癌的发生、发展,在肿瘤早期起重要作用。HGF、C-MET和VEGF表达反应了子宫癌的潜在恶性程度和分化程度,可作为子宫癌早期诊断、预测转移的指标,为临床治疗方案的选择及评估预后提供依据,有望成为抗瘤体新靶标,开拓肿瘤间质治疗新途径。但是肿瘤的发生、发展是多步骤、多因子参与的过程,复杂网络中的精确的调节机制还需要进一步的研究。
[1] 孙鑫,何永文.肿瘤微环境和相关成纤维细胞. 国际病理科学与临床杂志,2009,34(04):67-68.
[2] Tamura M, Daikuhara Y. Structure and function of hepatocyte growth factor/scatter factor(HGF/SF). Curr Topics Biochem Res,2000,54(2):149-159.
[3] Zhang Y W, Vande G F. HGF/C-Mmet signaling in the control of branching morphogenesis and invasion. J CellBiochem,2003,88(2):408-417.
[4] Neufeld G, Cohen T, Gengrinovitch S, et al. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J,1999,13(1):9-22.
[5] 刘崇梅,李德祥.HGF/C-Met 系统与头颈鳞癌相关性研究的进展.国外医学耳鼻咽喉科学分册,2003,27(5):276-279.
[6] Yamamotoa Tj, Maruia T,Akisue T.Coexpression of hepatocyte growth factor and its receptor c-Met correlates with high MIB-1 proliferative index in malignant fibrous histiocytoma.Pathology Research and Practice,2004,200(03):397-402.
[7] Nakamura T, Nawa K, Ichihara A. Partial Purification and characterization of hepatocyte growth factor from serum of hepatectomized rats. Bioehem Biophys Res Commun,1984,122(3):1450-1459.
[8] Baykal C, Ayhan A. Over expression of the c-Met/HGF receptor and its prognostic significance in uterine cervix carcinomas. GynecolOnco,l 2003, 88(03): 123-129.
[9] Maulik G, Shrikhande A, Kijima T, et al. Role of the hepatocyte growth factor receptor, c-Met, in oncogenenesis and potential for therapeutie inhibition. Cytokine Growth Factor Rev,2002,13(l):41-59.
[10] Enc.Van.belle,Bemhard W,Donghui C,et al.Potentiated angiogenic effect of scatter factor/hepatoeyte growth factor via induction of vascular endothelial growth faetor.Cireulation,1998,97(06):381-390.
[11] Dong G, Chen Z, Li ZY, et al. Hepatoeyte growth factor/scatter factor-induced activation of MEK and PI3 k signal pathways contributes to expression of proangiogenic cytokines interleukin-8 and vascular endotheliai growth factor in head and neck squamous cell carcinoma. Cancer Res,2001,61(15):5911-5918.
[12] Xin X, Yang S, Ingle G, et al. Hepatocyte growth factor enhances vascular growth factor-induced angiogenesis in vitro and in vivo. AmJPathol,2001,158(3):1111-1120.
[13] Paumelle R, Tulasne D, Kherrouche Z, et al. Hepatocyte growth factor/scatter factor activates the ETS1 transcription factor by a RAS-RAF-MEK-ERK signaling pathway. Oncogene,2002,21(15):2309-2319.
ClinicalSignificanceofHGF、C-MetandVEGFExpressioninUterineCancerTissue
YINHua-wei.
ShandongMedicalCollege,Linyi276000,China
ObjectiveTo test the HGF,C-Met and VEGF expression in the uterine cancer,analyse their effects in occurrence,development and aggressive of the womb cancer, and provide the theory to the formation mechanism of uterine cancer, prognostic, gene targeting therapy.MethodsCollected 35 cases of uterine surgery patients from 2009.12 to 2010.08, took the cancer cells as the team group,take 35 specimen of patients with uterine flesh tumour compared to the organization of the 1 group, at the same time, 35 patients were selected the normal medical organization as comparison group 2,applyed immunohistochemical P-V method to detect HGF, C-Met and VEGF protein expression.ResultsThe positive expression of HGF in the womb cancer was 71.43%(20/35), significantly higher than uterine fibroids organization 8.57%(3/35) and normal tissue 2.86%(1/35),P< 0.01,C-Met in the expression of uterine cancer was 51.43%(18/35), significantly higher than uterine fibroids organization 8.57%(3/35) and normal tissue 5.71% (2/35),P< 0.01, VEGF in 35 patients of normal tissues are faint expression, only 1 case had positive expression, accounting for percentage is 2.86%, and in 35 patients in the uterus cancer cells 29 patients (82.86%,P<0.01)for protein expression positive, the fibroid tissue has no significant differences and normal tissue,P> 0.05.ConclusionHGF, C-Met and VEGF expressed significantly raised in uterine cancer, may be one of the factors that contributed to the womb cancer.
Uterine cancer; HGF; C-Met; VEGF
276000 临沂,山东医学高等专科学校
