PET与增强CT同机融合检查在胰腺恶性肿瘤鉴别诊断及临床分期中的价值
2013-10-19方艺张建崔莹孙高峰冯菲崔斌邱爽左长京
方艺 张建 崔莹 孙高峰 冯菲 崔斌 邱爽 左长京
·论著·
PET与增强CT同机融合检查在胰腺恶性肿瘤鉴别诊断及临床分期中的价值
方艺 张建 崔莹 孙高峰 冯菲 崔斌 邱爽 左长京
目的探讨18F-FDG PET与增强CT(contrast enhance CT, CECT)同机融合(PET/CECT)检查对胰腺恶性肿瘤鉴别诊断及分期的应用价值。方法对52例未行过增强CT检查、临床及影像检查发现可疑胰腺病变的患者行常规PET/CT检查,同时在PET延迟扫描后立即行同机增强CT检查(PET/CECT),将两者图像融合并对胰腺病变进行诊断及鉴别诊断。以病理及临床随访结果作为诊断标准,比较PET/CECT、常规PET/CT对胰腺恶性肿瘤诊断的敏感性、特异性及准确性。分别测定病灶早期及延迟的最大标准摄取值(SUVmax),计算18F-FDG的滞留指数(RI)。以接受手术的24例患者术中所见及病理诊断为依据,比较PET/CECT与常规PET/CT对胰腺癌TNM分期的准确性。结果52例胰腺病变患者中,PET/CECT对胰腺良、恶性病变鉴别诊断的敏感性、特异性及准确性分别为100%、88.2%、96.2%,常规PET/CT分别为94.3%、70.6%、86.5%。恶性组(35例)的早期SUVmax、延迟SUVmax、RI分别为8.4±3.4、10.1±4.3、(24.1±22.6)%,良性组(17例)分别为4.5±3.9、5.0±4.3、(10.9±14.9)%,胰腺良、恶性组间RI差异无统计学意义(P=0.064)。24例手术患者中17例为恶性,PET/CECT和PET/CT诊断胰腺恶性肿瘤T分期准确性为82.3%和64.7%,差异有统计学意义(P=0.032);诊断胰腺恶性肿瘤N分期准确性为91.7%和83.3%,差异无统计学意义(P=0.980)。结论18F-FDG PET/CECT诊断胰腺良、恶性病变的敏感性、特异性及准确性优于常规PET/CT,判断胰腺恶性肿瘤侵犯周围血管及脏器的准确性高于常规PET/CT,可以作为一站式检查对胰腺病变行良、恶性鉴别诊断及术前评估。
胰腺肿瘤; 体层摄影术,发射型计算机; 体层摄影术,X线计算机; 脱氧葡萄糖
胰腺癌发病隐匿,早期症状不明显,多数患者确诊时已出现局部扩散及远处转移,失去了手术机会,即使有条件进行手术的患者,其5年生存率也仅为10%~15%[1],因此及时、准确诊断胰腺癌对于选择治疗方案极为重要。常规PET/CT在胰腺癌诊断、分期、疗效检测及预后评估中显示了其优越性,但在鉴别胰腺病变的良、恶性及肿瘤侵犯邻近组织的范围等方面存在一定的局限性。张森等[2]报道,常规PET/CT检查结合增强CT(CECT)能提高胰腺癌诊断的灵敏性、特异性及准确性。本研究回顾性分析52例未行增强CT检查的可疑胰腺病变患者常规PET/CT与同机增强CT(PET/CECT)的影像学特征,探讨其一站式检查对胰腺肿瘤鉴别诊断及恶性肿瘤分期的临床应用价值。
资料与方法
一、临床资料
收集2011年9月至2012年6月间在上海长海医院行PET/CT检查的患者。入选标准:(1)临床及影像检查怀疑胰腺肿瘤但尚未行增强CT检查者;(2)检查前未行穿刺活检及相关治疗。排除标准:(1)对碘造影剂过敏者;(2)血糖浓度>11.1 mmol/L;(3)不能耐受长时间平卧检查者。共入选患者52例,其中男性34例,女性18例,中位年龄58岁(13~81岁)。最后确诊恶性病变35例,其中经手术病理证实17例,经超声引导下细针穿刺活检证实10例,经影像学资料或临床随访6个月以上证实8例(2例死亡)。恶性病变中胰腺导管腺癌28例,囊腺癌3例,转移瘤1例,淋巴瘤2例,神经内分泌肿瘤1例。良性病变17例,其中经手术病理证实7例,经影像学资料或临床随访6个月以上证实10例。良性病变中慢性胰腺炎7例,结核1例,自身免疫性胰腺炎2例,囊腺瘤或导管内乳头状黏液瘤5例,实性假乳头状瘤1例,胰岛细胞瘤1例。
二、显像仪器及检查方法
成像设备为西门子Biograph 64 PET/CT(52环LSO晶体/64层螺旋CT),18F-FDG由上海原子科兴药业有限公司及复旦大学附属华山医院PET中心提供,放化纯度>95%。受检者检查前禁食6 h以上,注射18F-FDG前测量手指毛细血管血糖浓度并留置套管针。受检者血糖值<11.1 mmol/L时,按3.70~5.55 MBq/kg体重静脉注射18F-FDG。静息45~60 min后行PET/CT扫描,采集6~7个床位,2.5 min/床位。Multimodality后处理工作站TureD系统进行图像重建,形成横断面、冠状面、矢状面断层图像及三维投影图像。注射药物2 h后行胰腺区域延迟扫描1~2个床位,高压注射器注射碘海醇80 ml(370 mgI/ml),速率3 ml/s,行平扫及三期增强扫描(动脉期20 s、实质期45 s及门脉期80 s)。扫描范围包括膈顶至胰腺钩突,准直器宽度5 mm,螺距0.875,重建层厚3 mm,扫描条件为120 kV,170 mAs。将原始数据传递到工作站,使用后处理工作站TureD系统进行同机PET与增强CT(PET/CECT)融合处理。
三、图像分析
具有经验的中、高级职称的核医学、放射学医师各2名对每例常规PET/CT及PET/CECT影像进行分析,测量数据,取平均值,诊断不一致时以讨论一致后的结果为准。以手术病理或临床随访6个月以上结果作为最终诊断。
1.常规PET/CT图像分析:PET诊断胰腺恶性肿瘤标准为结节或肿块状放射性浓聚,高于肝脏及周围正常胰腺组织;对应层面CT平扫为低密度灶伴(或不伴)胰管扩张、胰腺萎缩,可伴有血行转移或淋巴结转移。慢性胰腺炎表现为弥漫性、条状摄取增高或无代谢异常,可伴有胰管结石。
2.CECT图像分析:包括胰腺病变强化方式及病灶与毗邻血管、脏器的关系。无明显强化的主要为胰腺癌,明显强化的主要为神经内分泌肿瘤及胰岛细胞瘤,轻、中度延迟强化主要为肿块型胰腺炎。
3.PET/CECT图像分析:将PET、CECT图像同机融合,综合分析病灶代谢与形态特征,重点观察肿瘤边缘、肿瘤与周围重要血管关系、肿瘤是否侵犯胰管及周围脏器。淋巴结转移标准为CT短径≥10 mm或PET的最大标准摄取值(SUVmax)≥2.5。
四、统计学处理

结 果
一、不同检查方法对胰腺良、恶性病变鉴别诊断的效能
35例恶性组的SUVmax范围为2.6~17.6,平均为8.4±3.4;17例良性组的SUVmax范围为1.1~14.1,平均为4.5±3.9。SUVmax诊断胰腺癌的ROC曲线的曲线下面积为0.798(95%可信区间0.649~0.948)。取SUVmax=3.5进行鉴别诊断,PET诊断胰腺恶性肿瘤的敏感性91.4%,特异性58.8%,为本研究的最佳诊断临界值。依据上述诊断标准,常规PET/CT诊断胰腺恶性肿瘤的敏感性、特异性及准确性分别为94.3%、70.6%、86.5%;PET/CECT分别为100%、88.2%、96.2%。PET/CECT检查结果与最终诊断结果吻合度较强(Kappa=0.910,P<0.05),常规PET/CT、PET的SUVmax3.5与最终诊断结果吻合度一般(Kappa值分别为0.680和0.535,P值均<0.05)。
常规PET/CT诊断出现假阳性5例,其中包括肿块型胰腺炎2例、胰岛细胞瘤1例(图1)、实性假乳头状瘤及结核各1例;出现假阴性2例,将胰腺癌误诊为急性胰腺炎(图2)及自身免疫性胰腺炎各1例。PET/CECT诊断仅出现假阳性2例,分别为慢性胰腺炎及结核各1例。
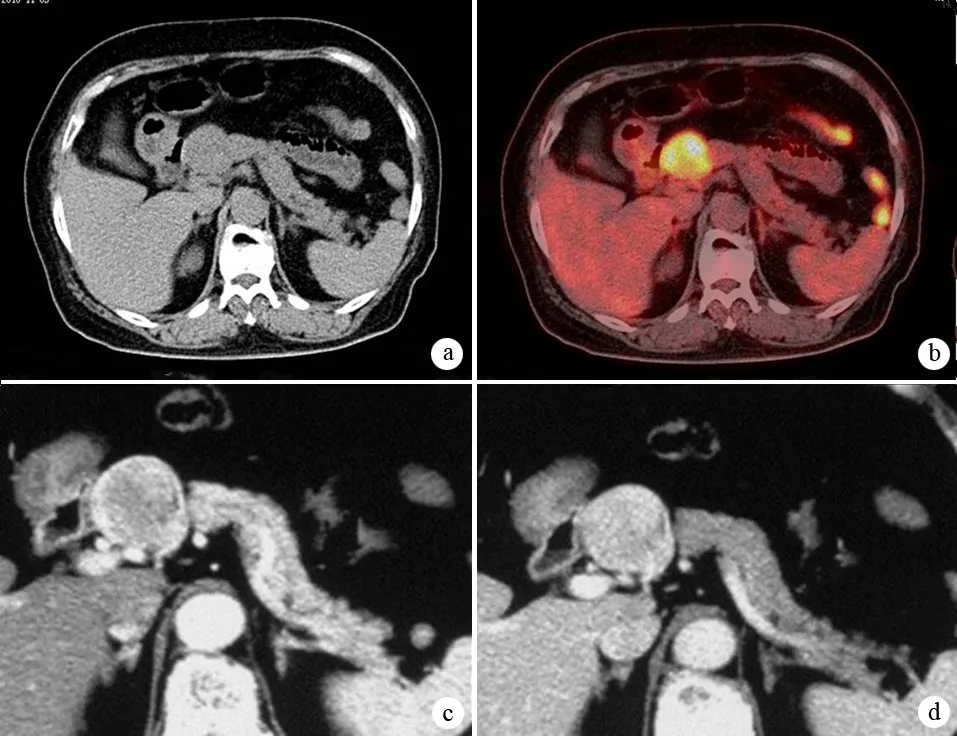
图1良性胰岛细胞瘤的CT平扫(a)、常规PET/CT(b)及增强CT实质期(c)、门脉期(d)征象
图2胰头沟突部癌的常规PET/CT(a)、PET与胰腺实质期融合(b)、增强后的胰腺实质期(c)和门脉期(d)及PET全身最大投影图(e)
二、滞留率
52例患者注射18F-FDG 2 h后均行PET胰腺延迟显像。恶性组35例的早期SUVmax为8.4±3.4, 延迟SUVmax为10.1±4.3,RI为(24.1±22.6)%;良性组17例的早期SUVmax为4.5±3.9, 延迟SUVmax为5.0±4.3,RI为(10.9±14.9)%,良性与恶性组间的RI差异无统计学意义(P=0.064)。
三、术前分期
52例患者中,常规PET/CT及PET/CECT均发现5例伴有血行转移(肝、肺、骨转移)及远处淋巴结转移,明确3例腹部增强CT未肯定的病灶,其中包括肝转移、腹膜种植转移及远处淋巴结转移。
对于24例接受手术的患者,术中发现恶性肿瘤侵犯周围血管或毗邻脏器11例。术前常规PET/CT诊断胰腺癌T分期的敏感性、特异性及准确性分别为54.5%(6/11)、83.3%(5/6)、64.7%(11/17);PET/CECT分别为81.8%(9/11)、83.3%(5/6)、82.3%(14/17),准确性差异有统计学意义(P=0.032)。常规PET/CT诊断区域淋巴结转移(N分期)的敏感性、特异性及准确性分别为71.4%(5/7)、100%(5/5)、83.3%(10/12);PET/CECT分别为85.7%(6/7)、100%(5/5)、91.7%(11/12),差异均无统计学意义(P值均>0.05)。
讨 论
在PET图像分析中,半定量指标SUVmax常作为判断胰腺病变良、恶性的重要指标。但由于18F-FDG并非肿瘤的特异性显像剂,一些胰腺的良性病变,如炎症(包括肿块型胰腺炎、自身免疫性胰腺炎、结核)、高分化神经内分泌肿瘤、部分囊腺瘤也可有FDG浓聚,造成假阳性,而部分胰腺癌糖的代谢增高不明显,因而造成假阴性。另外,PET受空间分辨率的限制,不易发现较小的病灶而出现假阴性。因此需要联合解剖学影像方法(如CT、MRI)来提高诊断的准确性。
PET/CT中同机CT大多用低剂量平扫CT,其对胰腺病变所提供的诊断信息有限。而行增强CT扫描,由于病灶与周围正常组织的血液供应不同,强化特征不一致,胰腺病变的动态增强CT值变化对胰腺病变鉴别诊断非常有价值。PET/CECT显像技术整合了PET与增强CT两种影像学手段,所以不仅可以反映病变组织糖代谢情况,还可以通过病灶的CT强化特征鉴别病灶性质,同时可较平扫CT更清晰显示病灶与毗邻脏器、血管的关系。本研究结果显示,PET/CECT诊断胰腺恶性肿瘤的敏感性、特异性及准确性较常规PET/CT均有提高。本组有1例患者常规PET/CT图像上显示胰头肿块高代谢灶并伴有胰管扩张,提示胰腺癌可能,但增强CT显示肿块动脉期轻度强化,实质期及门脉期呈渐进性强化,与胰腺癌乏血供特征不同,清楚显示并明确诊断胰管扩张是由结石引起,经随访证实为肿块型胰腺炎。1例患者的PET图像上显示放射性浓聚,代谢特征与胰腺导管腺癌相似,但同机增强CT发现肿瘤轮廓规则,周边见较厚纤维包膜,增强后包膜强化较明显,病灶与胰腺分界清晰,瘤体内实性与囊性成分混合伴有钙化灶,结合患者为年轻女性,诊断为实性假乳头状瘤,后经病理证实。2例局限性自身免疫性胰腺炎(AIP)的病变部位均出现节段性FDG摄取增高(SUVmax分别为4.9、5.6),延迟扫描后FDG摄取轻度升高(SUVmax分别为5.6、6.8),平扫CT图像以局限性低密度肿块为主要表现,与胰腺导管腺癌的PET/CT表现相似,但增强CT图像表现为增强早期密度低于周围正常胰腺组织,门脉期则逐步强化,密度与周围正常胰腺一致,与胰腺癌始终呈低密度乏血供肿块的征象不一致。当然,AIP的PET图像上除了显示胰腺异常外,还可显示胆管、唾液腺、淋巴结、肺及前列腺等多种其他器官受累的表现[3]。
文献报道,延迟显像有助于提高肺癌PET/CT诊断的敏感性、特异性和阳性预测值[4]。然而有关PET双时相显像在胰腺病变诊断应用的文献较少,延迟显像对胰腺良、恶性病变的鉴别价值尚待研究。Nakamoto等[5]提出,当PET常规显像的胰腺病灶SUVmax介于2.5~4之间时,应选择延迟显像帮助进一步确诊。82%的恶性病灶延迟2 h显像,其SUVmax增高,并且滞留率>10%,而仅15%的良性病变出现类似表现。本组胰腺良、恶性病变RI的差异无统计学意义,主要原因是一些炎性病变可摄取FDG,且随时间延长摄取增高。如显像阳性的结核往往是以增殖性病变为主的结节,含有大量类上皮细胞、朗罕巨细胞和淋巴细胞,这些细胞代谢旺盛,FDG摄取可很高[6]。本组1例胰腺结核及2例AIP行PET延迟显像后FDG摄取均进一步升高。因此,对疑为胰腺癌的患者,18F-FDG PET双时相显像鉴别诊断良、恶性病变的临床价值不大,但延迟SUVmax降低可有助于诊断胰腺良性病变。
PET/CECT由于综合了增强CT更多的解剖学信息,清晰地显示胰腺恶性肿瘤周围血管及毗邻脏器的侵犯情况,因而优于常规PET/CT。本研究PET/CECT与常规PET/CT对胰腺癌N分期的准确性结果与以往研究报道一致[7],两者无显著差异。PET/CECT对M分期诊断结果与常规PET/CT亦相似,然而PET/CT对M分期及远处淋巴结转移较常规影像学检查如CT、MRI局部扫描具有明显的优势。
对于部分CT、MRI难以发现的腹膜种植转移等隐匿病灶,PET/CT常可以有效地检出。文献报道, PET/CT发现的病灶中,约有1/3肝内及腹膜小转移灶被增强CT漏诊[8]。本研究PET检出3例腹部增强CT未能发现的隐匿病灶,其中1例CT误诊为肝微小囊肿,1例腹膜种植转移及1例远处淋巴结转移漏诊。
综上所述,PET/CECT较常规PET/CT可以获得更多、更精确的解剖学诊断信息,从而提高了对胰腺病变鉴别诊断及局部分期的准确性。PET/CECT可以作为一站式检查对胰腺病变患者进行鉴别诊断及术前分期。
[1] Jemal A,Clegg LX,Ward E,et al.Annual report to the nation on the status of cancer.1975-2001,with a special feature regarding survival.Cancer,2004,101:3-27.
[2] 张淼,李彪,王华枫,等.18F-FDG PET/CT与增强CT在胰腺癌诊断和分期中的价值比较.诊断学理论与实践,2009,8:50-54.
[3] Zhang J,Shao C,Wang J,et al. Autoimmune pancreatitis: whole-body (18)F-FDG PET/CT findings.Abdom Imaging,2013,38:543-549.
[4] 梁颖慈,唐安戊,徐浩. 18F-FDG PET延迟显像鉴别诊断原发性肺癌.中华核医学杂志,2004,24:27-29.
[5] Nakamoto Y,Higashi T,Sakahara H,et al.Delayed (18)F-fluoro-2-deoxy-D-glucose positron emission tomography scan for differentiation between malignant and benign lesions in the pancreas.Cancer,2000,89:2547-2554.
[6] 赵军,林祥通,管一晖,等.双时相PET显像在肺良恶性病变鉴别诊断中的应用.中华核医学杂志,2003,23:8-10.
[7] 张雯杰,吴宁,周纯武,等.18FDG PET/CT与增强CT对胰腺癌分期的价值.中国医学影像技术,2012,28:727-730.
[8] Heinrich S,Goerres GW,Schäfer M,et al. Positron emission tomography/computed tomography infuences on the management of resectable pancreatic cancer and its cost-effectiveness. Ann Surg,2005,242:235-243.
Valueof(18)F-FDGPET/CECTindifferentialdiagnosisandclinicalstagingofpancreaticcancer
FANGYi,ZHANGJian,CUIYing,SUNGao-feng,FENGFei,CUIBin,QIUShuang,ZUOChang-jing.
DepartmentofNuclearMedicine,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
Correspondingauthor:ZUOChang-jing,Email:changjing.zuo@gmail.com
ObjectiveTo investigate the values of (18)F-FDG PET integrated with contrast enhance CT(CECT) in the differential diagnosis and staging of pancreatic cancer.MethodsRoutine PET/CT was performed in 52 patients with clinically and radiologically suspected pancreatic lesions who had never undergone enhanced CT scan. After routine PET/CT exams, CECT was immediately performed (PET/CECT), and the images of the two examinations were integrated for the diagnosis and differential diagnosis of pancreatic lesions. Pathological and follow-up results were used as golden standard, and the sensitivity, specificity and accuracy for PET/CECT and PET/CT in diagnosis of pancreatic cancer were evaluated. The early maximum standard uptake value (SUVmax) and delayed SUVmax were measured, and the retention index (RI) was calculated. In 24 patients with surgical operation and pathological results, the accuracy of PET/CECT and PET/CT in TNM staging of pancreatic cancer were compared.ResultsThe sensitivity, specificity and accuracy of PET/CECT in diagnosing pancreatic diseases were 100%, 88.2%, 96.2%, while those of PET/CT were 94.3%, 70.6%, 86.5%. In 35 malignant cases, the early SUVmax, delayed SUVmax and RI values were 8.4±3.4, 10.1±4.3 and (24.1±22.6)%, respectively. In 17 benign cases, the corresponding values were 4.5±3.9, 5.0±4.3 and (10.9±14.9)%, respectively. There were no significant differences of the RI values between malignant and benign lesions (P=0.064). Seventeen of 24 patients underwent surgery were diagnosed to have pancreatic cancer, the diagnostic accuracy of PET/CECT and PET/CT for T staging was 82.3% and 64.7%(P=0.032) while those for N staging was 91.7% and 83.3%(P=0.980).ConclusionsThe sensitivity, specificity and accuracy of PET/CECT for differential diagnosis of benign and malignant pancreatic diseases are higher than those of PET/CT and it can more accurately evaluate vascular and organ invasion than that of PET/CT. Therefore, PET /CECT can be taken as a one-shop-stop imaging for diagnosis and preoperative assessment for patients with pancreatic diseases.
Pancreatic neoplasms; Tomography,emission-computed; Tomography,X-ray computed; Deoxyglucose
2013-03-19)
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2013.04.003
上海领军人才队伍建设专项资金(2011-036);国家自然科学基金(81170435);国家自然科学基金(3097801)
200433 上海,第二军医大学长海医院核医学科(方艺、张建、崔莹、孙高峰、冯菲、崔斌、邱爽、左长京);徐州医学院医学影像学院(方艺)
共同第一作者:张建
左长京,Email:changjing.zuo@gmail.com
