MMI-166对人胰腺癌SW1990细胞凋亡及其相关蛋白表达的影响
2013-10-19高崇崇巩本刚夏修良宋德坤徐怀勇
高崇崇 巩本刚 夏修良 宋德坤 徐怀勇
·论著·
MMI-166对人胰腺癌SW1990细胞凋亡及其相关蛋白表达的影响
高崇崇 巩本刚 夏修良 宋德坤 徐怀勇
目的观察MMI-166对人胰腺癌SW1990细胞及其移植瘤组织凋亡相关蛋白表达的影响,探讨其可能机制。方法应用人胰腺癌细胞株SW1990建立裸鼠胰腺癌皮下移植瘤模型,按完全随机法将荷瘤裸鼠分为对照组和MMI-166组,分别给予口服生理盐水和MMI-166(200 mg·kg-1·d-1),持续28 d。采用TUNEL法和蛋白质印迹法检测移植瘤组织的细胞凋亡指数(AI)及p53、c-Myc、Bax、Bcl-2、Survivin、Caspase-1、Fas蛋白的表达。应用不同浓度(0、50、100 μg/ml)MMI-166作用于人胰腺癌SW1990细胞24 h,蛋白质印迹法检测c-Myc、Survivin的表达。结果MMI-166组移植瘤组织的AI为81.1±7.9,显著高于对照组的21.3±2.2(P=0.000);c-Myc、Survivin的表达量分别为7715±2229、4594±1240,显著低于对照组的16870±2446、15208±1903(P值均为0.000);p53、Bax、Bcl-2、Caspase-1、Fas的表达与对照组比较无显著变化。50、100 μg/ml的MMI-166处理后,人胰腺癌SW1990细胞的c-Myc表达量显著下调(0.098±0.003、0.073±0.008比0.169±0.007,F=189.361,P<0.05);Survivin的表达量无明显变化。结论MMI-166可能通过下调c-Myc的表达诱导人胰腺癌SW1990细胞凋亡。
胰腺肿瘤; MMI-166; 金属蛋白酶类组织抑制剂; 细胞凋亡
细胞凋亡减少已被证实是多种肿瘤致病机制之一[1],研究细胞凋亡的调节机制对于人们认识肿瘤发病机制及新的防治方法具有重要意义。MMI-166是第三代新型基质金属蛋白酶(MMPs)抑制剂,可选择性抑制MMP-2、MMP-9的活性。我们前期的实验证实,MMI-166在体外呈浓度及时间依赖性促进人胰腺癌SW1990细胞凋亡[2]。本研究进一步通过体内实验观察MMI-166对凋亡相关蛋白表达及细胞凋亡的影响,并通过体外实验探讨MMI-166与c-Myc、Survivin表达的量效关系。
材料与方法
一、人胰腺癌裸鼠皮下移植瘤模型的建立
BALB/c裸鼠20只,4~5周龄,雄性,体重18~22 g,购自上海斯莱克动物中心,在无特定病原体动物(SPF)条件下饲养。人胰腺癌SW1990细胞株购自上海细胞库,常规培养、传代。取对数生长期细胞,用无血清L-15培养基调整细胞浓度,按1×107/只密度接种于裸鼠背部皮下。约7 d后裸鼠背部均有移植瘤生长,成瘤率100%。按完全随机法将裸鼠分成对照组及MMI-166组。对照组裸鼠口服生理盐水,MMI-166组裸鼠口服MMI-166 200 mg·kg-1·d-1(日本SHIONOGI公司免费提供),连服28 d。实验结束处死裸鼠,取移植瘤标本,用10%中性甲醛固定,石蜡包埋,连续切片。
二、免疫组织化学染色检测p53、c-Myc、Bax、Bcl-2、Survivin、Caspase-1、Fas蛋白
p53、c-Myc、Bax、Bcl-2、Survivin、Caspase-1、Fas抗体均购自福州迈新公司,二抗购自PAKD公司,每种抗体重复检测3次。随机取10个100倍视野,应用Image-pro Plus6.0软件计算吸光值,取均值表示蛋白表达量。
三、细胞凋亡指数(AI)检测
采用TUNEL法检测凋亡细胞,试剂盒购自德国罗氏公司,按说明书操作。细胞核中出现深棕色为凋亡细胞。每例切片至少计数10个400倍视野,以平均每1000个细胞中的凋亡细胞百分数为AI值。每次实验均设阴性对照片(即加不含TdT酶的反应液)和阳性对照片(DNA内切酶预处理过的组织切片)。
四、c-Myc、Survivin蛋白表达检测
应用0、50、100 μg/ml的MMI-166处理SWl990细胞24 h,收集细胞,应用细胞裂解液裂解。蛋白定量后常规行蛋白质印迹法检测c-Myc、Survivin表达,以GAPDH作为内参,应用ImageJ软件分析。以目的条带与内参条带灰度比值表示蛋白表达量。
五、统计学处理
结 果
一、裸鼠移植瘤组织的凋亡指数
凋亡细胞的胞核呈深棕色,染色质浓缩、边缘化,核膜裂解。凋亡细胞呈单个散在分布和(或)簇状分布(图1)。MMI-166组移植瘤的AI为81.1±7.9,显著高于对照组的21.3±2.2(P=0.000)。
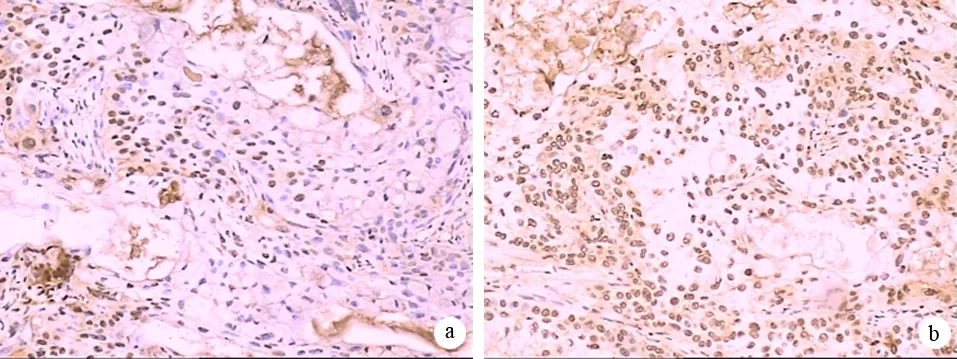
图1对照组(a)及MMI-166组(b)的凋亡细胞(TUNEL法 ×100)
二、裸鼠移植瘤p53、c-Myc、Bax、Bcl-2、Survivin、Caspase-1、Fas的表达
Bax、Bcl-2、Survivin、Caspase-1定位于细胞质,p53定位于细胞核,Fas定位于细胞膜,c-Myc定位于细胞核与细胞质。MMI-166组移植瘤组织c-Myc、Survivin蛋白表达显著低于对照组(P值均<0.01),而p53、Bax、Bcl-2、Caspase-1、Fas表达与对照组均无统计学意义(图2、表1)。裸鼠移植瘤组织c-Myc、Survivin表达与细胞凋亡呈显著负相关关系(r=-0.858,r=-0.939;P=0.000)。

图2对照组(上)及MMI-166组(下)移植瘤组织c-Myc(a)、Survivin(b)、p53(c)、Fas(d)、Bax(e)、Bcl-2(f)及Caspase-1(g)蛋白表达(EnVision×100)
表1 两组胰腺癌移植瘤c-Myc、Survivin、p53、Fas、Bax、Bcl-2、Caspase-1蛋白表达及
三、SW1990细胞c-Myc、Survivin蛋白的表达
对照组SW1990细胞的c-Myc、Survivin蛋白表达量分别为0.169±0.007和0.391±0.006。50、100 μg/ml的MMI-166处理SW1990细胞24 h后,c-Myc表达量分别为0.098±0.003、0.073±0.008,随着药物浓度增加表达量逐渐减少,组间差异有统计学意义(F=189.361,P<0.05);Survivin表达量分别为0.395±0.006、0.382±0.004,各组间差异无统计学意义(F=4.328,P>0.05,图3)。
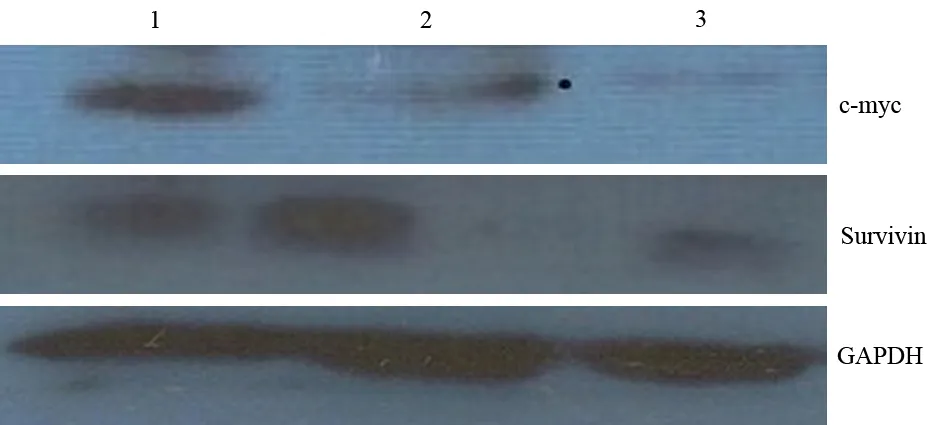
1:对照组,2:50 μg/ml MMI-166处理组;3.100 μg/ml MMI-166处理组
图3各组SW1990细胞的c-Myc、Survivin表达
讨 论
细胞凋亡又称为程序性细胞死亡(PCD),是多细胞生物体内一种由生化调控引起的细胞自杀形式,它在组织分化、器官形成和抵御疾病方面起着重要的作用。细胞凋亡的途径主要有两条,一条是通过胞外信号激活细胞内的凋亡酶caspase,一条是通过线粒体释放凋亡酶激活因子激活caspase。这些活化的caspase可将细胞内的重要蛋白降解,引起细胞凋亡。细胞凋亡的调控涉及许多基因,包括一些与细胞增殖和凋亡有关的原癌基因和抑癌基因,其中研究较多的有p53、c-Myc、Bax、Bcl-2、Survivin、Caspase-1、Fas等。本研究结果显示,MMI-166处理组移植瘤的细胞凋亡指数显著高于对照组,表明MMI-166在体内具有促进细胞凋亡的作用。
文献报道,c-Myc是一类“快速早期反应”的细胞内信使,其表达使细胞进入细胞周期,在某些生长因子的刺激下促使细胞增殖[3]。李胜等[4]研究发现,原发胰腺癌和胰腺癌转移瘤组织中c-Myc的表达明显高于胰腺良性病变组织。Orian等[5]研究了62例脑星形细胞瘤,发现低、中、高度恶性肿瘤组织的c-Myc蛋白过表达率分别为5%、33%和76%,差异具有统计学意义。他们认为c-Myc蛋白高表达意味着有相当高比例的细胞处于增殖状态,而凋亡受抑制是肿瘤进展的重要指标,患者预后极差。Survivin是凋亡抑制蛋白(IAP)中分子质量最小和最具有基础与临床意义而倍受关注的分子。Sarela等[6]报道,52例胰腺癌组织的Survivin阳性率为88%,Survivin阳性时凋亡指数低,而凋亡指数低的患者预后明显差于凋亡指数高的患者。推测细胞凋亡的增加与c-Myc、Survivin的表达下降有关。本研究结果显示,MMI-166处理人胰腺癌SW1990细胞24 h后c-Myc的表达下调,而Survivin的表达无明显变化,推测MMI-166促进胰腺癌细胞凋亡与c-Myc基因表达下调有关。Survivin表达虽无明显变化,但不排除样本量及蛋白浓度等因素的影响,因此MMI-166对Survivin表达的影响仍需进一步研究。
Meyer等[7]报道,MMP-9和MMP-10保护结肠腺癌细胞免于PKC/p53诱导的凋亡。Chetty等[8]报道,MMP-2可以通过改变Bax/Bcl-2表达,诱导Caspase-3、8、9以及PARP-1分裂体形成,诱导Fas/FasL的活化等途径抑制肺腺癌细胞的凋亡。由于MMI-166抑制MMP-2、MMP-9的活性[9],提示MMI-166可能通过抑制MMP-2、9表达而下调c-Myc的表达,从而促进胰腺癌细胞凋亡,但其具体机制待进一步研究。
[1] Kerr JF,Winterford CM,Harmon BV, et al. Apoptosis: its signficance in cancer and cancer therapy.Cancer,1994,73: 2013-2026.
[2] 巩本刚,徐怀勇,成丕光,等.MMI-166对人胰腺癌细胞株SW1990体外增殖及凋亡的影响.中华胰腺病杂志,2012,12:100-102.
[3] Dang CV,Resar LM,Emison E,et al.Function of the c-Myc oncogenic transcription factor.Exp Cell Res,1999,253:63-77.
[4] 李胜,石学涛,张鑫,等.胰腺癌中bcl-2的表达与细胞凋亡及癌基因c-myc表达的关系.肝胆胰外科杂志,2001,13:204-207.
[5] Orian JM,Vasilopoulos K,Yoshida S,et al.Overexpression of multiple oncogenes related to histological grade of astrocytic glioma.Br J Cancer,1992,66:106-112.
[6] Sarela AI,Verbeke CS,Ramsdale J,et al.Expression of survivin,a novel inhibitor of apoptosis and cell cycle regulatory protein,in pancreatic adenocarcinoma.Br J Cancer, 2002,86:886-892.
[7] Meyer E,Vollmer JY,Bovey R,et al.Matrix metalloproteinases 9 and 10 inhibit protein kinase C-potentiated,p53-mediated apoptosis. Cancer Res,2005,65:4261-4272.
[8] Chetty C,Bhoopathi P,Lakka SS,et al.MMP-2 siRNA induced Fas/CD95 mediated extrinsic II apoptotic pathway in the A549 lung adenocarcinoma cell line.Oncogene,2007,26:7675-7683.
[9] Tamura Y, Watanabe H, Nakatani T, et al. Highly selective and orally active inhibitors of type IV collagenase (MMP-9 and MMP-2): Nsulfonylamino acid derivatives. J Med Chem, 1998, 41: 640-649.
(本文编辑:吕芳萍)
EffectsofMMI-166onapoptosisandapoptosis-relatedproteinexpressioninhumanpancreaticcancerSW1990cells
GAOChong-chong,GONGBen-gang,XIAXiu-liang,SONGDe-kun,XUHuai-yong.
BinzhouMedicalCollege;DepartmentofHepatobiliarySurgery,BinzhouPeople′sHospital,BinzhouMedicalCollege,Binzhou256600,ChinaCorrespongdingauthor:GONGBen-gang,Email:shenglixiyuan@163.com
ObjectiveTo investigate the effects of MMI-166 on apoptosis and apoptosis-related protein expression of human pancreatic cancer SW1990 cells and its transplanted tumor, and explore possible mechanism.MethodsThe human pancreatic cancer xenograft model was constructed by using human pancreatic cancer SW1990 cells. Tumor-bearing nude mice were randomly divided into control and MMI-166 groups, and they were treated with normal saline or MMI-166 (200 mg·kg-1·d-1) for 28 days. Apoptosis index (AI), p53, c-Myc, Bax, Bcl-2, Survivin, Caspase-1, Fas proteins were detected by deoxynucl-eotidyl transferase-mediated nick end labeling (TUNEL method) and Western blot. MMI-166 of different concentrations (0, 50, 100 μg/ml) were used to treat human pancreatic cancer SW1990 cell for 24 h. The c-Myc, Survivin proteins expressions were measured by Western blotting.ResultsApoptosis index in MMI-166 group was 81.1±7.9, which was significantly higher than that in control group (21.3±2.2,P=0.000); the expressions of c-Myc, Survivin were 7715±2229, 4594±1240, which were significantly higher than those in control group (16870±2446, 15208±1903,P=0.000); the expressions of p53, Bax, Bcl-2, Caspase-1, Fas were not significantly different from those in control group. After 50, 100 μg/ml MMI-166 treatment, the expression of c-Myc was significantly down-regulated (0.098±0.003, 0.073±0.008vs. 0.169±0.007,F=189.361,P<0.05); and the expression of Survivin was not significantly changed.ConclusionsMMI-166 may induce cell apoptosis of SW1990 by down-regulating the expression of c-Myc.
Pancreatic neoplasm; MMI-166; Tissue inhibitor of metalloproteinases; Apoptosis
10.3760/cma.j.issn.1674-1935.2013.01.008
滨州市科技发展计划项目
256600 山东,滨州医学院临床学院(高崇崇、宋德坤);滨州医学院附属滨州市人民医院肝胆外科(巩本刚、夏修良、徐怀勇)
巩本刚,Email:shenglixiyuan@163.com
2012-09-13)
