MicroRNA-196a抑制序列对人胰腺癌PANC1细胞株HOXB8基因表达的影响
2013-10-19刘明浩杜奕奇刘建强高军吴洪玉龚艳芳李兆申
刘明浩 杜奕奇 刘建强 高军 吴洪玉 龚艳芳 李兆申
·论著·
MicroRNA-196a抑制序列对人胰腺癌PANC1细胞株HOXB8基因表达的影响
刘明浩 杜奕奇 刘建强 高军 吴洪玉 龚艳芳 李兆申
目的观察microRNA-196a(miR-196a)抑制序列转染胰腺癌细胞株PANC1后对其HOXB8基因表达的影响。方法将PANC1细胞分为对照组、miR-196a抑制序列组和siRNA对照组。采用脂质体法将miR-196a抑制序列及对照siRNA分别转染PANC1细胞。应用RT-PCR和蛋白质印迹法检测转染细胞miR-196a及其下游靶基因HOXB8 mRNA和蛋白的表达。结果转染miR-196a抑制序列后,PANC1细胞miR-196a表达量较siRNA对照组显著减少(0.050±0.054比0.839±0.025,t=3.12,P<0.05);HOXB8 mRNA表达量较siRNA对照组增高1.57倍(2.20±0.07比1.29±0.10,t=3.86,P<0.05);HOXB8蛋白表达量也显著增强(0.90±0.03比0.40±0.10,t=3.11,P<0.05)。结论miR-196a可以下调HOXB8基因的表达。
胰腺肿瘤; 微小RNA; miR-196a; HOXB8
MicroRNAs(miRNAs)是长度为18~25碱基的内源性非编码小分子RNA,其通过与靶mRNA3′端相结合导致mRNA降解或翻译受抑制从而调节基因
的表达[1]。MicroRNA-196a(miR-196a)作为一种miRNA,可以在转录后水平调节细胞基因的表达[2]。目前研究发现,胰腺癌miR-196a高表达提示患者预后较差[3]。我们通过Targetscan miRNA靶基因预测软件发现,HOXB8与miR-196a存在高度同源序列。而HOXB8基因能特异性地调节人体的发育,其过表达与结直肠癌相关[4]。为此,本研究应用miR-196a抑制序列转染胰腺癌PANC1细胞,观察转染后细胞的HOXB8基因表达。
材料与方法
一、细胞培养及miR-196抑制序列转染
PANC1胰腺癌细胞株购于中国科学院细胞库,常规培养、传代。接种细胞于25 cm2培养瓶,分为空白对照组、miR-196a抑制序列(antagomir,GeneCopoeia)组和siRNA对照组。待细胞生长至60%~70%融合时进行转染。空白对照组培养液中只加lipofactamine 2000;miR-196a抑制序列组培养液中加lipofactamine 2000和miR-196a抑制序列(75 nmol/L);siRNA对照组培养液中加lipofactamine 2000和与miR-196a不匹配的siRNA(75 nmol/L)。miR-196a抑制序列、不匹配的对照siRNA均购自Ambion公司,lipofactamine 2000转染试剂盒购自Invitrogen公司,按照说明书操作,48 h后收集细胞。
二、实时定量PCR
采用Trizol试剂(Invitrogen公司)提取各组细胞总RNA。分光光度计法测定RNA纯度和浓度。miR-196a反转录试剂盒及PCR试剂盒均购自Invitrogen公司。miR-196a序列为UAGGUAGUU-UCAUGUUGUUGGG(MIMAT 0000226)。在此基础上设计针对miR-196a的具有茎-环结构序列:5′-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTG-CACTGGATACCCCAAC-3′。其上游及下游引物分别为GGGCTAGGTAGTTTCATGTTG及AGTGCGTGT-CGTGGAGTC。以U6作为内参,上游及下游引物分别为CTCGCTTCGGCAGCACA及AACGCTTCA-CGAATTTGCGT。先行逆转录反应,反应条件:16℃ 30 min,42℃ 30 min,85℃ 5 min,4℃保存待分析。PCR反应条件:95℃ 10 min,95℃ 15 s、60℃ 30 s,40个循环。利用Real-time PCR仪自带软件获得Ct值,通过公式2-ΔΔCt计算Relative Quantification(RQ)值。实验重复3次,取均值。
HOXB8引物上、下游序列分别为5′-CCATAA-AGCAATTCACAGATAGAGG-3′及5′-GGTTGCGAGGAAAGATG-3′,由上海英俊生物有限公司合成。应用SYBR Green法检测HOXB8 mRNA,以GAPDH为内参,试剂盒购于Invitrogen公司。反应条件:94℃ 5 min,94℃ 30 s、58℃或60℃ 30 s、72℃ 30 s,35个循环,最后72℃ 5 min。mRNA表达量计算方法同上,实验重复3次,取均值。
三、蛋白质印迹法
提取细胞总蛋白,定量后常规行蛋白质印迹法检测HOXB8蛋白表达。鼠抗人HOXB8一抗购自Abcam公司(Ab86610),工作浓度1∶800;羊抗鼠IgG购自Abcam公司,工作浓度1∶1000;DAB显色液购自Thermo公司。应用BIORAD Flour-S Muilti-Imager凝胶成像仪摄片,用ImageJ 1.42q分析软件分析条带灰度,以目的条带与内参β-actin条带灰度比值表示蛋白的表达水平。
四、统计学处理
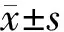
结 果
一、各组细胞miR-196a的表达
空白对照组、siRNA对照组、miR-196a抑制序列组细胞的miR-196a表达量分别为0.840±0.025、0.839±0.025、0.050±0.054。miR-196a抑制序列组miR-196a表达较siRNA对照组显著下降(t=3.12,P<0.05),而两对照组间的差异无统计学意义(P>0.05,图1)。
二、各组细胞HOXB8 mRNA的表达
空白对照组、siRNA对照组、miR-196a抑制序列组细胞的HOXB8 mRNA表达量分别为1.00±0.05、1.29±0.10、2.20±0.07。miR-196a抑制序列组的HOXB8 mRNA表达量较空白对照组增高2.2倍(t=4.45,P<0.05),较siRNA对照组增高1.57倍(t=3.86,P<0.05),而两对照组间的差异无统计学意义(P>0.05,图1)。
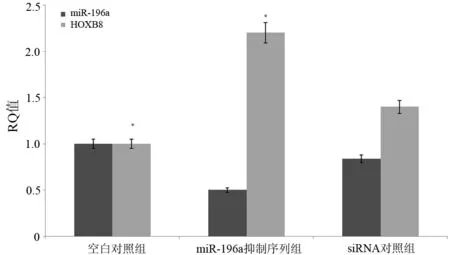
图1 miR-196a及HOXB8 mRNA的表达
三、各组细胞HOXB8蛋白的表达
空白对照组、siRNA对照组、miR-196a抑制序列组细胞的HOXB8蛋白表达量分别为0.30±0.06、0.40±0.10、0.90±0.03。miR-196a抑制序列组HOXB8蛋白表达较其他两组均显著增加(t=3.34,P<0.05;t=3.11,P<0.05),而两对照组间的差异无统计学意义(P>0.05,图2)。

图2 HOXB8蛋白的表达
讨 论
目前研究已经证实miRNAs可能作为胰腺癌的癌基因或者抑癌基因参与其发生、发展[3]。Zhang等[5]检测了10种胰腺癌细胞株及17例胰腺癌与配对癌旁正常胰腺组织的标本,有7种miRNA在胰腺癌细胞株及组织中表达显著升高,包括miR-196a、miR-190、miR-186、miR-221、miR-222、miR-200b、miR-15b。Wang等[6]报道,胰腺导管腺癌患者血清miR-196a水平较正常人血清miR-196a水平显著增高。Bloomston等[3]报道,高表达miR-196a的胰腺癌患者的预后较低表达患者差。Hoffman等[7]报道, miR-196a高表达人群的乳腺癌患病率较低,提示miR-196a在乳腺癌中作为一种抑癌基因。Schimanski等[8]研究证实miR-196a在结直肠癌中表达显著升高,并且与结直肠癌细胞的迁移、侵袭及对化疗药物的敏感性有关,但与癌细胞的增殖及凋亡无关。Maru等[9]报道,Barrett′s食管患者miR-196a表达较正常人显著增强,并且证实KRT5、SPRR2C和S100A9为miR-196a的靶基因。Qiu等[10]报道,miR-196a与非洲爪蟾的眼部发育有关,预示miR-196a可能作为治疗眼部疾病的新的基因靶点。最近的研究[11]发现,miR-196a在黑色素瘤细胞表达较正常的黑色素细胞低,以上报道均说明miR-196a在肿瘤发生、发展中起着重要的作用。本实验结果显示,miR-196a在胰腺癌细胞株及组织中表达显著增强,表明miR-196a参与胰腺癌的发生,起着癌基因的作用。
我们通过miRNA靶基因预测软件发现HOXB8可能为miRNA下游靶基因。文献报道HOXB8基因与哺乳动物胚胎发育相关,miR-196a可通过负调节HOXB8基因影响器官的发育[12]。最近报道HOXB8基因与结肠癌等肿瘤的发生、发展也存在一定相关性[13]。本研究将miR-196a抑制序列转染PANC1细胞,结果显示转染后的PANC1细胞的HOXB8 mRNA和蛋白的表达增强,证实miR-196a是负调控HOXB8基因的,其调控机制需进一步探讨。
[1] Ambros V. The functions of animal microRNAs.Nature, 2004,431:350-355.
[2] Bentwich I, Avniel A, Karov Y, et al. Identification of hundreds of conserved and nonconserved human microRNAs, Nat Genet, 2005,37:766-770.
[3] Bloomston M, Frankel WL, Petrocca F, et al. MicroRNA expression patterns to differentiate chronic pancreatitis. JAMA,2007, 297:1901-1908.
[4] Kosaki K, Kosaki R, Suzuki T, et al.Complete mutation analysis panel of the 39 human HOX genes.Teratology,2002,65:50-62.
[5] Zhang Y, Li M, Wang H, et al. Profiling of 95 microRNAs in pancreatic cancer cell lines and surgical specimens by real-time PCR analysis. World J Surg, 2009, 33:698-709.
[6] Wang J, Chen J, Chang P, et al. MicroRNAs in plasma of pancreatic ductal adenocarcinoma patients as novel blood-based biomarkers of disease.Cancer Prev Res, 2009,2: 807-813.
[7] Hoffman AE, Zheng T, Yi C, et al. microRNA miR-196a-2 and breast cancer: a genetic and epigenetic association study and functional analysis. Cancer Res, 2009, 69:5970-5977.
[8] Schimanski CC,Frerichs K, Rahman F, et al. High miR-196a levels promote the oncogenic phenotype of colorectal cancer cells. World J Gastroenterol, 2009,15:2089-2096.
[9] Maru DM, Singh RR, Hannah C, et al. MicroRNA-196a is a potential marker of progression during Barrett′s metaplasia-dysplasia-invasive adenocarcinoma sequence in esophagus. Am J Pathol, 2009, 174: 1940-1948.
[10] Qiu R,Liu Y, Wu JY, et al. Misexpression of miR-196a induces eye anomaly in Xenopus laevis. Brain Res Bull, 2009, 79: 26-31.
[11] Braig S, Mueller DW, Rothhammer T, et al. MicroRNA miR-196a is a central regulator of HOX-B7 and BMP4 expression in malignant melanoma. Cell Mol Life Sci, 2010, 67: 3535-3548.
[12] Mansfield JH, Harfe BD, Nissen R, et al. MicroRNA responsive “sensor” transgenes uncover Hox-like and other developmentally regulated patterns of vertebrate microRNA expression. Nat Genet, 36:1079-1083.
[13] Schimanski CC, Frerichs K, Rahman F, et al. High miR-196a levels promote the oncogenic phenotype of colorectal cancer cells. World J Gastroenterol, 2009,15: 2089-2096.
(本文编辑:屠振兴)
EffectsofmicroRNA-196ainhibitorysequencesonHOXB8expressioninhumanpancreaticcancerPANC1cells
LIUMing-hao,DUYi-qi,LIUJian-qiang,GAOJun,WUHong-yu,GONGYan-fang,LIZhao-shen.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
LIZhao-shen,Email:zhsli@81890.net
ObjectiveTo investigate the effects of microRNA-196a(miR-196a) inhibitory sequences transfection on HOXB8 expression in PANC1 cells.MethodsPANC1 cells were divided into control group, miR-196a inhibitory sequences group and siRNA control group. Liposomal transfection method was applied to transfect miR 196a inhibitory sequences and siRNA control into PANC1 cells. RT-PCR and Western blot were used to detect the expressions of miR-196a and HOXB8 mRNA and protein.ResultsAfter miR-196a inhibitory sequences transfection, when compared with that of siRNA control group, the expression of miR-196a was significantly decreased (0.05±0.054vs. 0.839±0.025,t=3.12,P<0.05); and the expression of HOXB8 mRNA was significantly increased by 1.57 folds (2.20±0.07vs. 1.29±0.10,t=3.86,P<0.05), the expression of HOXB8 protein was also obviously increased (0.90±0.03vs. 0.40±0.10,t=3.11,P<0.05).ConclusionsMicroRNA-196a down-regulates the expression of HOXB8.
Pancreatic neoplasms; MicroRNA; MicroRNA-196a; HOXB8
10.3760/cma.j.issn.1674-1935.2013.01.005
国家自然基金面上项目(30971344);上海市科委基础研究重点项目(11JC1416402)
200433 上海,第二军医大学长海医院消化内科
李兆申,Email:zhsli@81890.net
2011-07-18)
