响应面法优化三叶草中类黄酮提取工艺
2013-10-16陈春刚韩芬霞王媛媛
陈春刚,韩芬霞,王媛媛
(河南科技学院,河南新乡453003)
近年来,世界上掀起了活性物质开发的热潮,开发为人类健康造福的天然植物资源已被认为是世界上最具前景、最有现实意义的行业之一.一些特效天然药物成分常因资源稀少、含量低而限制了开发应用.类黄酮(flavonoids)是自然界存在的一大类酚类物质,是一组广泛存在于植物的叶、花、果中的天然色素,因多呈黄色而被称为类黄酮,至今科学家已发现4 000多种类黄酮物质[1].天然来源的生物黄酮分子量小,能通过血脑屏障,能进入脂肪组织,具有消除疲劳、保护血管、防动脉硬化、疏通微循环脂肪氧化、活化大脑及其他脏器细胞的功能[2-3].
三叶草(Trifolium repens L.)是豆科(Leguminosae)草本植物,全世界大约有250余种[4],广泛分布于温带及亚热带地区,我国该植物资源亦十分广泛.三叶草营养成分十分丰富,其中蛋白质含量45%~65%,可利用碳水化合物含量5%~20%,粗纤维含量为0.5%~1.5%,脂肪7%~25%,灰分0.5%~1.5%[5],是牛、羊很好的饲料.在许多国家己成为人们的传统食品和调味品,在我国民间也用其花、种子、植株及根部制膏、煎剂和泡茶饮用,具有治疗咳嗽、镇痛和祛痰作用[6].现代医学研究证明,三叶草属植物具有抗癌、抗肿瘤、防治骨质疏松、调节激素平衡、抗自由基、降血压等多方面的药理作用.目前,三叶草的提取物异黄酮是国际上公认的治疗更年期综合症疗效确切的植物药[7],其销量在美国多年来一直名列植物药的前10位[8],因而三叶草具有非常广阔的开发前景.
本课题组发现在河南省新乡市地区广泛分布的三叶草植物富含类黄酮,具有很高的开发价值.本文拟利用响应面法对三叶草中活性物质的提取工艺进行优化,旨在为三叶草中类黄酮类物质的工业化提取提供依据,以充分发掘其潜在利用价值.
1 材料与方法
1.1 材料与试剂
三叶草;乙醇,芦丁,氢氧化钠,硼酸,亚硝酸钠,硝酸铝(以上试剂均为分析纯,由天津科密欧公司提供);试验用水均为蒸馏水,由河南科技学院化学化工学院提供.
1.2 主要仪器
MD100-2电子天平(广州红星仪器有限公司);DHG-9000A恒温干燥箱(上海博迅公司医疗设备厂);LGJ-18冷冻干燥机(北京四环科学仪器厂);Fw-400A倾斜式高速万能粉碎机(北京中兴伟业仪器有限公司);7200分光光度计(上海尤尼科仪器有限公司);HH-4恒温水浴锅(杰瑞尔电器有限公司).
1.3 试验方法
1.3.1 样品处理 将新鲜三叶草清洗干净后,冷冻干燥,粉碎,原料粒径最好在0.2~0.5 mm,最大不超过1 mm.原料粒径过大,给提取造成困难,粒径过小,给后续分离操作带来困难.
1.3.2 总类黄酮的鉴定和含量测定 先采用镁粉盐酸反应实验(取乙醇提取液1 mL于试管中加镁粉,再加入浓盐酸数滴,观察其颜色的变化)对提取物进行鉴定.参照参考文献[9]绘制芦丁浓度-吸光度标准曲线,然后根据参照文献[10]测定样品中总类黄酮的含量.
1.3.3 样品中类黄酮的提取 称取1 g左右经过脱脂处理的样品,放入150 mL锥形瓶中,加入一定体积、一定体积分数的乙醇溶液,在确定的温度下,振荡提取一定时间.提取完毕后,立刻抽滤,用乙醇溶液洗涤锥形瓶和抽滤瓶,滤液和洗液转入50 mL容量瓶,定容后,充分混合.准确称取1 mL定容液于25 mL容量瓶中,用体积分数为30%的乙醇补充至12.5 mL,加入0.7 mL质量分数为5%的亚硝酸钠溶液,摇匀放置5 min后加入0.7 mL质量分数为10%的硝酸铝溶液,6 min后再加入1 mol/L的氢氧化钠溶液5 mL混合均匀,用体积分数为30%的乙醇稀释至刻度,10 min后于波长500 nm处测定吸光度,同时做空白实验.然后在芦丁浓度吸光度的标准曲线上查出相应的类黄酮含量.黄酮提取率按以下公式计算:
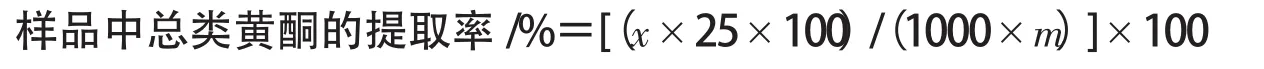
式中:x为工作曲线上相应的芦丁浓度(/g/L);m为样品质量/g.
1.3.3.1 样品中类黄酮提取的单因素试验 选取水浴温度、乙醇体积分数、提取时间、液固比4个可能影响提取效果的因素做单因素试验,以三叶草类黄酮的提取率为指标,确定相关因素的取值范围.
1.3.3.2 样品中类黄酮提取的响应面试验 根据单因素试验所确定的取值范围,采用Design-Expert Software7.0中RSM设计方法,进行水浴温度、乙醇体积分数、提取时间、液固比的4因素3水平共21个响应面分析试验(包括4个中心点).
2 结果与分析
2.1 类黄酮物质的定性试验结果
按照1.3.2的方法发现形成了紫红色的物质,发生了类黄酮类物质的特有反应,可以认为提取物中含有类黄酮类物质.
2.2 类黄酮总量及提取率
2.2.1 芦丁标准曲线 用MirosoftExcel做最小二乘法的线性回归得吸光度与芦丁浓度的工作曲线为:y=14.945x-0.014 4,相关系数R2=0.999.
2.2.2 类黄酮含量
2.2.2.1 单因素试验设计 选取提取时间、液固比、温度和乙醇体积分数作为主要影响因素,其单因素试验结果分别如图1至图4所示.
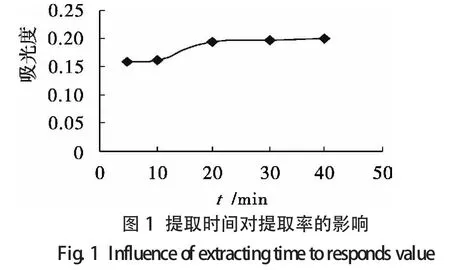
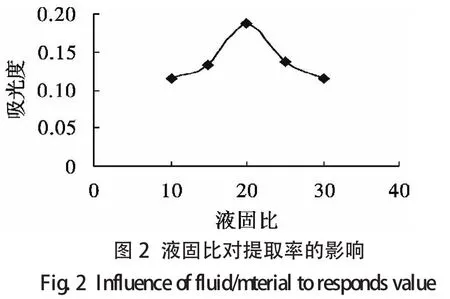
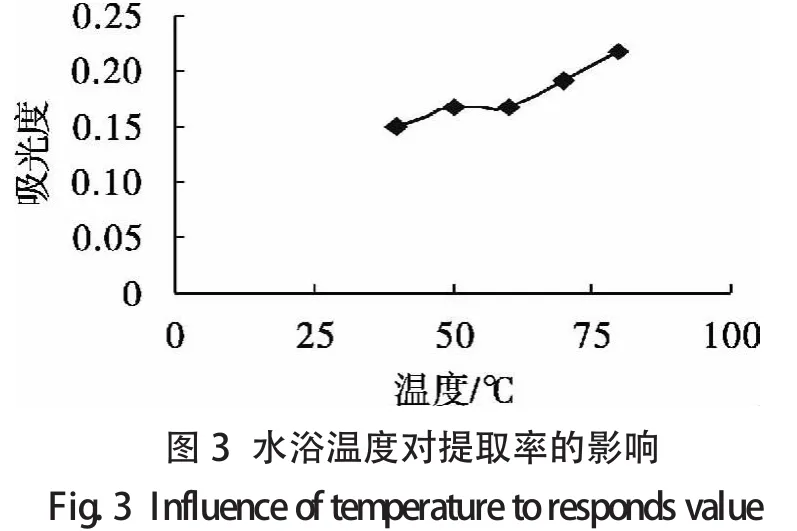
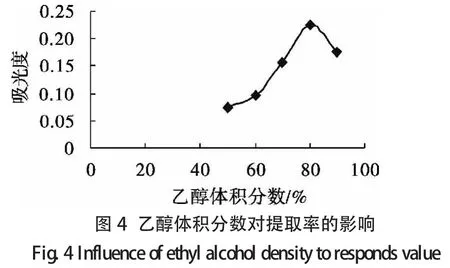
由单因素分析可知各个单因素对类黄酮提取率的影响程度,可以得到每个单因素的响应面试验的范围(见表1).
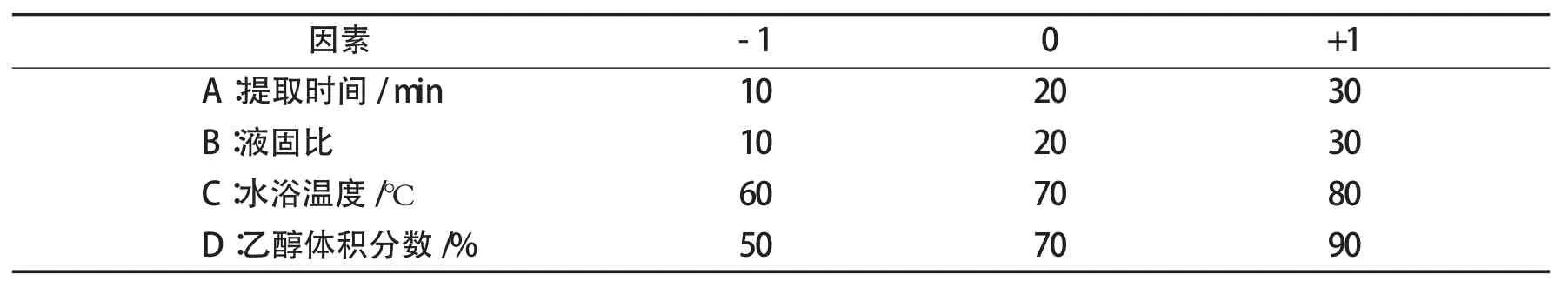
表1 响应面试验中各因素的取值范围Tab.1 Single factor rang for RSM experimental design
2.2.2.2 响应面分析 使用Design-ExpertSoftware7.0中的响应面设计法(RSM),进行水浴温度、乙醇体积分数、提取时间、液固比的4因素3水平共21个试验(包括4个中心点)的响应面分析.试验结果如表2所示.
Design-E xpertSoftware7.0对表2中的试验数据进行分析后推荐使用“Quadratic”(二次方程式)的数学模型.黄酮提取率的数学模型如下:
提取率 /%=6.472 53-0.028 585×A+0.721 16×B-0.478 59×C+0.116 19×D-3.850 00E-0.03×A×B+1.475 00E-0.03×A×C+7.875 00E-0 04×A×D+5.000 00E-0.04×B×D-7.000 00E-0.04×B×D-4.750 00E-0.04×C×D-1.419 75E-0 03×A2-0.015 079×B2+3.530 25E-0 03×C2-5.674 36E-0 04×D2.
式中,A为提取时间,B为液固比,C为水浴温度,D为乙醇体积分数.
表3为方差分析表.由表3可知,P=0.022 6,说明应变量与全体自变量之间的线性关系显著,即这种试验方法可靠.在本试验设定的区域范围内,只有水浴温度对三叶草中总类黄酮的提取率影响显著(P<0.05),而提取时间、乙醇体积分数、液固比以及它们之间的交互作用均对提取率的影响不显著(P>0.05).
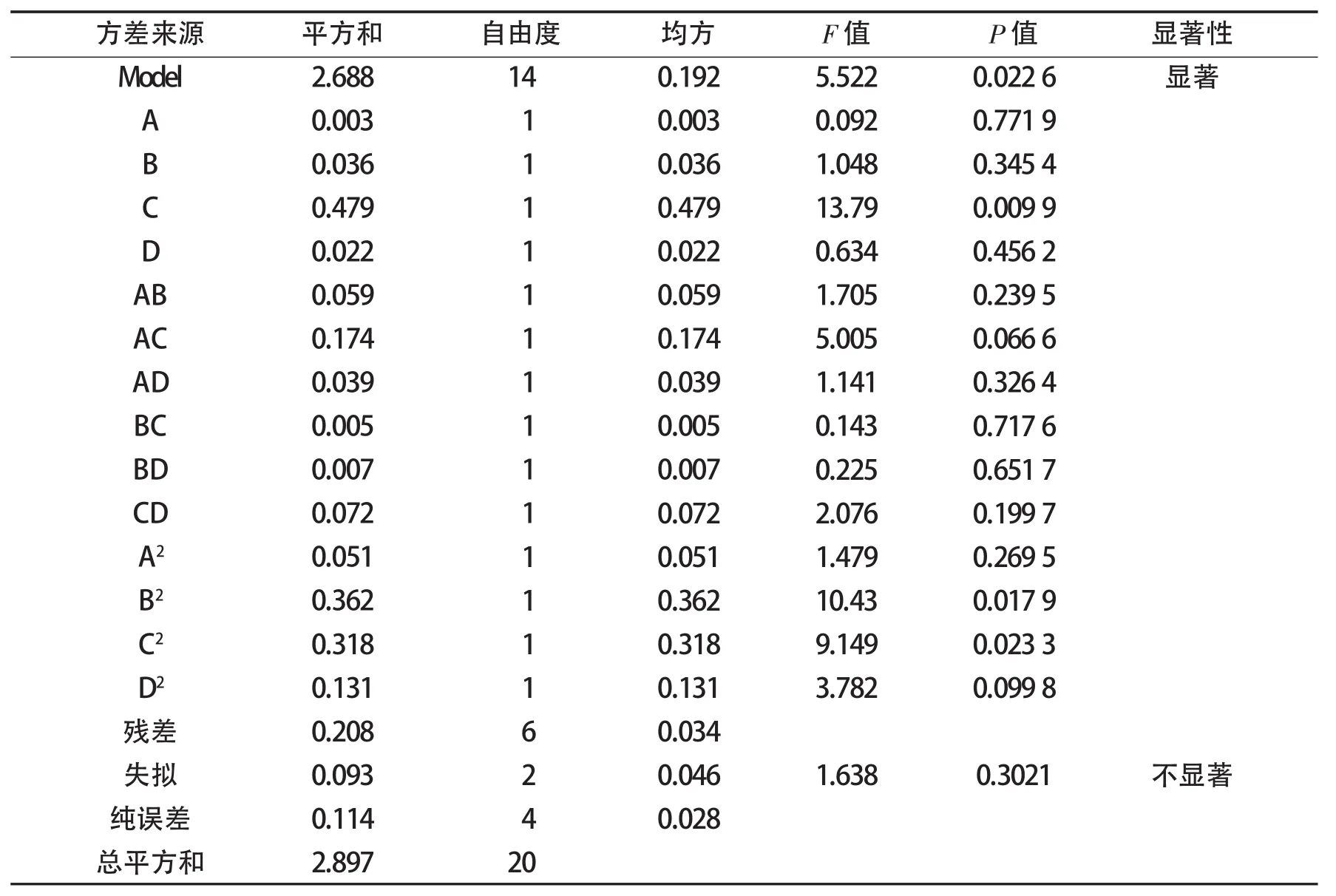
表3 响应面分析表Tab.3 Response surface experimental analytical table
RSA方法的图形如图5至图8所示.图5、图6、图7、图8中图形是特定响应值Y分别与对应的因素A、B、C、D构成的一个三维空间图,可以直观地反映各因素以及它们之间的交互作用对响应值的影响.从试验所得响应值分析图可看出它们在反应过程中的相互关系,确定合适的工艺条件.
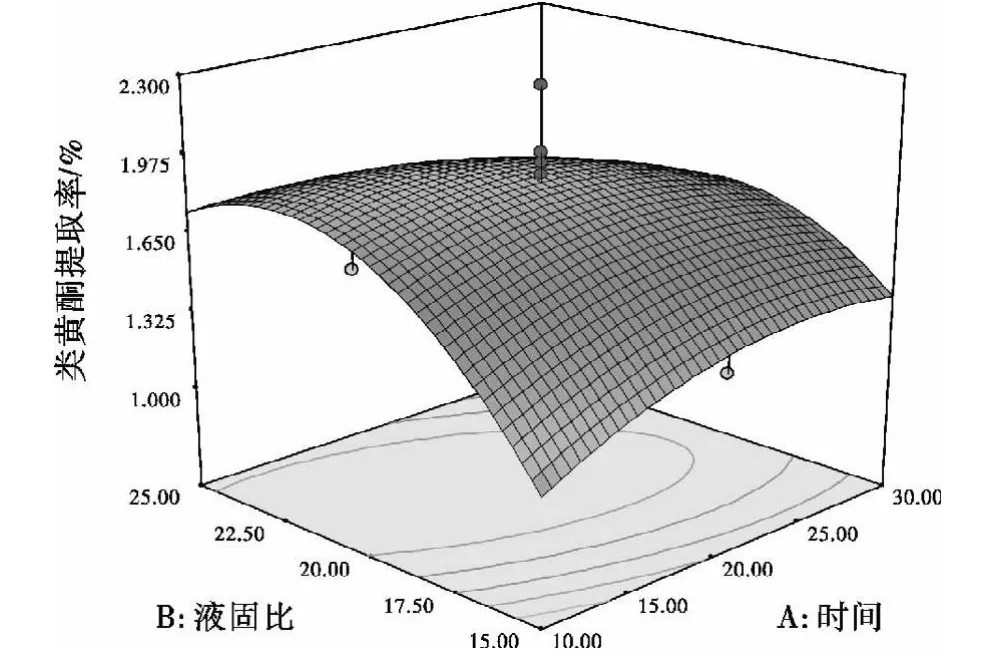
图5 提取时间与液固比的交互作用对提取率的影响Fig.5 Influence ofextracting time and ratioof liquid to solid correlation to extraction rate
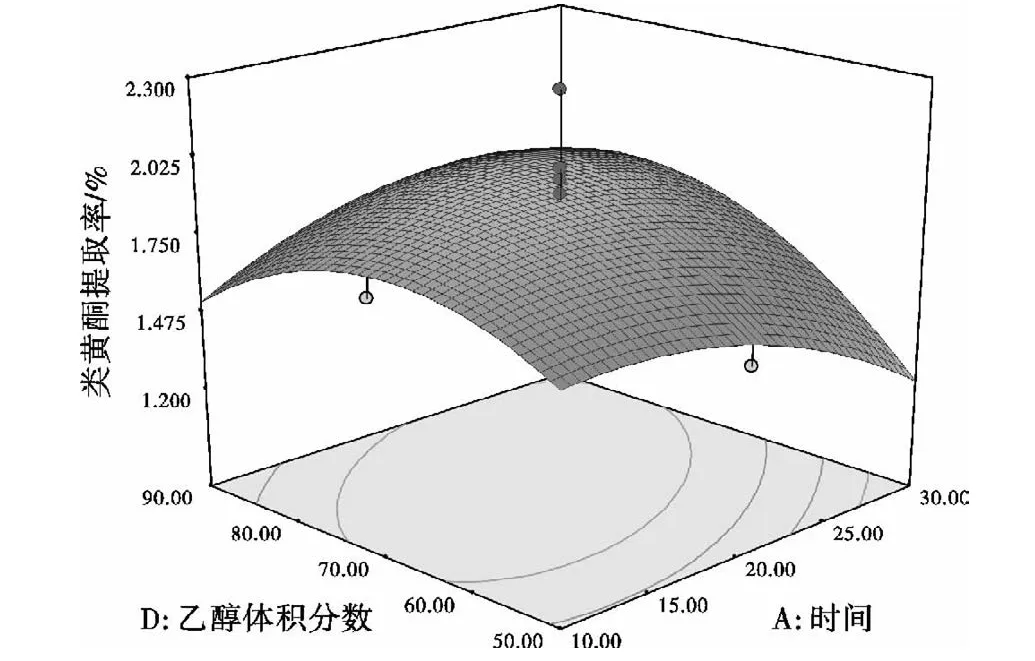
图6 提取时间与乙醇体积分数的交互作用对提取率的影响Fig.6 Influence ofextracting time and volume fraction ofethanol correlation toextraction rate
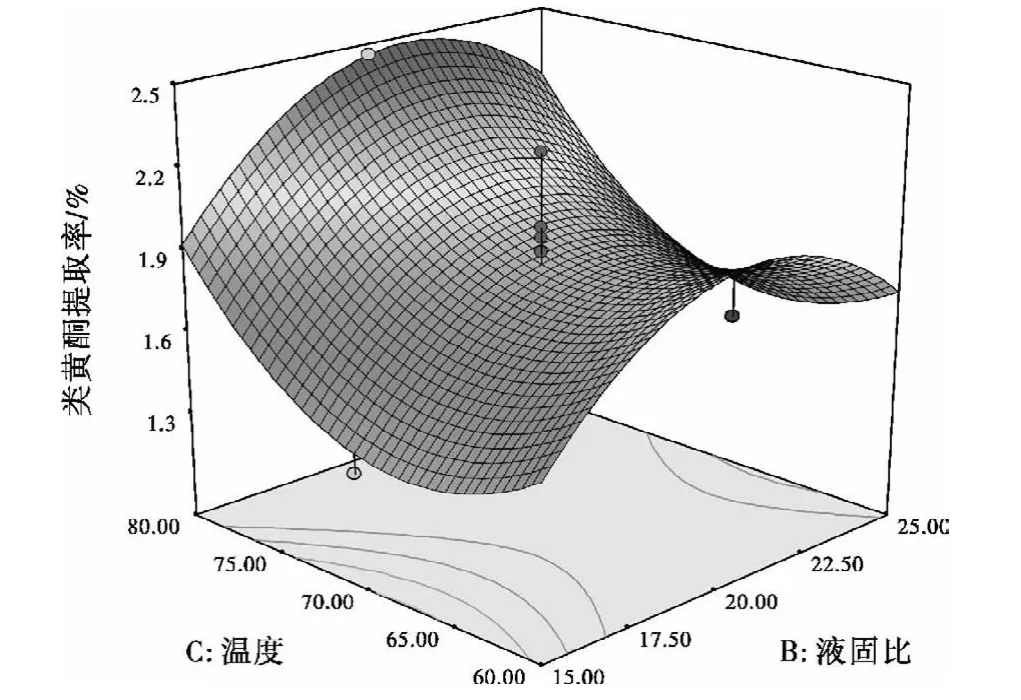
图7 液固比与水浴温度的交互作用对提取率的影响Fig.7 Influence of temperature and ratio of liquid to solid correlation toextraction rate
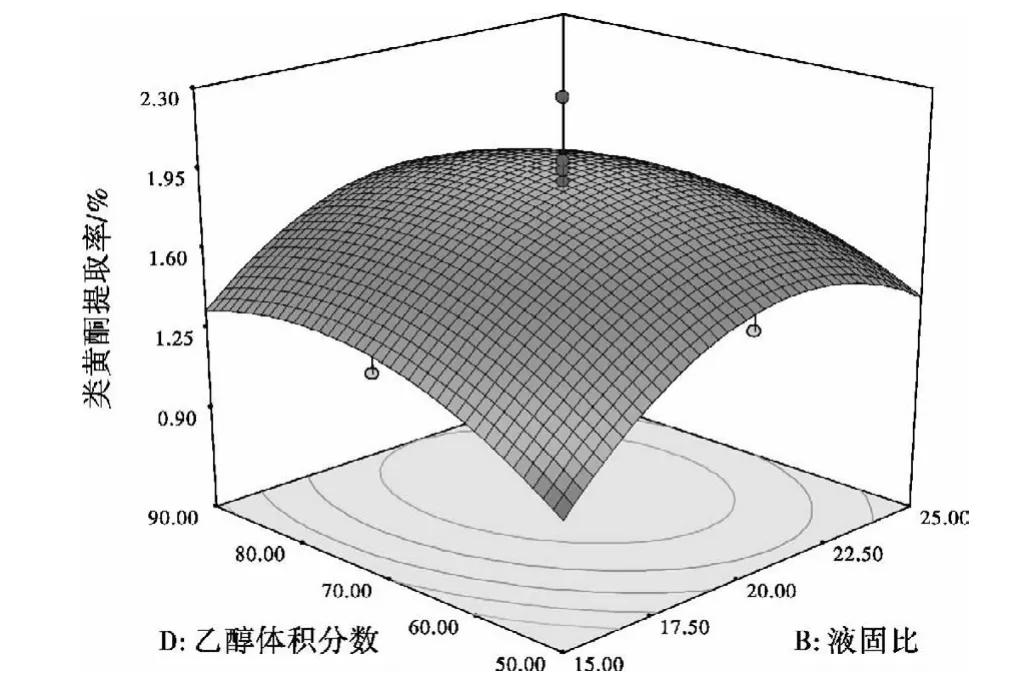
图8 液固比与乙醇体积分数的交互作用对提取率的影响Fig.8 Influence of ratio of liquid to solid and volume fraction ofethanol correlation toextraction rate
2.2.2.3 最适条件推荐 通过响应面试验,可以得到软件推荐的最佳工艺为:提取时间24.02 min,液固比为20.49,水浴温度为80℃,乙醇体积分数为72.59%.在此条件下,类黄酮的提取率为2.49%.
2.2.3 验证性试验 根据响应面试验所推荐的最适条件,提取时间为24.02 min(取24 min)、乙醇体积分数为72.59%(取72%)、液固比20.49(取20)、提取温度为80℃(取80℃),经3次平行试验测得总类黄酮得率为(2.54±0.11)%,与理论值2.49%差异不显著(P>0.05),说明该预测值是可靠的.
3 结论
通过单因素试验考察了提取时间、液固比、水浴温度、乙醇体积分数对三叶草黄酮提取率的影响,并得出了进一步试验的范围.通过响应面试验,确定了三叶草黄酮的最佳提取工艺为提取时间24.02 min、乙醇体积分数72.59%、水浴温度80℃、液固比20.49,提取次数为1.该工艺的黄酮提取率可达到2.49%.
[1]兰丹,文略,王小萍,等.红薯叶中总黄酮提取工艺的研究[J].微量元素与健康研究,2007(1):47-48.
[2]胡春.黄酮类化合物的抗氧化性质[J].中国油脂,1996,2 1(4):18-21.
[3]张庆建,赵毅民,杨明,等.黄酮类化合物对中枢神经系统的作用[J].中国中药材杂志,2001,26(8):511-514.
[4]谭剑蓉,干友民,李洋.三叶草活性成分及其应用研究进展[J].广东农业科学,2012(11):136-138.
[5]张秀芬,贾玉山.饲料草收贮与加工[M].呼和浩特:内蒙古人民出版社,1989:118-126.
[6]南京中医药大学.中药大辞典[M].上海:上海科学技术出版社,2006:88,1410.
[7]Zava D T,Dollbaum C M,Blen M.Estrogen and progestin bioactivity of foods,herbs,and spices[J].Society for Experimental Biology and Medicine,1998,217(3):369-378.
[8]常平,张颍,夏开元,等.红车轴草提取物中异黄酮成分的分析[J].食品科学,2007,28(9):449.
[9]Stanislaw B,Wieslaw O.Antioxidant and antiradical activities of flavonoids[J].Journal of Agricultural and Food Chemistry,2001,49(6):2774-2779.
[10]陈运中,胡小泓,周享春.苦荞麦黄酮提取最佳条件的研究[J].广州食品工业科技,1999,15(3):29-31.
