珠江口磨刀门溶解有机物CDOM三维荧光光谱特征
2013-10-13肖红伟龙爱民孙羚晏
肖红伟, 龙爱民, 孙羚晏
(中国科学院 南海海洋研究所 热带海洋环境国家重点实验室, 广东 广州 510301)
溶解有机碳在全球海洋中是最大还原性碳库之一。有色溶解有机物(CDOM)代表溶解有机池的一部分, 能够吸收可见光及 UV-A和 UV-B, 在海洋乃至全球的碳素生物地球化学循环中均起着不可或缺的关键作用[1]。CDOM化学组分非常复杂, 主要来源于陆地和水生生态系统植物的腐败[2]。在河口和近海岸,CDOM 主要来源于陆地有机物, 如土地使用后的废水[3], 因此了解 CDOM 分布和光谱特征能够更好的确定其来源及组成。一般情况下, 在河口和近海岸水体中, CDOM是典型的保守混合行为, 其浓度随盐度的增加而减少[4]。但是也有研究发现, 紫外线降解有机物, 河底底泥上翻水体提供有机物, 浮游植物产生有机物等, 都将影响CDOM的保守行为[5]。
尽管珠江口的CDOM研究已有少数报道[4,6,7], 但作为西江干流的入海口, 在珠江八大口门中, 输水量最大的磨刀门, 其CDOM却还未见报道。在我国大河口中,磨刀门为典型的以河流作用为主的河口, 其径流作用强,潮流作用相对较弱。随着区域经济及人口的进一步增长,珠江磨刀门水道已成为江门、中山、珠海、澳门等城市重要的水源地。因此, 本研究利用夏秋季磨刀门水体不同时间的CDOM数据, 结合水体参数, 了解CDOM的组成及来源, 同时探讨其时空变化的规律及原因。
1 材料与方法
1.1 样品采集与预处理
图1 磨刀门2011年9月25日航次站位图Fig.1 Sampling locations on Sep. 25 2011 in Modoamen Estuary
2011年9月25日在珠江口磨刀门设置8个站位(图1), 每个站位采集表(1m)、 中(底部深度的 1/2)、底(离底部1 m)层水样; 2011年9月26日8:00至27日10:00在W5号站位设置定点站位, 每隔2 h采集表(1 m)、中(底部深度的1/2)、底(离底部1 m)层水样1次。同时用CTD测定水深、温度、盐度。样品采集后立即用孔径为0.2 μm的聚碳酸酯滤膜过滤(10%HCl浸泡 15 min后用Milli-Q水洗净)过滤后装入60 mL洁净棕色瓶, 密封、冷冻保存待测。紫外线UV-B强度用IL-1700 Research Radiometer (International Light Inc., MA, USA)测定。
1.2 CDOM三维荧光光谱(EEMs)测定
冷冻样品取出后避光放置, 自然解冻至室温,样品三维荧光光谱采用PerkinElmer公司的LS-45荧光光度计进行测定。仪器基本参数设置如下: 光源为150 W氙弧灯, PMT电压为700 V, 激发和发射单色仪的狭缝宽度均设为10 nm, 扫描速度为1000 nm/min,扫描光谱进行仪器自动校正。激发波长(Ex)范围200~600 nm, 步长5 nm; 发射波长(Em)范围为210~750 nm,步长2 nm。以Milli-Q水作空白。同时记录当激发波长λEx=350 nm, 发射波长λEm=450 nm 处的荧光强度,并且用 QSU单位来表示水样 CDOM 的相对含量。1QSU为1μg/L硫酸奎宁(溶于0.05 mol/L硫酸溶液)在相同条件下(Ex/Em=350/450)测得的荧光强度[8-9]。
2 结果与讨论
2.1 CDOM的EEMs谱图

图2 CDOM的EEMs谱图(图中数据单位为相对荧光强度)Fig.2 EEMs of CDOM (data unit: relative fluorescence intensity)
对本次所有样品CDOM的EEMs分析测定表明,均表现出相似的EEMs谱图(图2)。根据前人的研究结果[3,10-11], 对 CDOM 的类型和来源进行区别和标记。在样品中主要发现4个荧光谱峰: 分别为UV类腐殖质A、陆源Vis类腐殖质C和海源Vis类腐殖质M, 以及类蛋白质T。峰A是少芳香性的陆源腐殖质所产生的荧光信号, 峰 C是较多芳香性的陆源腐殖质所产生的荧光信号[12], 峰M代表了海源来源的腐殖质组成, 峰 T是由有机颗粒物下沉时细菌降解产生的[13]。类似的荧光谱峰也在珠江其他口门水体中发现[4]。从图3中可以发现, 类蛋白质T在磨刀门水体中是主要的贡献者, 而磨刀门水体中生物量较小,因此认为CDOM可能主要来源于人为来源废水, 类似于动物养殖废水的荧光性质[14]。而陆源或海源腐殖质相对较少。从而进一步反映了, 由于广东省经济的快速发展, 森林、农田和湿地迅速减少, 由植物降解产生的 CDOM 也减少[6]。同时, 广东省 70%以上的污染物进入珠江水体[15], 而磨刀门沉积物中也发现近年有机碳氮等快速增加的现象[16]。

图3 不同站位荧光强度分布Fig. 3 Distribution of relative fluorescence intensity at different stations
2.2 CDOM空间分布规律
图3显示了从W1站点到W8站点表、中、底层水体CDOM相对荧光强度的横纵向空间变化趋势。纵向上, 所有站位基本呈现CDOM相对荧光强度表层水体>中层水体>底层水体, 表明表层水体主要受控于陆源淡水输入, 而底层受控于外海水输入, 密度较大的海水由底部向上游入侵。韩宇超也发现[17], 九龙江河口区CDOM 浓度呈现表层高于底层的分布特征。横向上,在W1点和W4点之间变化较小, 在W4点和W8点之间呈线性减小, 这与珠江其他口门水体CDOM变化现象类似[6-7]。所有站点不同层次水体CDOM相对荧光强度均与盐度明显的线性负相关关系, 指示了水体CDOM 具有很好的保守混合行为, 主要受河海水物理稀释作用。这种关系也在很多河口发现[6,18-19], 反映了淡水是河口水体中 CDOM 的主要来源。同时也发现,不同水深荧光强度随盐度变化系数不一样, 表层、中层、底层分别为: -1.78, -1.41, -1.35, 表明表层荧光强度随盐度变化较大, 中层次之, 而底层最小。
2.3 CDOM时间分布规律
图5显示了W5站位定点水样CDOM荧光强度随时间的变化规律。表、中、底层变化CDOM荧光强度变化规律基本一致, 两个峰值点分别出现26日18点和27日4点, 这与涨落潮时间基本一致, 反映了海水对CDOM浓度稀释作用。表层水体CDOM荧光强度随时间变化峰相对较多, 反映了表层水体CDOM干扰因素较底层多。定点CDOM荧光强度与盐度的线性关系(图 6)较不同站位 CDOM 荧光强度与盐度的线性关系(图4)差, 反映了定点CDOM不仅到海水的物理稀释作用, 还可能受到其他因素影响,如, 微生物活动强度、紫外线强度等。底层 CDOM荧光强度与盐度的线性关系相对较好, 表明底层主要受海水的物理稀释作用, 而微外线、微生物活动影响相对较小, 同时也反映了底泥的影响较小[5]。
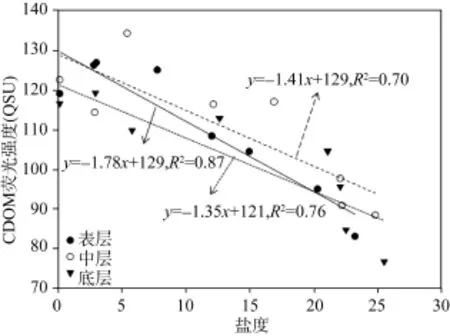
图4 不同站位盐度和CDOM荧光强度的线性关系Fig. 4 Fluorescence intensity versus salinity at different stations

图5 W5站位CDOM荧光强度时间变化规律Fig. 5 Fluorescence intensity changed with time at station W5
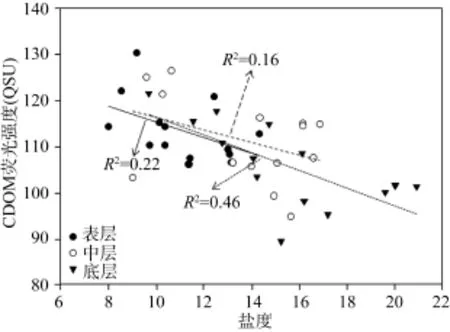
图6 W5定点站位荧光强度与盐度的关系Fig. 6 Fluorescence intensity versus salinity at station W5
2.3.1 表层紫外线的影响
CDOM 对紫外光具有较强的吸收, 对水体表层浮游植物的紫外损伤起着保护作用。同时CDOM又通过影响紫外辐射在水体中的穿透深度进而影响生态系的结构与功能, 即通过光吸收调节水下有效光辐射, 影响浮游植物的光合作用和生态系统的初级生产。CDOM 发生光化学反应的物质基础是其含有大量对太阳辐射具有吸收性质的芳香双键结构(C=C,C=O 等)。CDOM 的这些发色团吸收光子能量后可产生直接或间接的光化学反应[20]。由于CDOM 的吸收随着波长减小而呈指数形式增加, 因此起主要作用的是紫外区的辐射, 尤其是 UV-B (280~320 nm)和 UV-A (320~400 nm)波段[21]以及部分短波可见光波段[22]。因此, CDOM 光化学反应主要发生在表层水体。前人研究了长期暴露光照下CDOM 的光化学和细菌降解, 发现在暗中培养的 500 天期间, 浮游生物降解的 CDOM 的量与表层日光辐射一周降解的量相同, 可见表层CDOM 光降解远比浮游生物的降解重要得多[23]。从图7中可以看出, CDOM白天的含量与紫外线 UV-B强度存在明显的指数递减关系, 表明定点站位表层CDOM浓度的变化是由紫外线强度变化影响的。在夏秋季, 太阳紫外辐射较为强烈, 所以使表层CDOM很容易发生光降解[24]。由于近岸水体污染较大, 紫外线 UV-B在水体衰减较快,一般情况下, 认为对较深水体影响较小[25]。

图7 表层CDOM荧光强度与紫外线的关系Fig. 7 Fluorescence intensity versus UV at surface water at station W5
2.3.2 初级生产力对中层CDOM的影响
而中层的CDOM除了海水稀释作用外, 由于大部分有害紫外线被表层水阻挡不能到达中层, 因此,生物活动的影响开始显现, 浮游植物生长可引起水体类蛋白质荧光的增加。水体中浮游植物的生长主要受营养盐含量、水体温度和光照强度控制[26-27]。W5站位中层水体的营养盐物质丰富, 分别为,P:0.55 μmol/L, N:25.63 μmol/L, Si:7.02 μmol/L, 因此营养盐含量并不是影响浮游植物的主要因素。温度对大多数河口浮游植物光合作用和生长的影响类似,当温度超过最适温度时浮游植物初级生产迅速下降,一般浮游植物生长最适温度在20~25℃[26,28]。本次采样时白天的水体温度均超过 25℃, 因此水体温度越高, 浮游植物初级生产越低。在9月26日8: 00-14: 00,T峰荧光强度与水体温度呈现良好的负相关关系(R2=0.58)。从图8中可以看出, 在9月26日8: 00 -16: 00及9月27日8: 00和10: 00, 反映浮游植物指示的叶绿素 a与 T峰荧光强度具有较好的线性关系(R2=0.45), 指示了浮游植物生长对增加水体类蛋白质荧光具有较大的贡献。而两者在表层的线性关系较差(R2<0.0001), 说明表层水体CDOM的T峰荧光强度受到多重因素影响。从26日16: 00 -27日6: 00,T峰荧光强度与盐度存在良好的负相关关系(R2=0.54), 说明从26日16: 00及晚上的水体主要受海水稀释作用控制。对比26日8:00-14:00和27日8:00 -10:00, 也同样发现温度较高的27日, T峰荧光强度较低。另外, 光照强度也对浮游植物初级生产产生作用, 但是其影响较水体温度小[26]。
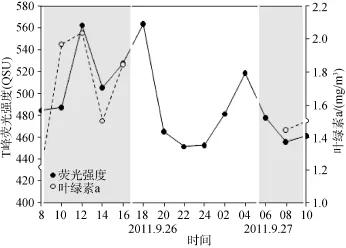
图8 中层T峰荧光强度与叶绿素a变化规律Fig.8 T-peak fluorescence intensity with Chlorophyll a changed with time at station W5
3 结论
(1)珠江口磨刀门CDOM的三维荧光峰谱包括:UV类腐殖质A、陆源Vis类腐殖质C和海源Vis类腐殖质M, 以及类蛋白质T, 其中以类蛋白质T峰为主要峰, 说明CDOM主要来源于人为来源废水。
(2)从河端至海端, 随着盐度的增加, CDOM荧光强度逐渐减小, 表明陆源输入是河口区CDOM主要的主要来源, 并且主要受海水的物理稀释控制。
(3)CDOM 的荧光强度主要受海水的物理稀释影响, 但同时也受紫外线和浮游植物生长等多重因素的共同影响。
致谢: 感谢中国科学院南海海洋研究所周伟华提供叶绿素a的数据以及党爱翠、石荣贵在采样时提供的帮助, 感谢中国科学院地球化学研究所李晓东在英文摘要修改上提供的帮助。
[1]Amon R M W, Benner R. Rapid cycling of highmolecular-weight dissolved organic matter in the ocean[J]. Nature, 1994, 369: 549-552.
[2]Kirk J T O. Light and photosynthesis in aquatic ecosystems[M]. Cambridge: Cambridge University Press, 1994. 57-72.
[3]Blough N V, Del Vecchio R. Chromophoric DOM in the coastal environment[M]. San Diego, CA: Academic Press, 2002. 509- 546.
[4]Hong H, Wu J, Shang S, et al. Absorption and fluorescence of chromophoric dissolved organic matter in the Pearl River Estuary, South China[J]. Mar Chem,2005, 97(1-2): 78-89.
[5]Boss E, Pegau W S, Zaneveld J R, et al. Spatial and temporal variability of absorption by dissolved material at a continental shelf[J]. J Geophys Res, 2001, 106:9499-9507.
[6]Callahan J, Dai M, Chen R F, et al. Distribution of dissolved organic matter in the Pearl River Estuary,China[J]. Mar Chem, 2004, 89(1-4): 211-224.
[7]Chen Z, Li Y, Pan J. Distributions of colored dissolved organic matter and dissolved organic carbon in the Pearl River Estuary, China[J]. Cont Shelf Res, 2004,24(16): 1845-1856.
[8]Chen R F, Bissett P, Coble P, et al. Chromophoric dissolved organic matter (CDOM)source characterization in the Louisiana Bight[J]. Mar Chem, 2004, 89(1-4):257-272.
[9]Vodacek A, Hoge F E, Swift R N, et al. The use of in situ and airborne fluorescence measurements to determine UV absorption coefficients and DOC concentrations in surface waters[J]. Limnol Oceanogr,1995: 411-415.
[10]Coble P G. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy[J]. Mar Chem, 1996, 51(4): 325-346.
[11]Coble P G, Del Castillo C E, Avril B. Distribution and optical properties of CDOM in the Arabian Sea during the 1995 Southwest Monsoon[J]. Deep-Sea Res PT II,1998, 45(10-11): 2195-2223.
[12]程远月, 郭卫东, 龙爱民, 等. 利用三维荧光光谱和吸收光谱研究雨水中 CDOM 的光学特性[J]. 光谱学与光谱分析. 2010, 9: 2413-2416.
[13]Del Castillo C E, Coble P G, Morell J M, et al. Analysis of the optical properties of the Orinoco River plume by absorption and fluorescence spectroscopy[J]. Mar Chem, 1999, 66(1-2): 35-51.
[14]Baker A. Fluorescence properties of some farm wastes:implications for water quality monitoring[J]. Water Res,2002, 36(1): 189-195.
[15]逄勇, 李毓湘. 珠江三角洲污染物对东四口门通量影响分析[J]. 河海大学学报: 自然科学版, 2001, 29(4): 50-55.
[16]贾国东, 彭平安, 傅家谟. 珠江口近百年来富营养化加剧的沉积记录[J]. 第四纪研究, 2002, 22(2):158-165.
[17]韩宇超, 郭卫东. 河口区有色溶解有机物 (CDOM)三维荧光光谱的影响因素[J]. 环境科学学报, 2008,28(8): 1646-1653.
[18]Ferrari G M, Dowell M D. CDOM absorption characteristics with relation to fluorescence and salinity in coastal areas of the southern Baltic Sea[J]. Estuar Coast Shelf Sci, 1998, 47(1): 91-105.
[19]Green S A, Blough N V. Optical absorption and fluorescence properties of chromophoric dissolved organic matter in natural waters[J]. Limnol Oceanogr,1994, 39(8): 1903-1916.
[20]Osburn C L, Morris D P. Photochemistry of chromophoric dissolved organic matter in natural water waters[A ]. In:Helbling E W, Zagarese H. UV Effects in Aquatic Organisms and Ecosystems, vol. 1[ C ]. Cambridge:The Royal Society of Chemistry, 2003, 187-209.
[21]Zepp R G, Callaghan T V, Erickson D J. Effects of enhanced solar ultraviolet radiation on biogeochemical cycles[J]. J Photoch Photobio B, 1998, 46(1-3): 69-82.
[22]Moran M A, Zepp R G. Role of photoreactions in the formation of biologically labile compounds from dissolved organic matter[J]. Limnol Oceanogr, 1997,42(6): 1307-1316.
[23]Vahatalo A V, Wetzel R G. Photochemical and microbial decomposition of chromophoric dissolved organic matter during long (months-years)exposures[J]. Mar Chem., 2004, 89(1-4): 313-326.
[24]郭卫东, 程远月. 天然日光辐照下河口区 CDOM 的光化学降解[J]. 环境科学, 2008, 29(6): 1463-1468.
[25]张运林, 秦伯强, 朱广伟, 等. 长江中下游浅水湖泊紫外辐射的衰减[J]. 中国环境科学,2005, 25(4):445-449.
[26]蔡后建, 陈宇炜, 蔡启铭. 太湖梅梁湾口浮游植物初级生产力及其相关因素关系的研究[J]. 湖泊科学,1994, 6(4): 340-347.
[27]郭沛涌, 沈焕庭. 河口浮游植物生态学研究进展[J].应用生态学报,2003, 14(1): 139-142.
[28]Goldman J C. Temperature effects on steady-state growth, phosphorus uptake, and the chemical composition of a marine phytoplankter[J]. Microb Ecol,1979, 5(3): 153-166.
