藻类对硒的吸收、富集和转化的研究进展
2013-10-13刘丽婧王长海
刘丽婧, 葛 滢, 王长海
(南京农业大学 资源与环境科学学院, 江苏省海洋生物学重点实验室, 江苏 南京210095)
硒是唯一种由基因调控且生物所必需的微量元素,它能够防治癌症[1-3]、延缓衰老[4]、提高免疫能力[5]。硒主要通过硒代半胱氨酸(Sec)的形式进入硒蛋白,而硒代半胱氨酸又是硒蛋白的关键组成成分, 同时也是构成一系列硒酶, 如谷胱甘肽过氧化物酶(Glutathione Peroxidase, GSH-POX)等的活性中心。此外硒代半胱氨酸还是由UGA密码子引导的第21种氨基酸[6]。大量研究表明, 硒的缺乏或过剩与人类的多种疾病息息相关[7]。在低质量浓度水平下, 硒有助于细胞的生长与功能的发挥, 对哺乳动物的发育起着重要作用[8]; 然而高质量浓度的硒会导致活性氧物质产生, 促使DNA氧化, DNA双链断裂, 细胞死亡[9]。硒多以无机形式存在, 生物利用度低且易引起硒中毒, 而有机硒的毒性低, 生物活性高且容易被人类或其他生物吸收利用, 所以有机硒常被视为高效且安全的补硒制剂[10]。
海洋是地球上硒元素存在和迁移的主要场所,海水中硒元素主要来源于岩石风化、降水、水土流失以及水体中生物有机体的分解。海水中的硒含量一般为 4~6 μg/L[4], 亚硒酸盐、硒酸盐和有机硒是溶解在海洋水体中的3种主要形态的硒[11]。
在水生食物链中, 藻类在硒的生物循环过程中起着极其重要的作用。海洋藻类含有丰富的蛋白质、脂类和多糖, 在生长期间, 海洋藻类能够吸收、积累一定量的硒并将硒与这些大分子有机物结合, 使无机形式的硒转化为有机形式, 继而通过食物链传给海洋中的其他消费者, 同时也为食物网中的各级消费者提供硒营养。因此使无机硒在海洋生物载体中富集、转化为有机硒产品的想法, 既合理又有效[12]。
本文针对藻类对硒的吸收、富集和转化及其影响因素进行综述。
1 研究常用藻种1
藻类并非易积累硒的生物, 自然条件下, 藻类的含硒量极低。毛文君等[13]曾对12中含硒藻进行测定, 发现硒含量在 1.3~7 μg/g, 其中绿藻含硒量较高。虽然藻类的天然含硒量不高, 但实验证明, 经驯化, 人们往往可以获得对硒的耐受性和富集能力更强的藻种。之前的研究中有关富集转化无机硒的藻类主要有: 螺旋藻[14]、紫球藻[15]、小球藻[16]、球石藻[17]等。富硒螺旋藻中硒的存在形式主要为有机硒,有机硒占总硒含量的75 %以上[18], 且螺旋藻的生长速度快、培养方法简单快捷、耐受硒的能力较强, 工业化生产技术成熟, 因此, 螺旋藻被视为无机硒生物有机化的理想载体并且被广泛地研究。螺旋藻主要分为三大类; 钝顶螺旋藻; 极大螺旋藻和盐泽螺旋藻。大多数的富硒研究中使用钝顶螺旋藻作为载体, 但也有少数研究发现, 盐泽螺旋藻的富硒能力更胜一筹; 在外加硒质量浓度相同的条件下, 盐泽螺旋藻的富硒量分别是极大螺旋藻和钝顶螺旋藻的72倍和5.7倍[19]。因此, 盐泽螺旋藻可能是更具发展前景的富硒研究生物载体。
2 培养条件对藻类富硒影响
许多因素都会影响到富硒藻类生长与其富硒效果, 并且它们之间的关系十分复杂。
2.1 温度、光强和pH的影响
藻类的最适生长条件不等同于藻类吸收、富集和转化硒的最适条件。以极大螺旋藻为例, 研究显示,当外加的硒质量浓度为 0.4 mg/L, 藻类的生长在温度为 35 ℃时得到促进; 而 25 ℃下, 藻类的富硒量最大, 且在 15 ℃时, 极大螺旋藻富集硒的量又比 35 ℃时高[20], 周志刚等[20]认为原因可能是: 在比较低的温度下, 藻类生长比较迟缓, 而这种较缓慢的生长速度却有助于藻类对硒进行富集[20], 然而郑文杰等[21]则推测这种现象可能是极大螺旋藻中与富硒活动有关的酶在高温条件下失活所造成的。
除此之外, 光强对藻类富硒也有所影响。周志刚等[20]的研究表明, 在8 000lx的光强条件下, 不仅能够刺激极大螺旋藻细胞的生长, 还有利于藻细胞富集硒[20]。
作为培养条件之一, pH也是影响藻类富硒的一大因素。黄键等[22]的研究表明, pH8.0 的培养条件有利钝顶螺旋藻富集 Se(IV)。Riedel等[23]对莱茵衣藻(Chlamydomonas reinhardtii)的研究显示: 当培养液中pH 5 ~ 9时, pH对衣藻吸收硒酸盐的作用极小, 仅有微弱证据表明pH8最适宜衣藻吸收硒酸盐。当pH远低于7时, 衣藻细胞对亚硒酸盐的吸收迅速增长。Riedel等[23]认为pH影响衣藻富硒的可能原因主要有两点, 一是pH改变了溶液中离子的质子化程度, 进而改变了离子的化学形态, 生物活性较高的形态有利于衣藻富硒, 而生物活性较低的则抑制藻类富硒;二是pH改变了衣藻细胞中吸收转移蛋白质的活性。
2.2 其他元素的影响
其他元素的存在也会影响藻类对硒的富集。Fournier等[24]发现, 当硒质量浓度相同时, 藻类在硫质量浓度较低的条件下富硒量较大。黄峙等[18]的研究显示, 外加硫元素与硒元素的质量浓度值之比是钝顶螺旋藻对硒的富集和有机化效率的一大影响因素。在硒质量浓度为3.80 mmol/L, S(VI):Se(IV)=1.232的条件下, 钝顶螺旋藻的总生产量、含硒量和有机硒含量均达到峰值, 但当硫硒比(S/Se)逐渐增加时, 藻类的总硒含量与有机硒含量均出现显著下降趋势。造成这种现象的原因可能是硒与硫的物理、化学性质都十分相似, 所以在各种生物作用过程中, 当硒的质量浓度较高时, 硒可以代替硫, 通过硫的代谢途径进入生物体, 而因为硒硫两元素之间的竞争,生物体内产生拮抗作用, 从而影响钝顶螺旋藻对硒吸收、富集、代谢和转化等一系列功能。另有李志勇等[25]的针对钝顶螺旋藻的研究显示, Na2SO3能够有效缓解高质量浓度硒[Se(IV)]条件对钝顶螺旋藻所产生的毒性, 并且随着Na2SO3质量浓度的逐渐增加,这种缓解作用更为显著, 而在使用 Na2SO4的对照组试验中这种缓解现象并未出现。这可能也是硫元素与硒元素之间的竞争关系所导致的。
Kramárová等[26]在研究Desmodesmus quadricauda时发现, 在As(Ⅲ)-Se(IV)混合培养液中, 藻类富硒量随着As质量浓度的升高而增加。
磷(P)则是另一种能够影响藻类富硒的元素。多项研究表明, 藻类富硒量随培养液中磷酸盐的质量浓度升高而降低[23,27-30]。Yu等[29]认为这可能是硒和磷之间相似的阴离子转运方式产生的竞争所致。
另外, 黄键等[22]的研究发现 ZnSO4可促进钝顶螺旋藻的生长, 而Zn(Ac)2能提高藻类的富硒能力。
3 硒形态、添加方式和质量浓度对藻类生长和富硒影响
3.1 不同形态硒源的影响
水体中硒主要以四价无机硒[Se(IV)]、六价无机硒[Se(VI)]、甲基硒、硒蛋白等形式存在, 其中无机硒是硒存在的主要形式, 不同形态的外加硒源对藻类生长过程以及藻类富硒能力的影响差异较大。Umysová等[31]认为藻类富硒不仅由硒的添加量决定, 还与硒的化学形态紧密相关。亚硒酸盐的毒性低并且吸收转化速率快。因此, 与硒酸盐相比, 亚硒酸盐更适宜作为藻类富硒培养过程中的外加硒源。Riedel等[32]发现,在短期(0~24 h)富硒培养中, 藻类对亚硒酸盐的富集量约是硒酸盐的 4~5倍。喻达辉等[33]研究了钝顶螺旋藻对 Na2SeO3和 SeO2吸收的差异后发现, 当 SeO2质量浓度为10 mg/L时, 钝顶螺旋藻可达到最大富集系数, 而对于 Na2SeO3来说, 达到相同水平, 其质量浓度要达35 mg/L。而杨逸平等[34]的研究则发现, 一般的海洋藻类在生长过程中能快速选择摄取 Se(IV),并迅速转化为藻相硒。但这些藻类几乎不吸收 Se(VI),而中肋骨条藻是一个例外, 它能极缓慢地吸收Se(VI)。
3.2 硒添加方式的影响
杨莹莹等[35]在外加硒质量浓度为800 mg/L的培养条件下, 进行9 d的对照实验, 实验设计了5种在极大螺旋藻培养液中外加硒的方式, 并且研究了不同添加方式对极大螺旋藻的生长及富硒能力的影响。这5种方法分别是一次性添加、中间3 d平均等量添加、等量连续添加、等梯度添加和前后4 d等量添加硒。研究表明, 相比于一次性添加和中间添加,多次添加对于螺旋藻的生长的促进作用更强, 而螺旋藻在等梯度添加外加硒的条件下, 其生长最为旺盛, 可能是因为等梯度添加的前期, 刚好是极大螺旋藻生长过程中比较敏感的时期, 外加硒的量比较少, 较不易对极大螺旋藻产生生物抑制作用, 从而螺旋藻的生物量能得到较快的积累。而在对螺旋藻富硒效果影响上, 等量添加方式可使极大螺旋藻有机硒含量最高, 有机硒转化率达到97.38 %, 是5种添加方式中有机硒转化率最高的。可能是因为极大螺旋藻在前期已经适应了高质量浓度硒条件下的生长环境, 所以后期生长的藻类产生了较强的富硒能力。
而黄峙等[36]在比较一次性添加、浓缩添加(即低质量浓度下培养5 d后一次性加入)和等量添加3种方式时也发现: 在高质量浓度(1 000 mg/L)硒条件下等量添加法有利于硒的有机化, 有机硒转化率可达71.77 %; 而浓缩添加法所需外加硒源最少, 仅为一次性添加和等量添加法的 1/5和 1/6, 并且浓缩添加法实验中的第 5天过滤培养液在实际生产过程中还可回收利用, 这可减少富硒藻类生产过程中的硒用量, 既降低了成本又减轻了环境污染。
3.3 硒添加质量浓度的影响
因为硒对藻类具有生长促进与毒性抑制的二重性, 所以一般而言, 藻类的富硒量并不与培养液中外加的硒质量浓度成正比。当外加硒的质量浓度较低时,藻类的富集硒的能力随硒质量浓度增高而增大, 而在硒质量浓度较高的条件下, 当硒质量浓度增加时, 藻类的富硒量则明显下降, 因此外加硒的质量浓度过高或过低都不利于藻类对硒的富集[37]。适宜藻类生长的硒质量浓度以及藻类富硒能力最强时的硒质量浓度随藻种、生长环境因素、生长时期等条件的不同而各有不同, 表1列出了不同研究者的研究结果。
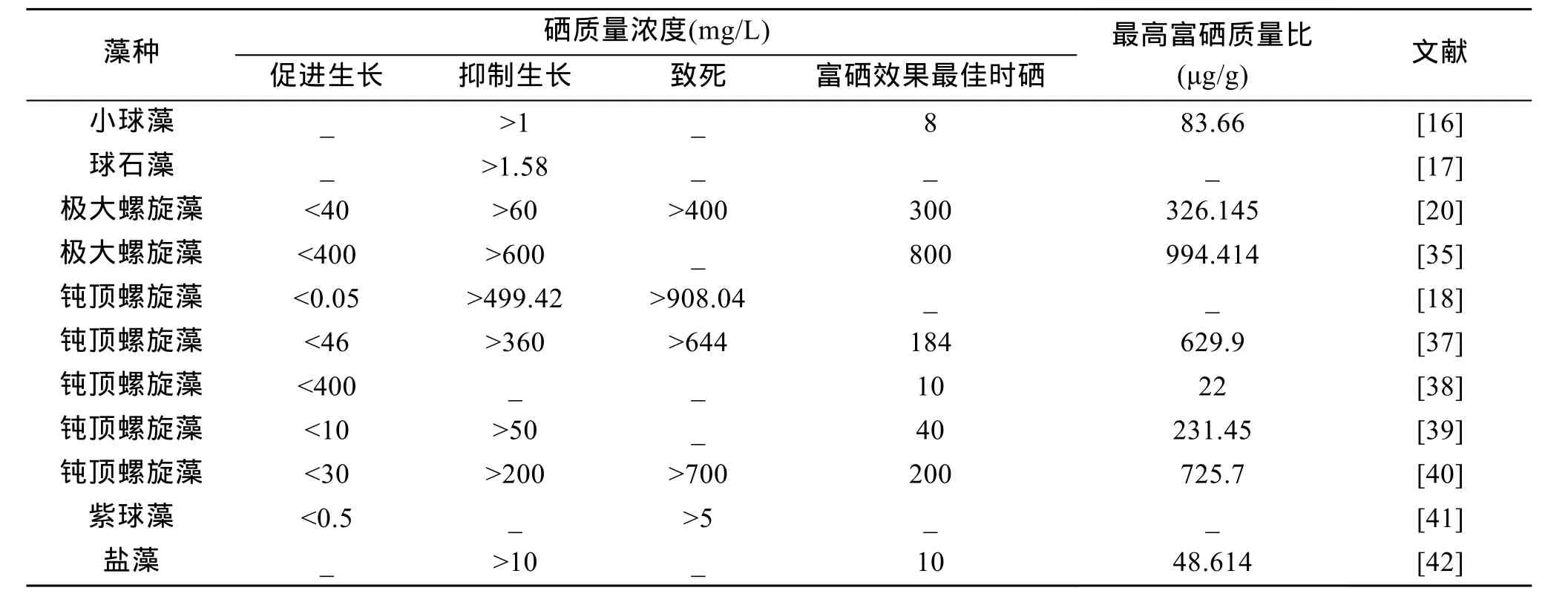
表1 硒添加质量浓度对不同藻种生长和富硒量(总硒)的影响
从表1可知, 一般当外加硒质量浓度小于50 mg/L时, 可以促进藻类的生长。与其他藻种相比, 螺旋藻对硒的耐受性较高, 但即使相同藻种(如极大螺旋藻)之间的最适生长质量浓度和致死质量浓度等方面也存在很大的差异。
有观点认为藻类在低质量浓度硒条件下的生长促进作用可能与其自身的活性氧自由基形成能力有很大关系。硒化合物具有清除自由基和产生自由基的能力[43]。硒质量浓度较低时, 超氧化物歧化酶可有效地协助清除藻类细胞内的活性氧自由基或其他过氧化物, 从而增加谷胱甘肽过氧化物酶的活性以及硒的抗氧化性, 进而增加细胞的活力, 延缓细胞的衰老, 大大促进藻类的生长[20]。
而高质量浓度下硒对藻类的抑制和毒性作用机理尚存在争议, 大致存在四种观点。第一种观点[20]认为外加硒质量浓度较高时, 机体主要产生自由基,而非清除自由基, 所以机体衰老速度加快, 从而使藻类的生长受到抑制, 甚至产生毒性作用。第二种观点[44]认为这种抑制和毒性作用与硒和硫两种元素之间的竞争作用有关。硒元素和硫元素在元素周期表中同属于第六主族(即氧族), 化学性质十分相近, 所以在许多条件下, 机体中用以催化含硫化合物反应的酶同样能够成功地催化含硒化合物反应。相关研究表明当有机体生长在一定质量浓度的硒环境中,在硫酶的参与下, 硒可通过硫的代谢途径进入生物体, 并取代有机体细胞中某些大分子结构中的部分硫[43,45]。所以, 一旦硒元素过多地取代了机体蛋白质中半胱氨酸、胱氨酸或蛋氨酸的硫元素, 则可能引起蛋白质空间结构明显改变, 影响蛋白质的正常功能,如酶的变性失活等, 打乱藻类的正常生命活动, 从而抑制或毒害藻类的生长过程。第三种观点[44]认为硒在机体生长代谢过程中产生的硒化氢会强烈地抑制细胞色素氧化酶, 而外加的高质量浓度硒导致大量硒化氢的产生, 影响一些酶的活性, 从而抑制藻的生长。第四种观点[44]认为硒能与藻类细胞叶绿体中的叶绿素结合, 干扰光合作用中电子传递的过程,影响能量转化过程造成细胞的营养和能量供应不足。刘太胜等[41]的研究显示, 硒可能会损伤藻类细胞中的捕光色素蛋白复合体, 从而降低其捕获光能的能力, 导致机体光合作用效率下降, 从而抑制紫球藻的生长。
4 富硒藻种细胞中硒的分布情况
硒在藻细胞内的分布由于藻种、培养条件、硒的添加形式、方法和质量浓度的不同而存在差别。表2列举了在不同研究发现的富硒藻细胞中硒的分布情况。
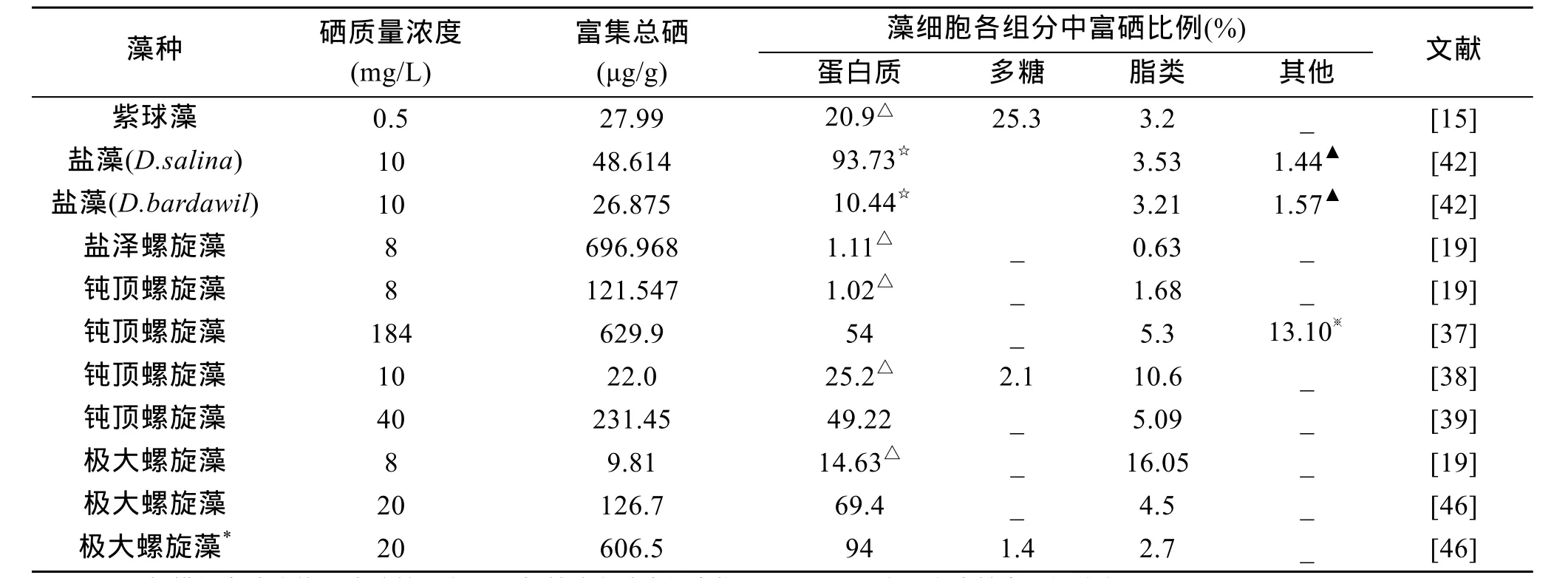
表2 硒在富硒藻种细胞中的分布情况
由表2可知, 硒主要和藻类细胞中的蛋白质, 脂类和多糖等大分子有机物结合, 但也存在其他结合方式, 例如与核苷酸、氨基酸等小分子化合物结合形成有机硒化合物, 或者仅以无机形式的硒存在。通过与蛋白质, 脂类, 多糖或其他生物配体结合, 外加硒实现了从无机形式转化成了有机形式的生物转化。藻类细胞对硒的累积一方面是大分子物质的吸附过程, 另一方面通过生物化学过程形成硒结合的大分子及一些小分子化合物[19]。
硒多与蛋白质结合, 而蛋白质中硒主要与叶绿素结合蛋白结合, 其次是与藻蓝蛋白小分子量的多肽结合[47]。硒与蛋白质是通过一系列生物化学代谢途径以共价键来结合的, 键能大, 结合牢固[19], 其主要机理是: 硒原子取代含硫氨基酸, 如半胱氨酸的巯基以及甲硫氨酸中的甲硫基中的硫生成硒代氨基酸, 从而形成含硒的多肽与蛋白质, 如谷胱甘肽过氧化物酶等。虽然硒代氨基酸的形成机理还不是非常清楚, 但徐晶等[37]的研究发现, 螺旋藻中硒蛋氨酸含量占其机体中含硒蛋白质含量的近一半, 这证明了硒可能会有选择性地与蛋氨酸结合, 或者硒的大量存在一方面影响螺旋藻中蛋氨酸的代谢过程,另一方面促使机体中蛋氨酸累积。对于紫球藻, 硒也可能取代机体藻红蛋白中的硫原子, 进而形成含硒藻红蛋白[15]。另外, 刘静雯等[17]的研究发现, 在无机硒质量浓度极低的环境下, 海洋球石藻能大量富集硒并将其高效地转化为有机硒蛋白。这一转化可能与球石藻机体中的一种新的、高效的硒蛋白代谢途径相关[48-49], 球石藻机体能通过ATP转移系统将细胞外70 %的无机硒以低分子量化合物形式形成一个丰富的胞内“硒库”, 然后通过翻译系统合成硒蛋白[50]。
虽然硒主要与蛋白质结合, 但是Li等[38]的研究表明, 多糖富硒能力更强, 是蛋白质富硒能力的2倍以上。周志刚等[19]的研究显示, 由于细胞内外的环境不同导致胞外多糖结合硒的能力比胞内多糖更强。亚硒酸根离子进入细胞后, 因为细胞内为还原环境,多糖与硒结合能力不如蛋白质、脂类等其他有机物,所以硒在细胞内不易与多糖结合。而在细胞外, 由于氧化环境的存在, 无需生物体的代谢过程, 多糖—金属离子—亚硒酸根离子就能很容易地进行简单的化学配合形成配合物, 并且此配合物可吸附硒, 形成局部高硒区, 从而使细胞总硒含量迅速增加。也有人认为硒可能会取代多糖组成成分中某些含硫单糖的硫原子, 并且以糖苷键的形式与多糖结合[47]。此外,一些单糖和其他小分子糖上也能结合微量的硒[47]。
脂类结合硒的机理还有待研究, 但基于硒多与极性脂结合的实验结果[47], 推测硒主要偏向于以离子的形态与脂类中的双键或三键以非共价键的形式结合。
5 研究展望
富硒藻类的研究已经逐步深入, 涉及方方面面,主要包括硒质量浓度、形态等条件对不同藻类的生长和富集硒的影响, 硒在藻体细胞中的具体分布情况与藻类富集、转化硒的过程, 富硒藻类中硒形态、生物活性的异同, 等等。同时富硒藻类也已在生产和生活等多个方面起着关键作用。在环境污染治理方面, 可利用藻类的富硒能力来治理海洋中硒的污染以及硒工业中硒排放所造成的污染, 变废为宝。在环境监测方面, 可通过监测海洋藻类中硒的富集量,判断海洋中硒污染状况。在营养保健方面, 可利用富硒藻类进行生物有机硒补充, 将富硒藻开发为保健品及饵料。今后, 改良藻种, 优化培养条件以获得更高含硒量的藻类产品以及深入研究富硒藻类的生物活性和医疗保健等功能仍然是藻类吸收、富集和转化硒的研究热点和重点。
[1]Ebert R, Ulmer M, Zeck S, Meissner-Weigl J, et al.Selenium supplementation restores the antioxidative capacity and prevents cell damage in bone marrow stromal cells in vitro[J]. Stem Cells, 2006, 24(5): 1226-1235.
[2]Chang W P, Combs G F J, Scanes C G, et al.The effects of dietary vitamin E and selenium deficiencies on plasma thyroid and thymic hormone concentrations in the chicken[J]. Developmental & Comparative Immunology,2005, 29(3): 265-273.
[3]Patrick L.Selenium biochemistry and cancer: A review of the literature[J]. Alternative Medicine Review, 2004,9(3): 239-258.
[4]Rayman M P.The importance of selenium to human health[J]. The Lancet, 2000, 356(9225): 233-241.
[5]Arthur J R, McKenzie R C, Beckett G J.Selenium in the immune system[J]. The Journal of Nutrition, 2003,133(5): 1457-1459.
[6]Böck A, Forchhammer K, Heider J, et al. Selenocysteine:the 21st amino acid[J]. Molecular Microbiology, 1991,5(3), 515-520.
[7]赵少华, 宇万太, 张璐, 等.环境中硒的生物地球化学循环和营养调控及分异成因[J].生态学杂志, 2005,24(10): 1197-1203.
[8]Schomburg L, Schweizer U, Köhrle J.Selenium and selenoproteins in mammals:extraordinary, essential,enigmatic[J].Cellular and molecular life sciences, 2004,61(16): 1988-1995.
[9]Letavayova L, Vlckova V, Brozmanova J.Selenium:From cancer prevention to DNA damage[J].Toxicology,2006, 227(1-2): 1-14.
[10]樊海峰, 温汉捷, 凌宏文, 等.表生环境中硒形态研究现状[J]. 地球与环境, 2006, 34(2): 19-26.
[11]Cases J, Puig M, Caporiccio B, et al.Glutathione-related enzymic activities in rats receiving high cholesterol or standard diets supplemented with two forms of selenium[J]. Food Chemistry, 1999, 65(2): 207-211.
[12]Fan T W, Teh S J, Hinton D E, et al. Selenium biotransformations into proteinaceous forms by foodweb organisms of selenium-laden drainage waters in California[J]. Aquatic Toxicology, 2002, 57(1):65-84.
[13]毛文君, 管华诗, 李八方.几种海洋生物体内硒含量的测定[J].海洋湖沼通报, 1995, 4: 28-32.
[14]黄峙, 杨芳, 郑文杰.富硒螺旋藻中硒别藻蓝蛋白的纯化及其特性[J]. 微生物学报, 2006, 6(3): 401-405.
[15]刘艳, 桑敏, 李爱芬, 等.硒在紫球藻蛋白质、多糖和脂类物质中的累积与分布[J]. 中国海洋药物, 2010,29(3): 22-27.
[16]吕蓉, 张波.硒质量浓度对小球藻生长、生物富集的影响[J].盐业与化工.2008, 37(4): 35-37.
[17]刘静雯, 张稚兰, 杜翠红, 等.富硒海洋球石藻(Emiliania huxleyi)的培养及其硒蛋白的初步分离纯化[J].海洋与湖沼, 2010, 41(6): 879-884.
[18]黄峙, 郑文杰, 向军俭, 等.硒硫比值对钝顶螺旋藻有机化硒的影响及藻体中硒的形态、价态构成[J]. 海洋科学, 2002, 26(5): 60-62.
[19]周志刚, 李朋富, 刘志礼, 等.三种螺旋藻及其蛋白质、多糖和脂类结合硒的研究[J]. 海洋与湖沼, 1997,28(4): 364-370.
[20]周志刚, 钟罡, 刘志礼.硒对极大螺旋藻生长及含硒量的影响[J]. 海洋科学, 1997, 5: 42-45.
[21]郑文杰, 贺鸿志, 黄峙, 等.螺旋藻富集和转化硒研究进展[J]. 中国生物工程杂志, 2003, 23(1): 57-60.
[22]黄键, 陈必链, 吴松刚.环境因素对螺旋藻富集硒和锌及生长的影响[J]. 食品与发酵工业, 1999, 25(4):23-25.
[23]Gerhardt F R, James G S.The influence of pH and media composition on the uptake of inorganic selenium byChlamydomonas reinhardtii[J]. Environmental Toxicology and Chemistry, 1996, 15(9): 1577–1583.
[24]Fourniera E, Adam-Guillermina C, Potin-Gautierb M,et al.Selenate bioaccumulation and toxicity inChlamydomonas reinhardtii: Influence of ambient sulphate ion concentration[J]. Aquatic Toxicology,2010, 97(1): 51–57.
[25]李志勇, 郭祀远, 李琳.富硒螺旋藻培养技术研究[J].水生生物学报, 2001, 25(4): 386-391.
[26]Zuzana K, Agáta F, Marianna M, et al.Arsenic and selenium interactive effect on algaDesmodesmus quadricauda[J]. Ecotoxicology and Environmental Safety,2012, 86: 1–6.
[27]Wang W, Dei R C H.Influences of phosphate and silicate on Cr(VI)and Se(IV)accumulation in marine phytoplankton[J]. Aquatic Toxicology, 2001, 52(1):39-47.
[28]Yu R Q, Wang W X.Biokinetics of cadmium, selenium,and zinc in the freshwater algaScenedesmus obliquusunder different phosphorus and nitrogen conditions and metal transfer toDaphnia magna[J]. Environmental Pollution, 2004, 129(3): 443–456.
[29]Yu R Q, Wang W X.Biological uptake of Cd, Se(IV),and Zn byChlamydomonas reinhardtiiin response to different phosphate and nitrate additions[J]. Aquatic Microbial Ecology, 2004, 35: 163–173.
[30]Wang W, Dei R C H.Effects of major nutrient additions on metal uptake in phytoplankton[J]. Environmental Pollution, 2001, 111: 233–240.
[31]Dáša U, Milada V, Irena D, et al.Bioaccumulation and toxicity of selenium compounds in the green algaScenedesmus quadricauda[J].BMC Plant Biology,2009, 9: 58-73.
[32]Riedel GF, Sanders JG, Gilmour CC.Uptake,transformation, and impact of selenium in freshwater phytoplankton and bacterioplankton communities[J].Aquatic Microbial Ecology, 1996, 11: 43-51.
[33]喻达辉, 刘少明.钝顶螺旋藻对不同无机硒的吸收研究[J].海洋学报, 2000, 22(2): 137-141.
[34]杨逸萍, 胡明辉.海洋浮游植物对硒的摄取和转化[J].台湾海峡, 1996, 15(4): 319-323.
[35]杨莹莹, 管斌, 孔青, 等.极大螺旋藻的硒富集化培养研究[J]. 食品科学.2012, 33(1): 106-110.
[36]黄峙, 谭龙飞, 郭宝江.硒添加方法对螺旋藻生长及富集转化硒的影响[J]. 广州食品工业科技, 1999,15(2): 60-63.
[37]徐晶, 朱茂祥, 陈婉华, 等.螺旋藻富集同化无机硒研究[J]. 植物营养与肥料学报, 1997, 3(2): 169-175.
[38]Li Z Y, Guo S Y, Li L.Bioeffects of selenite on the growth ofSpirulina platensisand its biotransformation[J].Bioresource Technology, 2003, 89(2): 171-176.
[39]王大志, 程兆第, 高亚辉.硒对钝顶螺旋藻生长的影响及其在细胞中的累积和分布[J]. 台湾海峡, 1998,17(4): 433-438.
[40]陈必链, 庄惠如, 余望, 等.钝顶螺旋藻对锌和硒生物富集作用的研究[J]. 食品与发酵工业, 1998, 24(6):27-29.
[41]刘太胜, 李爱芬, 顾继光, 等.硒对紫球藻生长及光谱特性的影响[J]. 生态环境, 2006, 15(2): 224-228.
[42]王大志, 高亚辉, 程兆第.硒对两种盐藻生长的影响及其在细胞中的累积和分布[J]. 海洋学报, 1997,19(5): 110-115.
[43]Bottino N R, Banks C H, Irgikuc K J, et al.Selenium containing amino acids and proteins in marine algae[J].Phytochemistry, 1984, 23(11): 2445-2452.
[44]徐辉碧, 范华汉.生命科学中的微量元素[M]. 第 2版. 北京: 中国计量出版社.1996 : 620-668.
[45]Price N M, Harrison P J. Specific selenium-containing macromolecules in the marine diatomThalassiosira pseudonana[J]. Plant Physiology, 1988, 86(1): 192-199.
[46]张跃平, 王大志, 高亚辉, 等.硒在极大螺旋藻细胞中的分布特点及对生化组成的影响[J]. 海洋科学,2007, 31(2): 31-34.
[47]李志勇, 龚华斐. 富硒螺旋藻中硒的有机化及其分布特性[J]. 水生生物学报, 2003, 27(4): 440-442.
[48]Danbara A, Shiraiwa Y. The requirement of selenium for the growth of marine coccolithophorids,Emiliania huxleyi, Gephyrocapsa oceanicaandHelladosphaerasp. (Prymnesiophyceae)[J]. Plant and cell physiology,1999, 40: 762-766.
[49]Obata T, Shiraiwa Y. A novel eukaryotic selenoprotein inthe haptophyte algaEmiliania huxleyi[J]. Journal of Biological Chemistry, 2005, 280(18): 18462-18468.
[50]Obata T, Araie H, Shiraiwa Y. Bioconcentration mechanism of selenium by a coccolithophorid,Emiliania huxleyi[J]. Plant and cell physiology, 2004, 45(10):1434-1441.
