乳酸菌及其代谢产物对刺参幼体肠道菌群和非特异性免疫的影响
2013-10-13王宝杰蒋克勇邱楚雯骆作勇范瑞用
宫 魁, 王宝杰, 刘 梅, 蒋克勇, 邱楚雯, , 骆作勇, , 范瑞用,王 雷
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 中国科学院 研究生院, 北京 100049; 3. 青岛瑞滋海珍品发展有限公司, 山东 青岛 266400)
刺参(Apostichopus japonicus)属棘皮动物门(Echinodermata), 海参纲(Holothuroidea)。目前刺参已成为我国海水养殖业中产值最高的养殖品种。随着养殖产业的迅速发展, 病害问题日趋突出, 其中以“烂嘴”、“吐脏”、“摇头”、“化皮”等为主要特征的“刺参腐皮综合征”频繁发生, 不同程度地波及并危害到各主要刺参养殖产区, 每年造成严重的经济损失[1]。抗生素和化学药物在防治水产病害中虽然有其独特的作用, 但长期使用导致若干副作用, 如病原菌抗药性, 内源性感染和二重感染, 同时化学药物在水产动物体内残留, 直接危害人类健康[2]。因此,减少抗生素及化学药物的使用, 寻找替代药剂, 发展生态养殖是刺参养殖业的必由之路。
作为微生态制剂的主要菌种, 乳酸菌在畜禽业已被广泛应用, 其具有无毒副作用、促进动物生长、提高饲料转化率、可替代抗生素等优点。但其在水产养殖中应用较少, 作用机理不明确, 限制了其在水产养殖业的推广。本研究通过研究乳酸菌及其代谢产物对刺参肠道菌群、非特异性免疫及特定生长率影响, 初步探索在刺参养殖中的乳酸菌菌体与代谢产物所起益生作用, 以期为乳酸菌制剂在刺参养殖中的应用提供参考。
1 材料与方法
1.1 乳酸菌制剂
乳酸菌: 市售商品化菌种(干粉保存), 经分析检测为屎肠球菌(Enterococcus faecium)与植物乳杆菌(Lactobacillus plantarum)的混合菌种。经实验室活化后, 小型发酵罐中试发酵, 经平板计数法检测发酵液活菌密度为4×109个/mL, 4℃保存备用。
乳酸菌代谢产物: 将乳酸菌发酵液置于-20℃冰箱保存48 h , 4℃, 6000 r/min, 30 min, 连续离心3次。经平板计数法检测其剩余乳酸活菌密度约为103个/mL。
1.2 试验动物
试验用刺参由青岛瑞滋海珍品发展有限公司提供, 为同一批孵化, 挑选规格基本一致的健康刺参,初始平均体质量为(2.74 ± 0.17)g。
1.3 方法
1.3.1 试验管理
试验于青岛瑞滋海珍品发展有限公司海参育苗场进行。挑选个体规格一致的健康刺参, 随机分为3组, 每组5个重复, 分别放入5 m×3 m×1m的养殖池,每池布苗量为 40 kg。按照常规生产规程进行管理,连续充气, 每天14:00投喂一次饵料, 日投饵量为刺参体质量的5%, 根据摄食、生长及粪便情况随时调整。每天换水 50%。试验期间水温 13~15℃, pH7.83~8.14, 溶解氧5.7~6.8 mg/L。鲜海泥取自青岛胶南琅琊海域, 用量为干饲料质量的 8倍。实验自 2011年 12月3日开始。对照组饲喂基础饲料(表1), 乳酸菌实验组添加 2mL/m3(按水体折算)乳酸菌制剂, 乳酸菌代谢产物组添加2 mL/m3(按水体折算)乳酸菌代谢产物。

表1 基础饲料搭配比例Tab.1 Composition of experimental basal diets
1.3.2 微生物分析
每组随机取3头刺参, 无菌解剖取其肠道, 去除肠道粪便, 无菌生理盐水充分冲洗后, 置于灭菌的玻璃匀浆器中, 加入适量无菌生理盐水匀浆, 倍比稀释,选择合适的稀释度取0.1mL, 分别接种2216E平板、麦康凯平板、TCBS平板和MRS平板, 并用无菌玻璃涂布棒涂布均匀, 培养适宜时间后, 进行平板细菌计数。
1.3.3 免疫指标
每组随机取 20头刺参, 解剖取体腔液, 吸取抗凝剂, 与体腔液体积比1:1混匀。所得体腔液, 一部分直接用于体腔细胞计数、吞噬活性的测定; 另一部分离心10 min(3000r/min, 4℃)后弃上清, 用含0.1 mmol/L苯甲基磺酞氟的 PBS缓冲液将体腔细胞沉淀物重悬,VC130超声波破碎仪(美国)破碎(22kHz, 15~20s)悬液中的细胞, 4000 r/min, 4℃离心10 min, 所得上清液即为细胞破碎上清液(CLS), CLS用于碱性磷酸酶(AKP)、酸性磷酸酶(ACP)和溶菌酶(LSZ)活力的测定。上述酶活采用上海生工试剂盒进行测定, 相关操作及计算均按试剂盒说明进行。体腔液细胞的吞噬活性测定参考王斌等[3]方法, 将200μL体腔细胞在96孔板中贴壁30 min后, 弃上清, 每孔加入100 μL中性红(体积分数0.1%)吞噬30 min后, PBS缓冲液冲洗3遍, 洗去未被吞噬的中性红, 加入 200 μL细胞裂解液裂解 20min,全波长酶标仪540 nm处读取吸光值, 结果以每108个细胞的吸光值来表示吞噬活性的高低。
1.3.4 特定生长率
试验持续60 d, 分别在试验第20天、第40天和第 60天随机取样, 分析天平(精确度为 0.001g)称质量, 测定特定生长率(RSG)。计算公式:
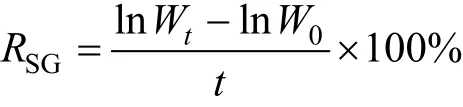
1.3.5 统计分析
数据用 spss16.0软件进行单因素方差(ANOVA)分析, 多重比较采用 LSD法进行。结果以平均值±标准误(M±SD)表示。
2 结果与分析
2.1 刺参肠道菌群变化

表2 投饲乳酸菌及其代谢产物后刺参肠道菌群变化(M±SD)Tab.2 The changes of intestinal microflora after using probiotics(M±SD)
连续投饲20d, 两实验组刺参肠道乳酸菌均显著增多(P<0.05); 40、60d, 两实验组刺参肠道乳酸菌也有一定程度增多。在试验期间, 两实验组大肠杆菌菌落数均显著减少(P<0.05)。弧菌增殖亦受一定抑制; 除40d,乳酸菌组弧菌量与对照组差异不显著外, 两实验组弧菌均显著降低(P<0.05)。刺参肠道异养菌总数在第40天差异显著(P<0.05), 其余时间差异不明显(表2)。
2.2 免疫指标
2.2.1 体腔细胞计数
连续投饲乳酸菌与乳酸菌代谢产物, 乳酸菌实验组、代谢产物实验组和对照组体腔细胞含量差异不显著, 表明乳酸菌及其代谢产物对刺参体腔细胞数量影响不明显(表3)。

表3 乳酸菌与其代谢产物对刺参体腔细胞的影响(M±SD)Tab. 3 The effects of lactic acid bacteria and its metabolites on coelomocyte of Apostichopus japonicus (M±SD)
2.2.2 体腔细胞吞噬活性
连续投喂乳酸菌及其代谢产物, 刺参体腔细胞吞噬活性明显上升(P<0.05)。其中乳酸菌实验组和代谢产物实验组体腔细胞吞噬活性在40、60 d差异不显著(表4)。对照组在20、40、60 d体腔细胞吞噬活性均显著低于乳酸菌实验组和代谢产物组(P<0.05)。
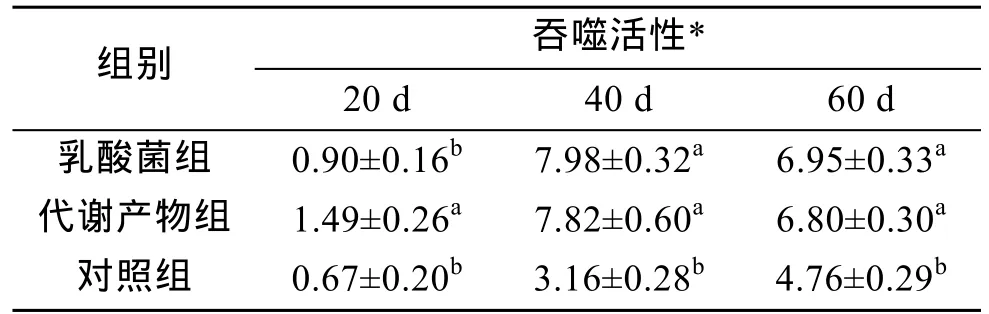
表4 乳酸菌与其代谢产物对刺参体腔细胞吞噬活性的影响(M±SD)Tab. 4 The effects of lactic acid bacteria and its metabolites on phagocytic activity of coelomocyte (M±SD)
2.2.3 体腔细胞免疫酶活性
刺参ACP活性测定结果见图 1。20、40、60 d活性乳酸菌组、代谢产物组与对照组刺参ACP差异显著(P<0.05), 且乳酸菌组与代谢产物实验组 ACP活性差异均不显著。表明投喂乳酸菌和乳酸菌代谢产物均可在一定程度上提高刺参体腔细胞ACP活性,且两者之间差异不显著。
刺参体腔细胞AKP活性测定结果见图2。乳酸菌组与代谢产物组, 体腔细胞AKP活性在20、40、60 d差异均不显著, 而对照组AKP活性显著低于各实验组(P<0.05)。表明乳酸菌、乳酸菌代谢产物在本实验条件下, 均可显著提高体腔细胞 AKP活性,且两者差异不显著。
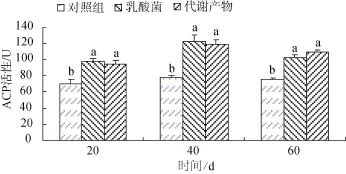
图1 乳酸菌与乳酸菌代谢产物对刺参体腔细胞ACP的影响Fig.1 The effects of lactic acid bacterial and metabolites on ACP of coelomocytes

图2 乳酸菌与乳酸菌代谢产物对刺参体腔细胞AKP的影响Fig.2 The effects of lactic acid bacterial and metabolites on AKP of coelomocytes
乳酸菌与乳酸菌代谢产物均能促进刺参体腔细胞LSZ活性(图3)。但在20d, 乳酸菌实验组与对照组 LSZ活性差异不显著。40 d, 各实验组与对照组LSZ差异均不显著。表明乳酸菌及乳酸菌代谢产物均能促进体腔细胞 LSZ活性, 但作用效果可能受其他因素影响而不稳定。
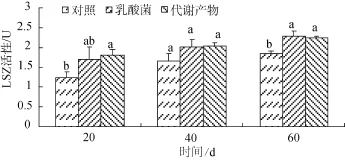
图3 乳酸菌与乳酸菌代谢产物对刺参体腔细胞LSZ的影响Fig.3 The effects of lactic acid bacterial and metabolites on LSZ of coelomocytes
2.3 特定生长率
乳酸菌和乳酸菌代谢产物连续投喂稚参, 均可提高刺参特定增长率(表5)。20~40 d, 乳酸菌实验组RSG显著高于对照组(P<0.05); 40~60 d, 乳酸菌代谢产物实验组刺参RSG显著高于对照组(P<0.05)。在试验期间, 乳酸菌实验组与乳酸菌代谢产物组刺参RSG未表现出显著差异。
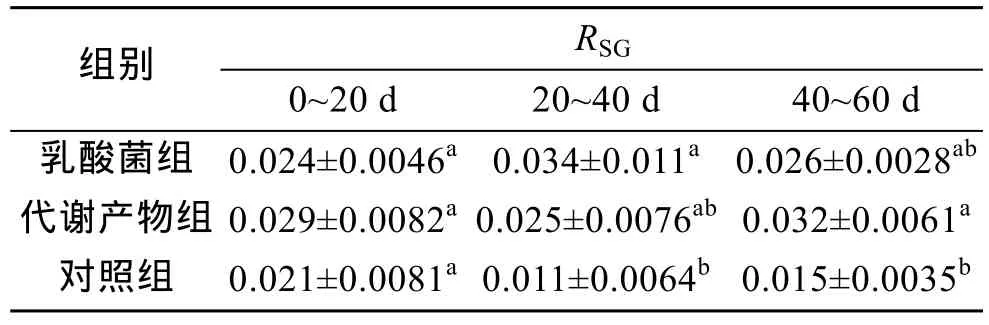
表5 乳酸菌及其代谢产物对刺参特定生长率的影响(M±SD)Tab.5 The effects of lactic acid bacteria and its metabolites on RSG of Apostichopus japonicus (M±SD)
3 讨论
目前针对乳酸菌的研究, 大多关注菌体与代谢产物共同作用效果[1-2,4], 未有分别针对乳酸菌菌体和乳酸菌代谢产物作用效果的研究。本实验在前人研究基础上, 将乳酸菌制剂中的菌体分离, 对乳酸菌发酵产物和乳酸菌制剂作用效果进行比较, 通过对比试验, 比较乳酸菌制剂与代谢产物各自益生效果, 为揭示乳酸菌作用机理提供参考。虽前处理未能将乳酸菌活菌彻底去除, 但代谢产物中活菌含量远低于乳酸菌制剂(相差 106倍), 应能通过刺参养殖实验比较乳酸菌菌体与发酵代谢产物各自所起益生功能。
动物肠道菌群和肠黏膜结合形成的机械屏障、免疫屏障与生物屏障不仅发挥着保持机体内环境稳定的作用, 而且能有效防止致病物质的入侵和菌群内毒素的位移, 在维护机体健康方面起着至关重要的作用[4-9]。许禔森研究发现, 在投喂短乳酸杆菌菌液和冻干菌粉后, 草鱼肠道的短乳酸杆菌稳定定殖,其数量呈上升趋势, 弧菌的数量下降[8]。曾地刚等发现投喂乳酸杆菌可有效抑制罗非鱼肠道病菌的增殖[9]。胡毅等研究发现饲料中添加芽孢杆菌显著降低了凡纳滨对虾肠道和粪便中的弧菌[4]。上述研究多认为, 外源有益菌可定殖于机体肠道, 通过与有害微生物竞争生态位点, 抑制有害菌繁殖, 进而对肠道微生态产生有益调节。本研究发现, 投喂乳酸菌及其代谢产物均能对刺参肠道菌群产生有益调节, 肠道乳酸菌均有所提高, 与许禔森等人研究结果相同;而有害菌群如大肠杆菌与弧菌增殖均受到显著抑制,与胡毅等人研究结论一致。但乳酸菌实验组与代谢产物实验组两者差异不显著, 表明两者之间应有相同成分起到调节肠道微生态的作用。而乳酸菌代谢产物经前处理后, 其活菌菌体显著减少, 代谢产物大量留存, 表明两者共有的乳酸菌代谢产物起到了调节肠道微生态的主要功能。且实验所用乳酸菌菌株来源于陆地, 前期研究发现其并不适于海洋环境,在刺参养殖环境下存活率很低(相关结果另文发表)。本研究中, 作者认为并不是乳酸菌通过肠道定殖,与有害微生物竞争来调节肠道微生态, 而是乳酸菌代谢产物对刺参肠道菌群起主要调节作用。研究发现乳酸菌代谢产物中不仅有大量酸性物质, 且通常含有细菌素(bacteriocin)类物质[10-11], 具有较好的抑菌效果。本实验菌株由植物乳杆菌和屎肠球菌复合。屎肠球菌与植物乳杆菌在发酵过程中, 同时会产生大量的乙酸、乳酸及大量活性抑菌物质, 这些发酵产物随饲料进入刺参消化道后, 降低肠道内的pH和氧化还原电位值 Eh, 使肠道处于酸性环境, 拮抗病原性细菌, 从而抑制其增殖, 促进乳酸菌等有益菌群的生长, 调节刺参肠道微生态, 提高刺参抗感染能力。
棘皮动物体腔细胞是棘皮动物的免疫核心成分,其密度在一定程度上反映了棘皮动物机体的免疫应激能力或健康状况[12]。而细胞吞噬作用在无脊椎动物的抗菌防御中起着非常重要的作用。本实验发现,投喂乳酸菌制剂及其代谢产物均未对刺参体腔细胞密度产生显著性影响, 但体腔细胞吞噬活性有所提高。有研究发现, 饲喂鼠李糖乳酸杆菌(Lactobacillus rhamnosus), 可以显著提高罗非鱼细胞吞噬活性[13],本实验与上述研究结果相近。乳酸菌制剂及乳酸菌代谢产物均对体腔细胞吞噬活性有积极影响, 可能与乳酸菌发酵过程中产生的活性代谢产物促进刺参吞噬细胞活性有关, 具体作用机理还需要进一步实验予以验证。
刺参作为低等动物, 其免疫系统不完善, 主要依靠非特异性免疫来提高对病原的抵抗力。ACP、AKP与 LSZ是反映刺参免疫能力的重要指标, 在刺参防御体系中发挥重要的作用。Gullia等发现投喂肠道分离芽孢杆菌, 显著提高对虾血清酚氧化酶活力[14]。Salinas等[15]发现芽孢杆菌和乳酸菌对乌颊鱼免疫效果具有较好的促进作用。王永胜等[16]用益生菌饲喂凡纳滨对虾时实验组溶菌酶、碱性磷酸酶、氧化物歧化酶等指标方面均高于对照组。上述对益生菌的研究, 多发现其能有效促进水产动物非特异性免疫酶活性, 但未揭示菌体还是代谢产物或者二者共同对免疫酶活发挥作用。本实验中, 乳酸菌制剂和乳酸菌代谢产物对刺参ACP、AKP和LSZ活性均有显著促进, 且两者之间对上述酶活影响差异不显著, 对刺参免疫酶活作用效果与上述研究一致。本实验表明, 含乳酸菌活菌的乳酸菌制剂和去乳酸菌菌体的代谢产物之间对刺参免疫酶活影响差异较小, 作为两者共有的代谢产物, 起到了主要促进刺参免疫酶活性的作用。而本实验所用乳酸菌菌体对刺参免疫酶活所起作用很小, 或可忽略不计。
实验采用SGR作为生长指标, 可很好的描述动物当时的生长趋势。乳酸菌能产生 B族维生素, 包括叶酸、生物素、维生素B6和维生素K等, 能够直接为宿主提供必需的营养物质, 促进动物生长[17]。有研究认为, 益生菌促生长机理可能与饲喂益生菌后动物机体肠道消化酶活性的提高有关[18]。本实验中,乳酸菌和代谢产物对刺参RSG均有所提高。表明乳酸菌代谢产物对刺参生长有一定的促进作用。刺参消化道相对比较简单, 对营养物质的消化体系不完善,通过在饲料中添加适量乳酸菌制剂, 可补充刺参消化体系中的不足, 促进对营养物质的消化吸收利用率, 从而提高刺参RSG, 实验结果与上述文献的结论相同。
综上, 乳酸菌与乳酸菌代谢产物之间对刺参肠道菌群、非特异性免疫与 SGR影响差异较小, 但均显著优于对照组。表明本实验所采用乳酸菌制剂, 其代谢产物在对刺参的益生影响中发挥主要作用。需注意的是, 本实验未能将发酵液中的乳酸菌活菌彻底去除, 对实验结论可能有所干扰。探明有益菌菌体与代谢产物之间各自对刺参所起益生作用, 尚需进一步实验予以验证。
[1]宋爱环, 李成林, 朱虎, 等. 刺参养殖池塘中一株益生芽孢杆菌的分离及鉴定[J]. 海洋科学, 2011, 35 (5): 38-41.
[2]王亚敏, 王印庚. 微生态制剂在水产养殖中的作用机理及应用研究进展[J].动物医学进展, 2008, 29 (6):72-75.
[3]王斌, 赵文, 范薇, 等. 复方中药制剂对草鱼免疫细胞功能及抗病力影响的初步研究[J]. 大连水产学院学报, 2007, 22(3): 203-206.
[4]胡毅,谭北平, 麦康森, 等. 饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J]. 中国水产科学, 2008, 15(2): 244-251.
[5]雷春龙, 董国忠. 肠道菌群对动物肠黏膜免疫的调控作用[J]. 动物营养学报, 2012,24(3): 416-422.
[6]Balcázar J L, Blas I D, Ruiz-Zarzuela I, et al. Review:The role of probiotics in aquaculture [J]. Veterinary Microbiology, 2006, 114: 173-186.
[7]Vine N G, Leukes W D, Kaiser H, et al. Competition for attachment of aquaculture candidate probiotic and pathogenic bacteria on fish intestinal mucus [J]. Journal of Fish Diseases, 2004, 27(6): 319-326.
[8]许禔森. 短乳酸杆菌对草鱼幼鱼养殖水体和肠道菌群的影响[J]. 德州学院学报, 2008, 24(2): 60-63.
[9]曾地刚, 雷爱莹. 乳酸杆菌对罗非鱼生长和抗病力的影响[J]. 南方农业学报, 2011,42 (3): 328-331.
[10]Cintas L M, Casaus P, Holo H , et al. Enterocins L50A and L50B, two novel bacteriocins fromEnterococcus faeciumL50, are related to staphylococcal hemolysins[J]. Journal of Bacteriology, 1997, 180(8): 1988-1994.
[11]Laukov M M. Partial characterization of bacteriocins produced by environmental strainEnterococcus faeciumEK13 [J]. Journal of Applied Microbiology,2003, 94(3): 523-530.
[12]常杰, 牛化欣, 张文兵. 刺参免疫系统及其免疫增强剂评价指标的研究进展[J]. 中国饲料, 2011, 6: 8-12.
[13]Pirarat N, Kobayashi T, Katagiri T, et al. Protective effects and mechanisms of a probiotic bacteriumLactobacillus rhamnosusagainst experimentalEdwardsiella tardainfection in tilapia (Oreochromis niloticus)[J]. Veterinary Immunology and Immunopathology, 2006, 113(3-4), 339-347.
[14]Gullian M, Thompson F, Rodriguez J. Selection of probiotic bacteria and study of their immunostimulatory effect inPenaeus vannamei[J]. Aquaculture, 2004, 233(1-4): 1-14.
[15]Salinas I, Cuesta A, Esteban M. Dietary administration ofLactobacillus delbrùeckiiandBacillus subtilis, single or combined, on gilthead seabream cellular innate immune responses [J]. Fish and Shellfish Immunology, 2005,19(1):67-77.
[16]王永胜, 钱鲁闽. 三类免疫制剂对凡纳滨对虾非特异性免疫效应的研究[J]. 台湾海峡,2006, 25 (1): 41-47.
[17]王玉堂. 乳酸菌及其在水产养殖中的应用[J]. 中国水产, 2009,10: 56-58.
[18]Ziaei-Nejad S, Habibi R M, Takami G A, et al. The effect ofBacillusspp. bacteria used as probiotics on digestive enzyme activity, survival and growth in the Indian white shrimpFenneropenaeus indicus[J].Aquaculture, 2006, 252: 516-524.
