不同来源堆肥腐殖质还原菌异化铁还原能力评估与调控
2018-10-29赵昕宇范钰莹席北斗檀文炳何小松
赵昕宇,范钰莹,3,席北斗*,檀文炳,何小松,张 慧,李 丹
不同来源堆肥腐殖质还原菌异化铁还原能力评估与调控
赵昕宇1,2,范钰莹1,2,3,席北斗1,2*,檀文炳1,2,何小松1,2,张 慧1,2,李 丹1,2
(1.中国环境科学研究院环境基准与风险评估国家重点实验室,北京100012;2.中国环境科学研究院国家环境保护地下水污染模拟与控制重点实验室,北京 100012;3.东北农业大学,黑龙江哈尔滨 150030)
通过富集不同来源堆肥过程中的腐殖质还原菌,并分析比较其异化铁还原能力差异,发现其电子转移能力从大到小依次为:蛋白类>纤维素类>木质素类.相关性分析表明,和是极显著影响异化铁还原的腐殖质还原菌属.利用冗余分析探究关键腐殖质还原菌与堆肥过程微环境因子的响应关系,结果发现可溶性有机氮是影响这些关键腐殖质还原菌变化的主要微环境因素.在此基础上,基于堆肥微环境因子与关键腐殖质还原菌菌群结构之间的响应关系,提出一种促进异化铁还原相关的腐殖质还原菌生长的调控方法.本研究可以深入了解堆肥中影响腐殖质还原菌群落的关键因素,而且对于环境中污染物生物地球化学循环也具有重要的生态学意义.
腐殖质还原菌;16S rDNA;异化铁还原;冗余分析;堆肥
微生物可通过调节特定的生物化学途径,降解或还原有机、无机污染物[1-2].这在污染物原位修复、污水处理以及生物燃料提取等方面呈现出不可替代的优越性和重要的应用前景,电子转移是新陈代谢的基础,地球所有能量都来源于氧化还原过程.腐殖质呼吸是近年来新发现的可参与环境修复生物降解过程的能量代谢方式,能够进行腐殖质呼吸的微生物称之为腐殖质还原菌[3],腐殖质还原菌作为一个庞大且复杂的生物类群,对重金属及有机污染物的降解起到重要作用,腐殖质还原菌是以AQDS或腐殖质作电子受体时进行胞外电子传递的一类微生物,腐殖质和腐殖质还原菌之间的这种电子穿梭被认为是促进重金属与有机污染物降解转化的主要原因[4-6].腐殖质还原菌还原腐殖质的生物化学途径与腐殖质还原菌还原Fe(III)的生化机制很相似[7-8],并且大多数的腐殖质还原菌都具有还原铁的功能[9-11].
腐殖质还原菌普遍存在于自然环境中,学者们已经在土壤、泥炭地、污泥、湖泊沉积物、河流沉积物、海洋沉积物以及水体等环境介质中分离富集出多种具有腐殖质呼吸功能的微生物[12].并且在许多极端环境下,也分离出多种具有电子传递能力的微生物,例如嗜热菌、嗜酸菌和嗜碱菌等[13].按照对氧气的需求不同,腐殖质还原菌又可以分为兼性厌氧菌和严格厌氧菌,主要集中在以下3个门: Proteobacteria、Acidobacteria与Firmicutes[12].堆肥是一个以微生物为驱动力,大量合成腐殖质的生物化学过程.腐殖质的形成可能诱导堆肥过程中腐殖质还原菌的生长,并且该过程中微环境因子的变化可能会影响腐殖质还原菌的群落组成与活性[14-15].然而,对于不同来源物料在堆肥过程中腐殖质还原菌的铁还原能力差异及其影响因素却鲜有报道.并且,现如今从自然环境中分离的腐殖质还原菌仅占可培养微生物的0.1%.
本研究主要目的为:探究不同物料堆肥过程腐殖质还原菌对异化铁还原电子转移能力差异;筛选具有高效异化铁还原能力的腐殖质还原菌;探究其关键影响因素,并提出一种促进筛选出的腐殖质还原菌生长的调控方法.
本研究主要探究6种物料:鸡粪(CM)、牛粪(DCM)、果蔬(FVW)、杂草(WW)、秸秆(SW)及枯枝(GW)在堆肥过程中腐殖质还原菌的电子转移能力及其影响因素,并构建一种可促进腐殖质还原菌生长的微环境调控方法.为堆肥物料中的污染物降解或应用富含腐殖质堆肥产品修复污染土壤提供参考.
1 材料与方法
1.1 主要仪器及实验设计
实验样品采集、堆肥实验搭建详见前期文章[11].采集阶段为升温期(CM1、DCM1、FVW1、WW1、SW1和GW1)、高温期(CM2、DCM2、FVW2、WW2、SW2和GW2)和腐熟期(CM3、DCM3、FVW3、WW3、SW3和GW3).
有机质(organic matter, OM)采用灼烧法测定;含水率采用马弗炉测烧失量法测定,在105℃下灼烧6h后测量烧失量;可溶性有机碳(Dissolved organic carbon, DOC)、可溶性有机氮(Dissolved organic nitrogen, DON)均采用岛津TOC-VCPH有机碳分析仪测定;总氮采用凯氏消煮法测定;NH4+-N采用纳氏比色法测定;NO3--N采用分光光光度计法测定.以上指标的测定结果曾发表于先前研究中,详见文章[16].
1.2 腐殖质还原菌培养及异化铁还原试验
腐殖质还原菌培养采用富集培养基(BAS培养基),具体成分详见前期文章[16].
6种物料经5mm筛,用去离子水冲洗,沉降30min后弃上层混浊液,取下层泥浆,重复多次再使用.取5mL堆肥泥浆于装有50mL富集培养基的西林瓶中,室温下80% N2和20% CO2充20min,盖橡胶塞.为了使富集培养基环境与原始物料环境尽可能保持一致,调节CM1、CM2、CM3、DCM1、DCM2、DCM3、FVW1、FVW2、FVW3、WW1、WW2、WW3、SW1、SW2、SW3、GW1、GW2及GW3的pH值为8.0、8.8、8.6、8.0、8.9、8.4、8.1、8.7、8.2、6.7、8.9、8.4、8.0、8.8、8.6、6.2、7.7及8.2,分不同堆肥阶段放置于不同温度的厌氧培养箱(升温期40℃,高温期58℃及腐熟期43℃)中培养.3d后将其开盖至上清液橙红色褪去,8h内使AQDS还原率达到80%可视为腐殖质还原菌驯化成功.
分别将MR-1菌株[12](对照)及堆肥腐殖质还原菌在LB液体培养基中培养至对数生长期(约18h),培养温度为30℃,然后将其在4℃下离心10min(8000r/min),倾去上清液.用已灭菌的BAS培养液洗涤菌体,再次离心,重复多次,最终用等体积BAS培养液重新制成菌悬液,以无菌液BAS培养基作空白对照,在紫外吸收波长为600nm下,将所有菌体浓度均调至0.18,以保证一致性.在100mL西林瓶中进行反应,配制20mmol/L Fe (III)-critrate溶液作电子受体,以5mmol/L乳酸钠作电子供体,加入200 µL菌液,最终反应体系为50mL.室温下用80% N2和20% CO2充20min,pH值调至7.4.将样品摇匀后,用注射器取2mL,过0.22µm纤维素滤膜,采用邻菲啰啉分光光度法于510nm测定滤液吸光度,计算Fe(II)浓度,每24h测定一次直到最终达到稳定.利用一级动力学方程进行拟合[17],求得不同堆肥中腐殖质还原菌还原Fe(III)的常数.方程的表达式:
Fe= Fe0[1-exp (-×)]
式中:Fe为时刻Fe(II)的生成量, mmol/L;Fe0为Fe(II)的潜在生成量, mmol/L;为培养时间,h;为反应速率常数,h-1.
1.3 DNA 提取及16SrDNA测序
使用E.Z.N.A.TM土壤DNA提取试剂盒(Omega Bio-tek,广州)提取六种物料的DNA,使用Illumina MiSeq测序仪测序,采用合成测序法,对最终获得clean数据进行OTU聚类分析和物种分类学分析.在物种分类学上,对于序列进行精细至分类学上属的划分.
1.4 数据分析
运用SPSS 19.0、Origin 8.0、Canoco for windows 4.5进行数据分析.
2 结果与讨论
2.1 腐殖质还原菌异化铁还原特征
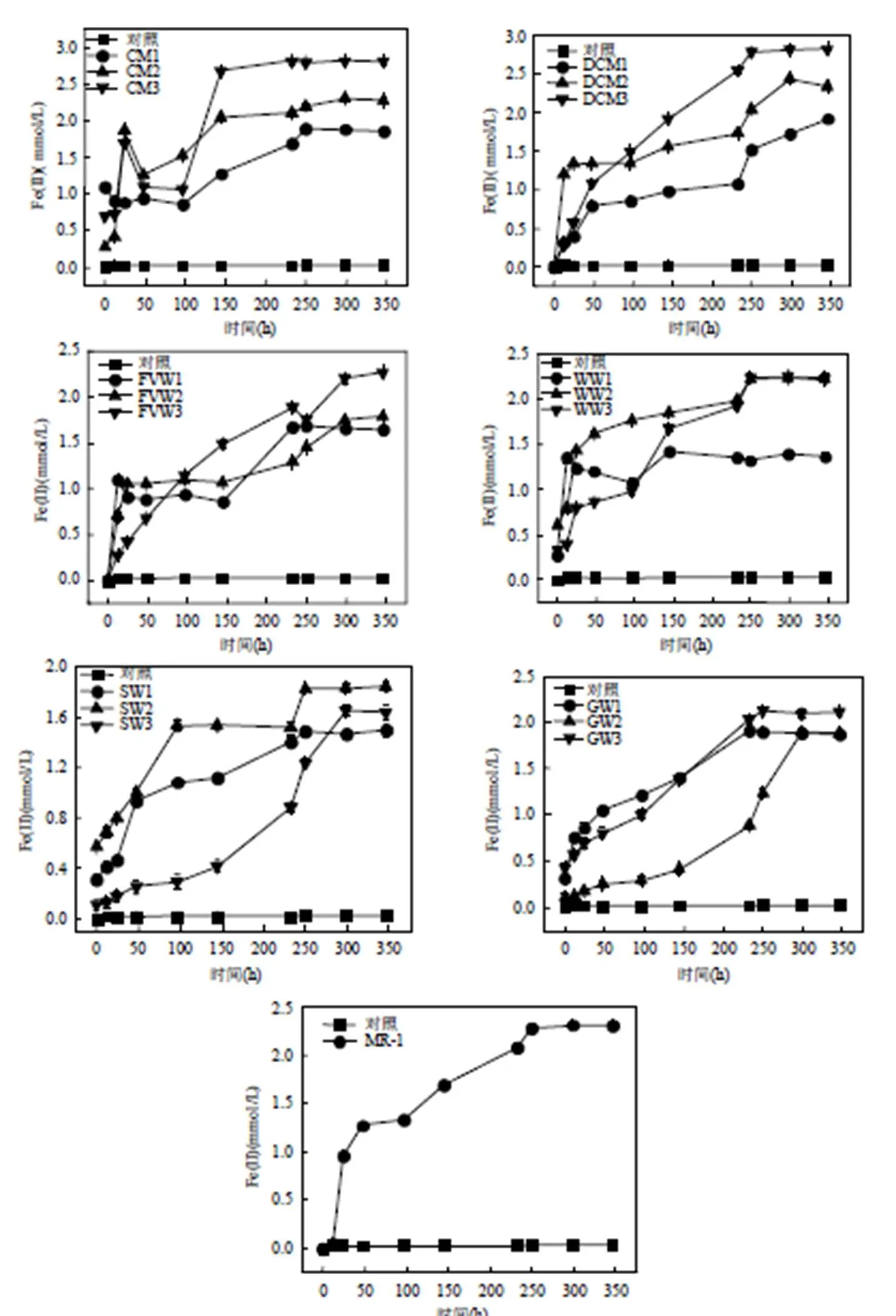
图1 不同物料堆肥中腐殖质还原菌与S.oneidensis MR-1对Fe(III)还原的影响
为反映腐殖质还原菌还原腐殖质的能力,利用腐殖质还原菌与Fe(III)-citrate进行直接接触反应,绝大部分腐殖质还原菌具有还原Fe(III)的功能[18], Fe(III)逐渐被腐殖质还原菌还原为Fe(II),以Fe(III)还原量间接代表腐殖质还原菌还原腐殖质的能力.如图1所示,不同物料类型堆肥过程中腐殖质还原菌的还原能力呈现不同的变化趋势.与相应对照组比较,不同来源堆肥过程中的腐殖质还原菌均能明显还原Fe(III).
一级动力学方程可以较好的描述Fe(III)-citrate还原动态变化(表1),方程拟合的相关系数均达到显著水平(<0.1).不同物料堆肥的3个阶段的值变化存在差异,而在堆肥的升温期,纤维素类物料(FVW、WW)反应速率显著高于其它物料(<0.05).而蛋白类物料(CM、DCM)在高温期的反应速率达到最高,至腐熟期反应速率仍保持较高水平.这说明不同物料的物质组成及结构对腐殖质还原菌还原异化铁能力有不同的影响.堆肥初期腐殖质还原菌利用纤维素分解的单糖等营养物质进行生长代谢[19],异化铁电子受体利用量增多,其还原能力随之增强.而蛋白类物料中的营养物质丰富,且在高温期的蛋白质大量降解[20],造成腐殖质还原菌代谢活动反应剧烈,反应速率随之升高.

表1 Fe(III)还原能力的一级动力学方程拟合结果
与MR-1的还原能力相比(图2a),堆肥腐熟期CM3、DCM3、FVW3、WW3、GW3及SW3中腐殖质还原菌的还原能力分别是模式菌株MR-1还原能力的1.22、1.23、0.99、0.97、0.92及0.71倍.由此可以说明,经过堆肥后,蛋白类物料(CM、DCM)中腐殖质还原菌电子转移能力相比其他物料堆肥更强.CM、DCM、FVW及WW中腐殖质还原菌的还原能力随堆肥过程呈明显增加趋势.这可能是由于蛋白类与纤维素类物料在初始阶段较易降解,可相对快速地形成氧化还原功能基团,并影响腐殖质还原菌的电子转移力.而与之相比,木质素类物料(GW、SW)中腐殖质还原菌的电子转移能力相对较低,且随堆肥过程变化不显著.这主要是由于木质素类物料在堆肥过程中较难降解,腐殖质还原菌获得营养物质相对较少,堆肥过程中形成氧化还原功能基团相对缓慢,导致期腐殖质还原菌电子转移能力相对较弱.总之,不同堆肥中形成腐殖质的分子量及结构不同,腐殖质还原菌通过堆肥过程中形成的腐殖质做电子受体从而获得自身生长的能力不同[21],进而影响堆肥中腐殖质还原菌的还原能力.图2(b)可更为清晰的分析不同物料堆肥过程中腐殖质还原菌的电子转移能力差异.从总体上看,腐殖质还原菌的电子转移能力的变化量从大到小依次为CM>DCM>WW>FVW>GW>SW.因此,也可进一步证明,堆肥过程对蛋白类物料中腐殖质还原菌的提升能力最强,其次为纤维素类与木质素类.

2.2 腐殖质还原菌与异化铁还原能力相关性分析
由于本研究中培养为富集培养,培养后为腐殖质还原菌菌群,因此哪种腐殖质还原菌显著影响Fe(III)的还原尚不清晰,且还原的机制也尚不明确,因此,本研究采用相关性分析进一步筛选哪一种或几种腐殖质还原菌对Fe(III)还原具有显著作用.其中,不同物料堆肥过程中腐殖质还原菌的群落结构发表于前期研究[16]中.相关性分析结果如图3,共有100个腐殖质还原菌菌属与Fe(III)的还原呈正相关关系.由图3中可以看出,腐殖质还原菌归属于4个菌门:Actinobacteria、Bacteroidetes、Firmicutes和Proteobacteria,大部分还原Fe(III)的腐殖质还原菌集中于Proteobacteria,其次为Firmicutes,而Actinobacteria和Bacteroidetes相对较少.在6种不同物料堆肥中,纤维素类物料FVW和WW中促进Fe(III)还原的相关菌属分别为37个和39个,高于蛋白类物料CM(23个)和DCM(31个),而木质素类物料SW和GW中含有促进还原能力的腐殖质还原菌较少,分别为16个和8个.这可能由于纤维素类物料在堆肥前期不易分解,堆肥后期逐渐被纤维素菌分解为小分子物质,该类营养物质易被腐殖质还原菌吸收利用[19],微生物代谢加快,可加速堆肥过程中腐殖质还原菌电子转移能力的驯化.堆肥腐熟期大量的腐殖质类物质累积,从而丰富了纤维素类物料中腐殖质还原菌的多样性.相比于纤维素类物料,蛋白质类物料中腐殖质还原菌与异化铁还原呈正相关的菌种略少,然而蛋白类物质的平均还原能力在6种物料中最强,这可能是由于蛋白类物质利于分解,腐殖质形成速度相对较快,腐殖质还原菌的氧化还原能力也相对较强[20].因此蛋白类物料经过堆肥驯化后,尽管促进Fe(III)还原相关菌属的多样性较低于纤维素类物料,但其还原异化铁能力却高于纤维素类物料.
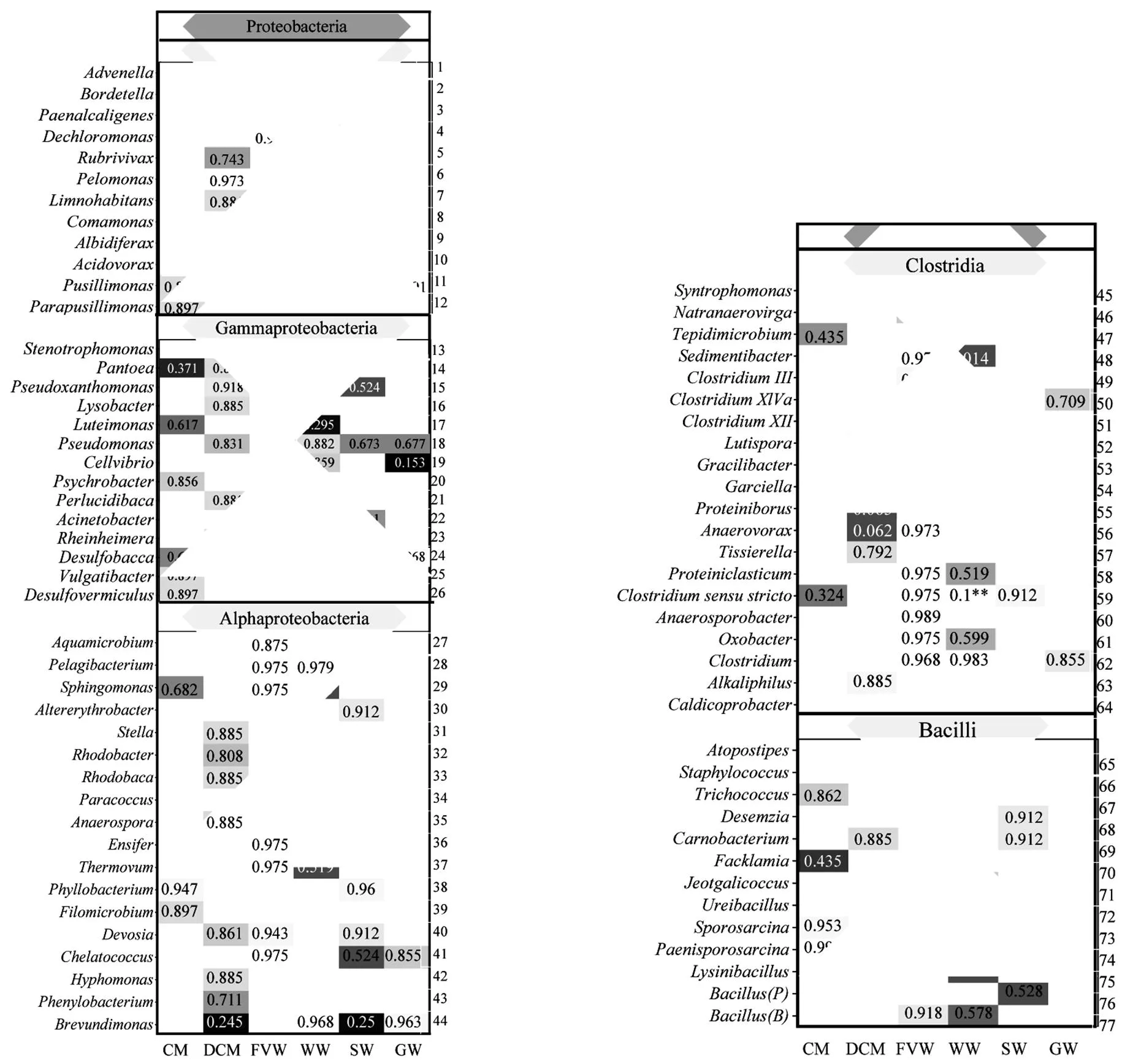
菌属序号按照图中排列顺序进行标号
*<0.05; **<0.01
图3中可以看出,Actinobacteria门的(序号94)与Firmicutes门的(序号59)和(序号73)都与还原Fe(III)呈极显著正相关(<0.01).这3种腐殖质还原菌属可能具有较强的电子传递能力,在氧化还原过程中起主导作用.有研究表明,具有将Cr(VI)还原为Cr(III)能力,该菌属在遇到高电位的金属离子时可能会展现出较强的还原能力[22].因此,推测当与Fe(III)在厌氧环境中共存时也较容易将Fe(III)还原为Fe(II).菌属是分泌脲酶的主要菌属,常用于工业废水处理.和在FVW中与还原Fe(III)能力显著相关(图3),而也仅在WW中与还原Fe(III)能力显著相关.因此,腐殖质还原菌的还原能力可能受物料环境的条件约束.在不同的物料中腐殖质还原菌存在共同还原机制,腐殖质还原菌由于复杂的生长代谢环境,不能单独发挥还原能力,可能需要与群落中相关的菌属相互影响来达到还原Fe(III)的作用.另外,本研究中发现,有19个菌属在还原过程中菌种丰度逐渐降低(图4),且该些菌种在不同物料中都呈现相同的丰度降低趋势,在反应过程中与Fe(III)还原量呈负相关关系.这说明该些菌属可能由于不适应复杂的微生物环境及其它微生物对其生长条件的约束,在微生物环境中逐渐失去生长优势.

图4 不同物料堆肥中与Fe(III)还原能力呈显著负相关关系的腐殖质还原菌识别
*<0.05; **<0.01
2.3 腐殖质还原菌群与微环境因子的响应关系
异化铁还原是参与天然有机污染层降解有机污染物的重要过程[23],而本研究发现堆肥过程的腐殖质还原菌具有较强的异化铁还原能力.因此通过一定的过程调控技术手段,增加腐殖质还原菌的数量,理论上可以提升堆肥或土壤中污染物的生物修复效率,具有重要的环境意义.但由于添加外源微生物会对堆肥微生物环境造成未知影响,且腐殖质还原菌须在厌氧环境下进行筛选,对接种环境条件限制较为严格.基于上述理论,通过腐殖质还原菌与微环境的响应关系分析[24],不添加外源微生物的条件下构建一种促进腐殖质还原菌生长的堆肥微环境调控方法是本文主要的研究方向.
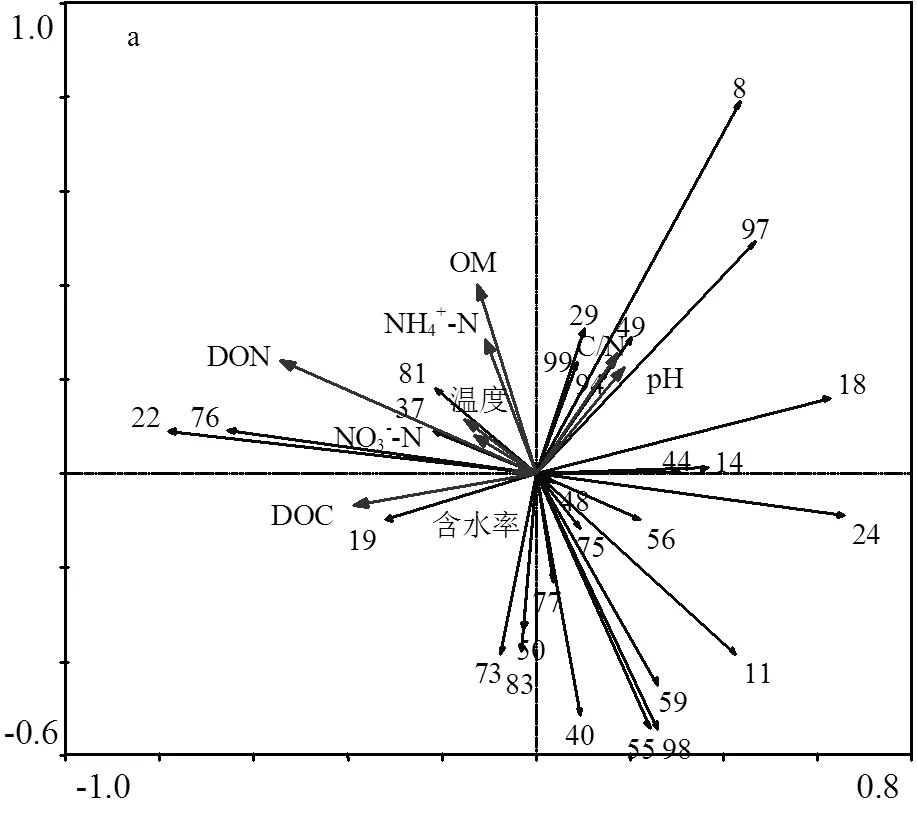
于100个与异化铁相关菌属中选择普遍存在于6种物料的27个菌属.对这些腐殖质还原菌的相对丰度采用降趋对应分析(即DCA分析),第一排序轴最大梯度为2.771.因此,选择可以更好反应腐殖质还原菌菌群结构与微环境因子之间的响应关系的RDA来分析堆肥过程中微环境因子对腐殖质还原菌菌群结构变化的影响,以明确该27个菌属与理化因子之间的响应关系.其中,第一排序轴与第二排序轴分别解释了22.03%和40.64%的物种变化量.DON、DOC、pH、C/N、OM、NH4+-N、温度、NO3--N及含水率分别单独解释了总变量的16.0%、8.2%、3.0%、2.8%、1.7%、1.5%、1.3%及0.6%.说明温度、NO3--N与含水率对腐殖质还原菌的菌群分布影响较小.采用偏相关分析进一步表明,DON显著影响腐殖质还原菌菌群结构的变化(< 0.05),说明DON是影响27属腐殖质还原菌的重要微环境因子.然而,堆肥过程中腐殖质还原菌的新陈代谢与多种微环境因子的紧密相联,因此,其他微环境因子对腐殖质还原菌群落也具有至关重要的影响[25].
从排序图可进一步探究堆肥过程微环境因子对腐殖质还原菌的作用(图5a和图5b),其中,序号19、22、37、76及81与DON、DOC、NO3--N、SW1及SW3呈正相关关系.说明此类腐殖质还原菌的生长与氮相关指标具有密切关系,在秸秆类物料中适当添加有机碳源与氮源不仅能够促进此类腐殖质还原菌的生长,还可能对堆肥过程中硝化作用具有一定贡献;腐殖质还原菌序号8、29、49、94、97及99主要存在于蛋白类物料(CM、DCM)中,其中序号94与异化铁还原能力呈极显著正相关关系(图3),鉴于该菌属有较强还原金属离子的能力,因此在蛋白质物料中主要对序号94的菌属进行调控从而提升堆肥中重金属污染物的修复率.从图5a中可以看出这些腐殖质还原菌与C/N、pH呈正相关关系.说明在蛋白类物料中升高pH(£8.93)与C/N(£22.05)会在一定程度上提高此类腐殖质还原菌的丰度,这一结果也为在弱碱条件下筛选腐殖质还原菌提供可能性.序号为11、24、40、55、59、73及98的的腐殖质还原菌存在于多种类型物料中,其中与异化铁还原能力呈极显著正相关关系的59号菌属在生物量分解中起主导作用[26].这些腐殖质还原菌与NH4+-N、OM和DON呈一定的负相关关系.由此可以推测,此类微生物能够以DON与NH4+-N作为营养源进行新陈代谢.然而,若NH4+-N与DON浓度过高,也可能会抑制此类腐殖质还原菌的活性.因此还有更多的研究工作需要继续开展,为进一步通过调控微环境促进腐殖质还原菌生长提供技术支持.
3 结论
3.1 不同物料中的腐殖质还原菌还原异化铁能力有所不同.随着堆肥过程进行,CM、DCM、FVW和WW中腐殖质还原菌还原能力增强.堆肥过程对GW和SW中腐殖质还原菌的还原能力无显著影响.不同物料还原能力依次为蛋白质类物料(CM、DCM)>纤维素类物料(WW、FVW)>木质素类物料(GW、SW).
3.2 筛选了不同堆肥过程中与异化铁还原能力极显著相关的腐殖质还原菌,分别为Actinobacteria门的、Firmicutes门的和.具有异化铁还原能力的腐殖质还原菌在纤维素类物料中有丰富的多样性.
3.3 基于微环境因子与腐殖质还原菌的响应关系,筛选了堆肥过程中腐殖质还原菌的关键影响因素,DON能显著影响腐殖质还原菌菌群分布.在此基础上,构建了一种通过调节堆肥物料微环境因子,促进腐殖质还原菌生长的调控方法.
[1] Cheng D, He J Z. Isolation and characterization of "Dehalococcoides" sp. strain MB, which dechlorinates tetrachloroethene to trans-1,2- dichloroethene [J]. Applied and Environmental Microbiology, 2009, 75(18):5910-5918.
[2] Futagami T, Goto M, Furukawa K. Biochemical and genetic bases of dehalorespiration. Chemical Record, 2008,8(1):1-12.
[3] Xi B, Zhao X, He X, Huang C, et al. Successions and diversity of humic-reducing microorganisms and their association with physical- chemical parameters during composting [J]. Bioresource Technology, 2016,219:204-211.
[4] Wu C Y, Chen N, Li H, Li Q F. Kocuria rosea HN01, a newly alkaliphilic humus-reducing bacterium isolated from cassava dreg compost [J]. Journal of Soils & Sediments, 2014,14(2):423-431.
[5] Wolf M, Kappler A, Jie J, Meckenstock R U. Effects of humic substances and quinones at low concentrations on ferrihydrite reduction by Geobacter metallireducens [J]. Environmental Science & Technology, 2009,43(15):5679-5685.
[6] Klüpfel L, Piepenbrock A, Kappler A, Sander M. Humic substances as fully regenerable electron acceptors in recurrently anoxic environments [J]. Nature Geoscience, 2014,7(3):195-200.
[7] Bird L J, Bonnefoy V, Newman D K. Bioenergetic challenges of microbial iron metabolisms [J]. Trends in Microbiology, 2011,19(7): 330-340.
[8] 荆国华,李 伟,施 耀,等. Fe~(+3)(EDTA)还原菌的分离及其性能[J]. 中国环境科学, 2004,24(4):447-451.
[9] Lovley D R. Dissimilatory Fe(III) and Mn(IV) reduction [J]. Advances in Microbial Physiology, 1991,55(2):259-287.
[10] Francis A J, Dodge C J, Rose A W, Ramirez A J. Aerobic and anaerobic microbial dissolution of toxic metals from coal wastes: mechanism of action [J]. Environmental Science & Technology, 1989, 23(4):435-441.
[11] Weber K, Achenbach L, Coates J. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction [J]. Nature Reviews Microbiology, 2006,4(10):752-764.
[12] Martinez C M, Alvarez L H, Celis L B, Cervantes F J. Humus- reducing microorganisms and their valuable contribution in environmental processes [J]. Applied Microbiology & Biotechnology, 2013,97(24):10293-10308.
[13] Lovley D R, Nevin K P. Lack of production of electron-shuttling compounds or solubilization of Fe(III) during reduction of insoluble Fe(III) oxide of Geobacter Metallireducens [J]. Applied and Environmental Microbiology, 2000,66(5):2248-2251.
[14] Jiang J, Kappler A. Kinetics of microbial and chemical reduction of humic substances: implications for electron shuttling [J]. Environmental Science & Technology, 2008,42(10):3563-3569.
[15] Lovley D R, Coates J D, Bluntharris E L, Phillips E J, et al. Humic substances as electron acceptors for microbial respiration [J]. Nature, 1996,382(6590):445-448.
[16] Zhao X, He X, Xi B, Gao R, et al. Response of humic-reducing microorganisms to the redox properties of humic substance during composting [J]. Waste Management, 2017,70:37-44.
[17] 汪明霞,王 娟,司友斌. Shewanella oneidensis MR-1异化还原Fe(Ⅲ)介导的As(Ⅲ)氧化转化[J]. 中国环境科学, 2014,34(9):2368-2373.
[18] Roelcke M, Han Y, Cai Z, Richter J. Nitrogen mineralization in paddy soils of the Chinese Taihu Region under aerobic conditions [J]. Nutrient Cycling in Agroecosystems, 2002,63(2/3):255-266.
[19] Ait B G, Cegarra J, Merlina G, Revel J C, et al. Qualitative and quantitative evolution of polyphenolic compounds during composting of an olive-mill waste-wheat straw mixture [J]. Journal of Hazardous Materials, 2009,165(1-3):1119-1123.
[20] Said-Pullicino D, Erriquens F G, Gigliotti G. Changes in the chemical characteristics of water-extractable organic matter during composting and their influence on compost stability and maturity [J]. Bioresource Technology, 2007,98(9):1822-1831.
[21] Zhang J, Zeng G, Chen Y, Yu M, et al. Effects of physico-chemical parameters on the bacterial and fungal communities during agricultural waste composting [J]. Bioresource Technology, 2011,102(3):2950-2956.
[22] Zhu W, Yang Z, Ma Z, Chai L. Reduction of high concentrations of chromate bysp. CRB1isolated from Changsha, China [J]. World Journal of Microbiology & Biotechnology, 2008,24(7):991-996.
[23] Lovley D R, Woodward J C. Mechanisms for chelator stimulation of microbial Fe(III)-oxide reduction [J]. Chemical Geology, 1996, 132(1-4):19-24.
[24] Wei Y, Zhao Y, Fan Y, Lu Q, et al. Impact of phosphate-solubilizing bacteria inoculation methods on phosphorus transformation and long-term utilization in composting [J]. Bioresource Technology, 2017, 241:134-141.
[25] Wang X, Cui H, Shi J, Zhao X, et al. Relationship between bacterial diversity and environmental parameters during composting of different raw materials [J]. Bioresource Technology, 2015,198:395-402.
[26] Zhao D, Cao X, Huang R, Zeng J, et al. Variation of bacterial communities in water and sediments during the decomposition of Microcystis biomass [J]. Plos One, 2017,12(4):e0176397.
A regulating method for humic-reducing microorganisms and assessment of the reduction of dissimilatory Fe(III)in composting.
ZHAO Xin-yu1,2, FAN Yu-ying1,2,3, XI Bei-dou1,2*, TAN Wen-bing1,2, HE Xiao-song1,2, ZHANG-Hui1,2, LI-Dan1,2
(1.State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;2.State Environmental Protection Key Laboratory of Simulation and Control of Groudwater Pollution, Chinese Research Academy of Environmental Sciences, Beijing 100012, China;3.Northeast Agricultural University, Harbin 150030, China)., 2018,38(10):3815~3822
Reduction of dissimilatory Fe(III) by humic-reducing microorganisms (HRMs) from different composts was conducted. Results showed that the capacity for reduction of dissimilatory Fe(III) by HRMs was ranked in the order protein-rich compost > cellulose-rich compost > lignin-rich compost. The result of correlation showed that、andwere significantly associated with the Fe(III) reduction. It was indicated that dissolved organic nitrogen was the primary micro-enviromental factors significantly driving the variation of these key HRMs by Redundancy analyses (RDA). Finally, based on the relationship between the mico-enviromental factors and HRMs, this work proposed a regulating method to enhance the growth of the key HRMs during composting. This study not only investigated the influencial factors of HRMs in compost deeply, but also had ecologicalsignificant in the study of waste biogeochemical process.
humic-reducing microorganism;16S rDNA;reduction of dissimilatoryFe(III);RDA;compost
X705
A
1000-6923(2018)10-3815-08
赵昕宇(1989-),女,黑龙江双鸭山人,中国环境科学研究院博士后,主要从事有机固体废弃物处置与资源化研究.发表论文11篇.
2018-06-25
国家自然科学基金资助项目(41501242)
* 责任作者, 研究员, xibeidou@yeah.net
