电解质NRTL模型的研究进展及应用
2013-10-11徐建新张洪起刘继东董忠哲
徐建新,张洪起,刘继东,董忠哲
(1河北工业大学化工学院,天津 300130;2河北工业大学国家大学科技园,天津 300130)
化学、化工、冶金、环境、生化等领域中存在着大量电解质溶液,它们的热力学研究一直备受关注。自Debye-Hückel于20世纪20年代提出电解质溶液的离子互吸理论以来[1],国内外许多专家学者对电解质溶液理论做了大量的研究工作[2-5],创造性地提出了一系列的理论和半经验或经验模型,胡英[6]和Loehe[7]等的著作对不同时期该方面的研究成果做了详细的介绍。其中Chen提出的电解质NRTL模型具有参数少,适用范围广,精度高等优点,能够用于处理单一电解质水溶液、多组分电解质水溶液、混合溶剂电解质溶液及有机电解质溶液体系,在工程中得到了成功的应用。夏云龙等[8]曾从工程应用角度对电解质NRTL模型的发展做了论述,介绍了模型在电解质溶液相平衡计算中的应用。本文对模型的研究进展做了更为全面的阐述,同时介绍了模型在处理不同类型电解质体系中的应用。
1 电解质NRTL模型的研究进展
电解质NRTL模型的简易发展路线如图1所示,下 文对模型的研究进展过程做较为详细的论述。
1.1 模型的提出
基于同类离子相互排斥和局部电中性这两个基本假设,Chen等[9]于1982年提出了计算电解质体系的过剩吉布斯自由能局部组成模型——电解质NRTL模型,用来描述单一电解质水溶液体系的热力学性质。该模型将电解质溶液体系的过剩吉布斯自由能用两部分表示:离子-离子之间的静电长程相互作用贡献和所有粒子之间的短程相互作用贡献。用扩展的Debye-Hückel方程[10]描述静电长程作用的贡献,用基于局部组成概念的NRTL模型[11]表示短程作用的贡献。从而得到如式(1)的表达式。


图1 电解质NRTL模型的发展简图
由式(1)可得式(2)。

Chen等用此模型关联了大量不同类型的单一强电解质水溶液体系,取得了较好的结果。为了检验模型对溶液浓度的适用范围,Chen等还用该模型关联了电解质的纯熔融盐体系,从而证明模型可用于从纯溶剂到纯电解质的整个浓度范围。关联结果还表明,只使用二元作用参数,模型就能取得令人满意的精度。
1.2 模型的修正和扩展
Chen等[12]于1986年修正了上述模型。他们在计算物种之间的短程相互作用贡献时通过确定一个中心物种引入了“有效局部摩尔分率”的概念,从而改进了短程作用项,离子之间的长程作用贡献计算方法不变。该模型的应用范围可推广到多组分电解质(包括弱电解质)溶液体系的汽液平衡和固液平衡。
Mock等[13]于1986年成功将电解质NRTL模型扩展应用于混合溶剂电解质体系的汽液平衡和液液平衡中。Mock等认为对于混合溶剂电解质溶液体系,应主要考虑溶剂物种之间的相平衡行为,尽管长程相互作用项的贡献对于计算液相离子的活度系数比较重要,但是对于水和有机溶剂的相平衡行为影响甚微。因此,在该模型中忽略了长程相互作用的贡献,只考了溶剂-溶剂、离子-离子、离子-溶剂之间的短程作用贡献,得到了适用于混合溶剂电解质体系的电解质NRTL模型。Mock等用该模型关联了部分混合溶剂电解质体系的汽液平衡和液液平衡。对于单纯的混合溶剂体系,该模型简化为NRTL模型。
Chen等[14]针对混合溶剂电解质溶液体系,在原两贡献模型的基础上引入了Born项[15],用它表示从某一混合溶剂中的无限稀释状态到水溶液中的无限稀释状态的离子吉布斯自由能的转换,以消除无限稀释混合溶剂电解质溶液体系参考状态的影响。该模型用非对称Pitzer-Debye-Hückel方程和Born方程的加和来描述离子之间的长程相互作用贡献,短程相互作用贡献仍用NRTL模型描述。则得到如式(3)形式三贡献模型。

相应的活度系数表达式如式(4)。

该三贡献模型可用于混合溶剂电解质溶液体系的计算,且精度有了进一步提高。
Yunda等[16]对三贡献模型进行了扩展,用于处理混合溶剂电解质体系的液液相平衡。他们向原模型引入经验项Brnsted-Guggenheim(BG)来弥补原模型在用于处理混合溶剂电解质溶液体系时Pitzer-Debye-Hückel方程和Born项引起的误差。
BG项表达式如式(5)。

此时模型扩展为如式(6)。

Liu等[17]用该模型关联预测了部分水-有机溶剂-盐体系的液液相平衡行为,并将结果与Z-P模型进行比较,显示出了其优越性。但模型在临界点处的预测能力较差,原因可能是模型中的DH参数被当做了常数处理。
对于高浓度电解质溶液体系,Abovsky等[18]考虑了“多体”对局部组成的影响,在原始的电解质NRTL模型中引入了依赖于浓度成线性变化的相互作用参数,得到了改进的模型。通过对部分电解质溶液体系的关联计算,发现该模型对高浓度电解质溶液体系非理想性的预测能力较原模型有了很大提高。新模型满足吉布斯-杜亥姆热力学关系。当浓度依赖项为零时,改进模型还原为初始模型。
Chen等[19]于1999年用两贡献电解质NRTL模型计算单一电解质水溶液的液相活度系数时,考虑了电解质的水合作用和部分离解性质,此修正使模型的计算能力进一步提高。对于没有水合和部分离解作用的电解质水溶液体系,该模型在较低浓度下获得的参数可以外推到中等浓度甚至高浓度的溶液范围内使用,且关联精确度可靠。对于考虑了水合和部分离解作用的电解质水溶液体系,该模型在整个浓度范围内可提供准确预测电解质体系非理想性的全面热力学框架。
Anders等[20]修正了Chen的电解质NRTL模型,得到了适用于计算单一溶剂、单一电解质溶液体系过剩吉布斯自由能的新局部组成模型。在描述短程作用贡献时,他们引入了一个经验的能量修正项ω,来补偿粒子大小差别和相互作用能绝对值大小引起的偏差,长程静电作用贡献计算方法不变。Anders等用该模型关联了298.15 K下163种单一电解质水溶液体系,结果优于原模型。计算时,模型中的NRTL项相互作用参数τ和局部组成因子G依赖于温度变化,而能量修正项ω与温度无关。
Anders等[21]于2000年在原工作的基础上对模型做了进一步修正,他们假设离子和溶剂分子之间的相互作用能和修正能相等,这样在由二元参数计算多组分参数时避免了使用混合规则,从而将模型扩展应用于多组分电解质溶液体系。Anders等用该模型回归了部分电解质水溶液体系的相互作用参数,所得结果较Chen的模型更优。进而用回归的参数分别计算了多组分电解质体系的渗透系数和溶解度,前者结果与实验数据吻合很好,后者结果虽与文献数据一致,但精度不是很高。
Bochove等[22]针对混合溶剂电解质体系,考虑了不同溶剂组成对长程静电作用贡献的影响,向Chen提出的三贡献模型中引入了与Liu不同的经验项BG[23],从而对原模型进行了扩展。
BG项表达式如式(7)。

模型扩展为如式(8)。
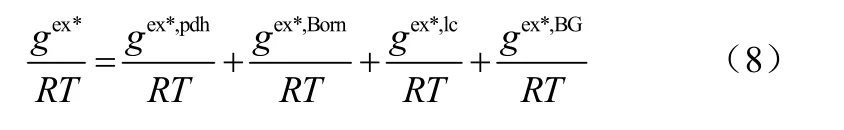
他们用该扩展的电解质NRTL模型计算了部分多元混合溶剂电解质体系的活度系数,并进一步预测了体系的液液相平衡行为,关联结果较Chen模型更优。该模型在工业萃取四元电解质溶液体系中得到了应用。
Chen等[24]于2001年将两贡献模型扩展用于计算有机电解质溶液体系的过剩吉布斯自由能。因为有机电解质溶液体系与典型电解质水溶液体系的非理想性差别较大,故不能直接用原电解质NRTL模型处理。Chen[25]将两贡献模型与聚合物NRTL模型相结合,在原模型中引入Flory-Huggins(FH)方程得到如式(9)。

FH方程的表达式如式(10)。

模型把形成碳氢化合物的有机离子作为低聚物处理,可用于处理有机电解质溶液体系和含胶体的有机电解质溶液体系。该模型综合考虑了正规双液体理论、同类离子相互排斥和局部电中性的假设、“分段式局部组成”概念、 Pitzer-Debye-Hückel方程及FH方程的影响,可通用于描述无机电解质溶液体系、有机电解质溶液体系和含有聚合物的混合电解质溶液体系的非理想性。
Chen等[26]于2004年向三贡献模型中引入了“部分相互作用”概念,用以描述离子对有机溶剂亲水性部分的吸引作用和离子对有机溶剂疏水性部分的排斥作用,使得模型关联混合溶剂电解质体系平均活度系数的能力进一步提高,对混合溶剂电解质体系的通用性更好。他们用该修正模型计算了部分混合溶剂电解质体系的活度系数,包括无限稀释混合溶剂电解质溶液体系和含有机溶剂的混合溶剂电解质溶液体系,计算值与文献值的最小均方根误差仅为0.024。
Bollas等[27]于2008年对三贡献电解质NRTL模型进行了改进。他们考虑了在使用三贡献模型推导液相活度系数时由于假设离子的摩尔分率为常数所引起的误差,故在计算时将这一假设去除,得到了适用于多组分电解质体系的热力学一致性更加严格的活度系数方程。模型还综合考虑了电解质溶液的离子水合作用、离子配对效应和部分离解因素的影响,通过用该模型对一些多组分电解质溶液体系的关联预测,发现平均相对误差可降至1%,同时模型由低浓度溶液的实验数据获得的交互作用能参数可外推用于高浓度电解质溶液体系的计算。
Yuhua等[28]在2009年提出了最新的对称电解质NRTL活度系数模型。该模型重新选择了溶液参考态,溶剂以纯液体作为参考态,电解质以纯熔融盐作为参考态。并基于新的参考态对描述局部相互作用项的NRTL模型和描述长程作用贡献的非对称Pitzer-Debye-Hückel方程重新做了推导,由此得到的液相活度系数表达式更为简化。新模型消除了在计算超额吉布斯自由能时局部作用贡献项中的离子电荷分率的影响,扩展了表示长程作用贡献的PDH项。最新的对称电解质NRTL模型较之前的非对称模型有很大的优越性,它为我们提供了一个更为全面的热力学框架,可以很好的用于关联水溶液电解质体系、非水溶液电解质体系和混合溶剂电解质体系的相行为。对于单一弱电解质水溶液体系,该模型简化为1982模型[9];对于多组分电解质水溶液体系选择无限稀释态为参考状态时,该模型简化为1986 模型[12]。
2 模型的应用
2.1 应用于单一电解质水溶液体系
Chen[29]用两贡献电解质NRTL模型分别计算了NaCl、Na2SO4和FeCl2水溶液体系的液相活度系数,进而预测了它们在水中的溶解度,结果与文献数据一致,这表明该模型可以很好的描述部分单一电解质水溶液体系的固液平衡。
2.2 应用于多组分电解质水溶液体系
电解质NRTL模型在不同电解质体系中的应用如表1所示。从表1中可以看出,电解质NRTL模型不仅可以用于处理强电解质体系,还可适用于挥发性弱电解质体系。通过对NH3-CO2-H2O体系相平衡的关联,为化肥工业过程模拟设计和工业上CO2脱除氨激冷过程的优化提供了热力学模型。基于电解质NRTL模型建立的NaCl-Na2SO4-H2O体系热力学相平衡模型,可以为工业卤水分离过程的模拟设计提供理论指导。可见,电解质NRTL模型的在混合电解质体系中的应用为工业生产提供了有力的理论支持。
2.3 应用于混合溶剂电解质体系
表2列出了电解质NRTL模型用于处理一系列混合溶剂电解质体系的实例,从而显示了该模型在处理混合溶剂电解质体系中的优势。混合溶剂基本是水和有机溶剂组成的。

表1 电解质NRTL模型在混合电解质体系中的应用

表2 电解质NRTL模型在混合溶剂电解质体系中应用
2.4 应用于有机电解质溶液体系
Vicent等[51]用 Mock 的模型[13]预测了丙酮-甲醇-1-乙基-3-甲基咪唑三氟甲磺酸体系的汽液平衡,所得结果与实验数据一致。Calvar等[52]用电解质NRTL模型[23]关联计算了乙醇-EMISE、水-EMISE和乙醇-水-EMISE体系的汽液平衡,其中对二元体系的预测结果令人满意,三元体系的预测结果较差。
3 结语
电解质NRTL模型自提出以来,便很受关注。经过大量的探索研究,原始模型不断得到修正、改进和扩展,越来越完善。模型在工程领域得到广泛应用,且取得了很好的效果。在用于电解质溶液的计算时,模型只需二元作用参数就能在很宽的浓度和温度范围内获得理想的结果,不需要更高阶的参数。模型可用于处理单一电解质水溶液、多组分电解质水溶液、混合溶剂电解质溶液、有机电解质溶液、含聚合物的电解质溶液等复杂体系,尤其在混合溶剂电解质溶液体系中的应用更为突出。对于电解质溶液体系的汽液、液液、固液及汽液固相平衡行为的非理想性,模型可给出很好的预测结果。最新的对称电解质NRTL模型消除了计算过程中参考态的影响,推导出的活度系数模型更简化,且预测精度进一步得到提高,热力学一致性更加严格。
尽管电解质NRTL模型适用性广泛,优越性显著,但仍有自身的缺陷。对于复杂的电解质溶液体系,模型参数的回归工作量大,过程繁琐。并且参数随温度和浓度的扩展外推并不稳定,在溶液的高浓度区,模型参数的关联难度更大。在模型的应用中,有时忽略了长程静电作用的贡献,从而降低了模型的热力学一致性。模型在溶液临界点处的预测精度较差,需进一步改进。模型在描述电解质体系汽液固三相平衡中的应用还很片面,仍需大量普遍的研究工作。模型用于有机电解质体系和含聚合物电解质体系的研究还局限在个别的物系,该项工作有待深入。
电解质NRTL模型应吸收其它同类模型的优点以弥补自身的不足,同时将长程静电作用贡献和短程作用贡献更加全面的有机结合,从而开发出对不同类型的电解质溶液体系普适性更强、精度更高、热力学一致性更加严格的热力学模型。

[1] Debye P,Hückel E.The Theory of electrolytes.1.Lowering of freezing point and related phenomena[J].Physikalische Zeitschrift,1923,24:185-206.
[2] Chen C C,Britt H I,Boston J F,et al.Two New Activity Coefficient Model For the Vapor-Liquid Equilibrium of Electrolyte Systems[M].ACS Symposium Series,1980.
[3] Pitzer K S.Elctrolytes.I:Theoretical basis and general equations[J].Phys.Chem.,1973,77(2):268-277.
[4] 陆小华,王延儒,时均.电解质溶液的热力学进展[J].化工进展,1988,7(3):13.
[5] 左有祥,郭天民.电解质溶液的分子热力模型[J].化工学报,1990,41(1):1-9.
[6] 胡英,刘国杰,徐英年,等.应用统计力学[M].北京:化学工业出版社,1990:335-403.
[7] Loehe J R,Donohue M D.Recent advances in modeling thermodynamic properties of aqueous strong electrolyte systems[J].AIChE J.,1997,43(1):180-195.
[8] 夏云龙,项曙光.电解质NRTL模型的发展及应用[J].河北化工,2004(1):9-12.
[9] Chen C C,Britt H I,Boston J F,et al.Local composition model for excess gibbs energy of electrolyte systems[J].AIChE J.,1982,28(4):588-596.
[10] Pitzer K S.Elctrolytes-from dilute-solutions to fused-salts[J].Am.Chem.Soc.,1980,102:2902-2906.
[11] Renon H,Prausnitz J M.Local compositions in thermodynamic excess functions for liquid mixtures[J].AIChE J.,1968,14(1):135-144.
[12] Chen C C,Evans L B.A Local composition model for excess gibbs energy of electrolyte systems[J].AIChE J.,1986,32(3):444-454.
[13] Bill Mock,Evans L B,Chen C C.Thermodynamic representation of phase equilibria of mixed-solvent electrolyte system[J].AIChE J.,1986,32(10):1655-1664.
[14] Aspen Technology Inc.Aspen Plus Electrolytes Manual[M].Cambridge,MasschusettsAspen,1988:495-519.
[15] Rashin A A,Honig B.Revalution of rhe born model of ion hydration[J].Phys.Chem.,1985,89:5588-5593.
[16] Liu Yunda,Suphat Watasasiri.Representation of liquid-liquid equilibrium of mixed-solvent electrolyte systems using the extended electrolyte NRTL model[J].Fluid Phase Equilibria,1996,116:193-200.
[17] Zerres H,Prausnitz J M.Thermodynamics of phase equilibria in aqueous-organic systems with salt[J].AIChE J.,1994,40(4):676-691.
[18] Abovsky V,Liu Y,Watanasiri S.Representation of nonideality in concentrated electrolyte solutions using the Electrolyte NRTL model with concentration-dependent parameters[J].Fluid Phase Equilibria,1998,150-151:277-286.
[19] Chen C C,Mathias P M,Hasan Orbey.Use of hydration and dissociation chemistries with the electrolyte-NRTL model[J].AIChE J.,1999,45(7):1576-1586.
[20] Anders Jaretun,Gharib Aly.New local composition model for electrolyte solutions:single solvent,single electrolyte systems[J].Fluid Phase Equilibria,1999,163:175-193.
[21] Anders Jaretun,Gharib Aly.New local composition model for electrolyte solutions:Multicomponentsystems[J].FluidPhase Equilibria,2000,175:213-228.
[22] Gerard H van Bochove,Gerard J P Krooshof,et al.Modelling of liquid–liquid equilibria of mixed solvent electrolyte systems using the extended electrolyte NRTL[J].Fluid Phase Equilibria,2000,171(1-2):45-58.
[23] Christensen C,Sander B,Fredenslund A,et al.Towards the extension of UNIFAC to mixtures with electrolytes[J].Fluid Phase Equilibria,1983,13:297-309.
[24] Chen Chau Chyun,Costas P Bokis,Paul Mathias.Segment-Based Excess Gibbs Energy Model for Aqueous Organic Electrolytes[J].AIChE J.,2001,47(11):2593-2602.
[25] Chen C C.A segment-based local composition model for the gibbs energy of polymer solutions[J].Fluid Phase Equilibria,1993,83:301-312.
[26] Chen Chau Chyun,Yuhua Song.Generalized electrolyte-NRTL model for mixed-solvent electrolyte systems[J].AIChE J.,2004,50(8):1928-1941.
[27] Bollas G M,Chen C C,Barton P I.Refined electrolyte-NRTL model:Activity coefficient expressions for application to muti-electrolyte systems[J].AIChE J.,2008,54(6):1608-1624.
[28] Song Yuhua,Chen C C.Symmetric electrolyte nonrandom two-liquid activity coefficient model[J].Ind.Eng.Chem.Res.,2009,48:7788-7797.
[29] Chen C C.Representation of solid-liquid equilibrium of aqueous electrolyte systems with the electrolyte NRTL model[J].Fluid Phase Equilibria,1986,27:457-474.
[30] Ali Haghtalab,Vladimiros G Papangelakis,Zhu Xuetang.The electrolyte NRTL model and speciation approach as applied to multicomponent aqueous solutions of H2SO4,Fe2(SO4)3,MgSO4and Al2(SO4)3at 230—270℃[J].Fluid Phase Equilibria,2004,220:199-209.
[31] Paul M Mathias,Satish Reddy,John P O’Connell.Quantitative evaluation of the aqueous-ammonia process for CO2capture using fundamental data and thermodynamic analysis[J].Energy Procedia,2008,9:1-8.
[32] Paul M Mathias,Satish Reddy,John P O’Connell.Quantitative evaluation of the chilled-ammonia process for CO2capture using thermodynamic analysis and process simulation[J].Greenhouse Gas Control,2010,4:174-179.
[33] Feng Qin,Wang Shujuan,Inna Kim,et al.Study of the heat of absorption of CO2in aqueous ammonia:comparison between experimental data and model predictions[J].Ind.Eng.Chem.Res.,2010,49:3776-3784.
[34] Que Huiling,Chen C C.Thermodynamic modeling of the NH3-CO2-H2O system with electrolyte NRTL model[J].Ind.Eng.Chem.Res.,2011,50:11406-11421.
[35] Yan Yizhuan,Chen C C.Thermodynamic modeling of CO2solubility in aqueous solutions of NaCl and Na2SO4[J].Supercritical Fluids,2010,55:623-634.
[36] Yan Yizhuan,Chen Chau Chyun.Thermodynamic representation of the NaCl+Na2SO4+H2O system with electrolyte NRTL model[J].Fluid Phase Equilibria,2011,306(2):149-161.
[37] Que Huiling,Hua Songyu,Chen C C.Thermodynamic modeling of the sulfuric acid-water-sulfur trioxide system with the symmetric electrolyte NRTL model[J].Chem.Eng.Data,2011,56:963-977.
[38] David M Austgen,Gary T Rochelle,Xiao Peng,et al.Model of vapor-liquid equilibria for aqueous acid gas-alkanolamine systems using the electrolyte-NRTL equation[J].Ind.Eng.Chem.Res.,1989,28:1060-1073.
[39] Austgen David M,Rochelle Gary T,Chen C C.Model of vapor-liquid equilibria for aqueous acid gas-alkanolamine systems. 2.Representation of hydrogen sulfide and carbon dioxide solubility in aqueous MDEA and carbon dioxide solubility in aqueous mixtures of MDEAwith MEA or DEA[J].Ind.Eng.Chem.Res.,1991,30(3):543-555.
[40] Li Zongcheng,Tang Yiping,Liu Yi,et al.Salting effect in partially miscible systems ofn-butanol-water and butanone-water 1.Determination and correlation of liquid-liquid equilibrium data[J].Fluid Phase Equilibria,1995,103(1):143-153.
[41] Paulo A Barata,Maria L Serrano.Thermodynamic representation of the solubility for potassium dihydrogen phosphate(KDP)+water+alcohols systems[J].Fluid Phase Equilibria,1997,141(1-2):247-263.
[42] Taher AAl-Sahhaf,Emina Kapetanovic,Qadria Kadhem.Salt effects on liquid–liquid equilibria in the partially miscible systems water+2-butanone and water+ethyl acetate[J].FluidPhase Equilibria,1999,157(2):271-283.
[43] Liu Yunda,Zhang Luzheng,Suphat Watanasiri.Representing vapor-liquid equilibrium for an aqueous MEA-CO2system using the electrolyte nonrandom-two-liquid model[J].Ind.Eng.Chem.Res.,1999,38:2080-2090.
[44] Kim Yehoon,Haam Seungjoo,Koo Kee Kahb,et al.Representation of solid−liquid equilibrium of l-ornithine−l-aspartate+water+methanol system using the chen model for mixed-solvent electrolyte solution[J].Chem.Eng.Data,2001,46(6):1387-1391.
[45] Gerard H van Bochove,Gerard J P Krooshof,Theo W.de Loos.Twoand three-liquid phase equilibria in the system water+2-heptanone+caprolactam+ammonium sulfate:Experiments and modeling[J].Fluid Phase Equilibria,2002,194-197(30):1029-1044.
[46] Ernesto Vercher,Isabel Vázquez M ,Antoni Martinez-Andreu.Isobaric vapor–liquid equilibria for 1-propanol+water+lithium nitrate at 100 kPa[J].Fluid Phase Equilibria,2002,202:121-132.
[47] Olaya M M,Marcilla A,Serrano M D.Simultaneous correlation of liquid−liquid,liquid−solid,and liquid−liquid−solid equilibrium data for water+organic solvent+salt ternary systems.Anhydrous solid phase[J].Ind.Eng.Chem.Res.,2007,46(21):7030-7037.
[48] Stephan Machefer,Klaus Schnitzlein.Modeling the mean ionic activity coefficient of inorganic salts in complex polymer/water mixtures.Application of the segment-eNRTL model[J].Ind.Eng.Chem.Res.,2008,47(1):231-242.
[49] Zhang Ying,Chen C C.Thermodynamic modeling for CO2absorption in aqueous MDEA solution with electrolyte NRTL model[J].Ind.Eng.Chem.Res.,2011,50(1):163-175.
[50] Sun Shunping,Li Zhibao.Experimental measurement and modeling of aniline hydrochloride solubility in water,methanol,ethanol,propan-1-ol,and their mixed systems[J].Chem.Eng.Data,2012,57(1):219-226.
[51] Vicent Orchille’s A,Pablo J Miguel,Ernesto Vercher,et al.Ionic liquids as entrainers in extractive distillation:Isobaric vapor-liquid equilibria for acetone+methanol+1-ethyl-3-methylimidazolium trifluoromethanesulfonate[J].Chem.Eng.Data,2007,52:141-147.
[52] Noelia Calvar,Begoña González ,Elena Gómez.Vapor–liquid equilibria for the ternary system ethanol + water +1-ethyl-3-methylimidazolium ethylsulfate and the corresponding binary systems containing the Ionic Liquid at 101.3 kPa[J].Chem.Eng.Data.,2008,53:820-825.
