红曲菌两种荧光代谢产物与BSA相互作用的光谱法研究
2013-10-10黄志兵张淑云李来生李燕萍
黄志兵,许 杨,张淑云,李来生,李燕萍
(1.南昌大学食品科学与技术国家重点实验室,中德联合研究院,江西南昌330047;2.南昌大学分析测试中心,江西南昌330047)
红曲是我国的传统发酵产品,在我国一直被认为具有药用和食用双重功效,不仅是祖国宝贵的科学文化遗产,而且在世界微生物史上具有重要意义。近年来,随着对红曲中生物活性物质研究不断发展,各国学者对其进行深入而广泛的研究,发现红曲能产生许多令人瞩目的次级代谢产物,如红曲色素、胆固醇抑制剂、及具有降血压、抗菌、降血氨、抗肿瘤、降血糖等生理活性成分[1],使传统红曲增添新的内涵。一种天然物质能同时具有多项生物活性实属罕见,因此研究红曲菌新的代谢产物和开发红曲新功能现已成为各国研究热点之一。红曲菌最主要代谢产物为红曲色素,红曲色素是一类聚酮类物质,属于复合色素,主要包括红、橙、黄色素三大类,各大类又分为很多组分。目前,已确定出化学结构的红曲色素有6种,其中包括红曲素(Monascin)和红曲黄素(Ankanavin)两种黄色素,红斑红曲素(Rubropunctatin)和红曲玉红素(Monascorabrin)两种橙色素、红斑红曲胺(Monaseorubramine)和红曲玉红胺(Rubropunfamine)两种紫红色素,它们均属Azaphilone类真菌代谢物。近年来,越来越多的红曲菌新的Azaphilone类代谢产物及其抗癌生物活性被报道[2-5]。然而,有关红曲菌Azaphilone类代谢产物与BSA相互作用的报道甚少。前期实验从红曲中分离纯化出两种荧光代谢产物,分别命名为monasfluore A(MFA)和 monasfluore B(MFB)[6-7]。采用光谱法研究两种荧光代谢产物与BSA的相互作用下的热动力学参数和作用力类型等,对进一步研究红曲菌Azaphilone类代谢产物的生物活性机制有重要意义。
1 材料与方法
1.1 材料与仪器
红曲菌两种荧光代谢产物MFA和MFB 自制,纯度大于95%[6-7];牛血清白蛋白(BSA)Sigma公司;NaH2PO4、Na2HPO4、CH3CH2OH 均为分析纯;实验用水均为超纯水。
FS F-4500荧光分光光度计 日本日立公司;ULTRASPEC4300紫外分光光度计 美国Pharmacia公司。
1.2 实验方法
将一定量的BSA和上述两种红曲菌荧光代谢产物分别加入到容量瓶(10mL)中,并用含50%乙醇的PBS缓冲溶液(pH7.4,0.01mol·L-1)稀释。准确移取一定量的上述溶液于石英荧光池(1cm)中,进行荧光光谱扫描。BSA的荧光激发和发射波长分别为280nm和343nm,发射波长扫描范围400~600nm,狭缝宽度为5nm。紫外-可见吸收的参比液为含50%乙醇的 PBS 缓冲溶液(pH7.4,0.01mol·L-1),吸收波长扫描范围为300~450nm。
分别在25、35、45℃温度条件下,固定BSA浓度为3.03×10-6mol/L,加入一系列浓度的MFA或MFB后的BSA溶液进行荧光光谱扫描,记录荧光强度,计算荧光淬灭常数,推导荧光淬灭机理。
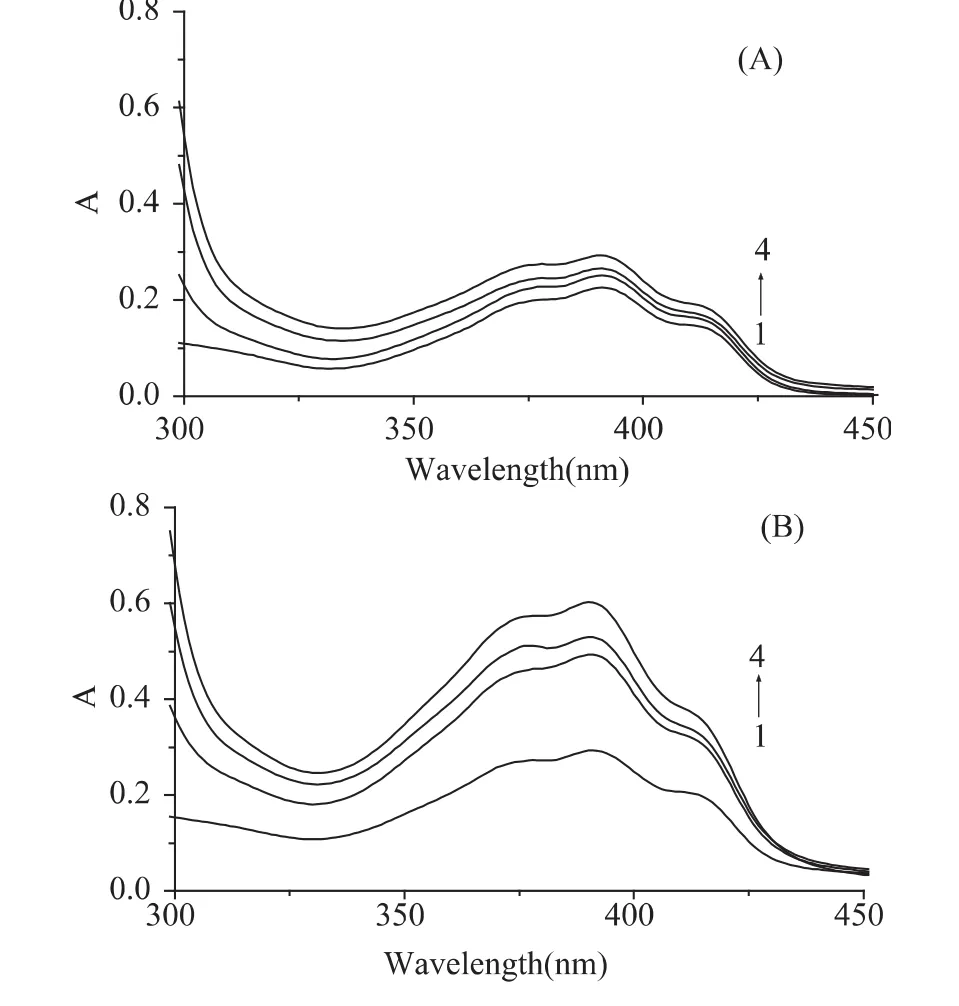
图1 MFA(A)和MFB(B)分别与BSA作用的吸收光谱Fig.1 Absorption spectra of MFA(A)and MFB(B)by BSA at different concentration
2 结果与讨论
2.1 吸收光谱
在含 50%乙醇的 PBS缓冲溶液(pH7.4,0.01mol·L-1)条件下,测定了不同浓度的 BSA对MFA和MFB紫外吸收谱图的影响,从图1可看出,随BSA浓度增大,MFA(A)和MFB(B)的最大吸光度值均增加,但MFB增加值比MFA更明显,说明MFB较MFA更容易与BSA作用。
2.2 荧光光谱
红曲菌两种荧光代谢产物(MFA和MFB)的激发波长和发射波长分别为396和460nm[6-7],对一系列含相同浓度的MFA和MFB与不同浓度BSA溶液混合后,静置30min,然后分别记录荧光光谱。由图2(A)可知,随加入的BSA溶液浓度增加,MFA的荧光强度几乎没有变化,可能原因是MFA与BSA之间的作用较弱;从图2(B)可知,随加入的BSA溶液浓度增加,MFB的荧光强度逐渐降低,说明MFB与BSA之间发生了明显的作用。
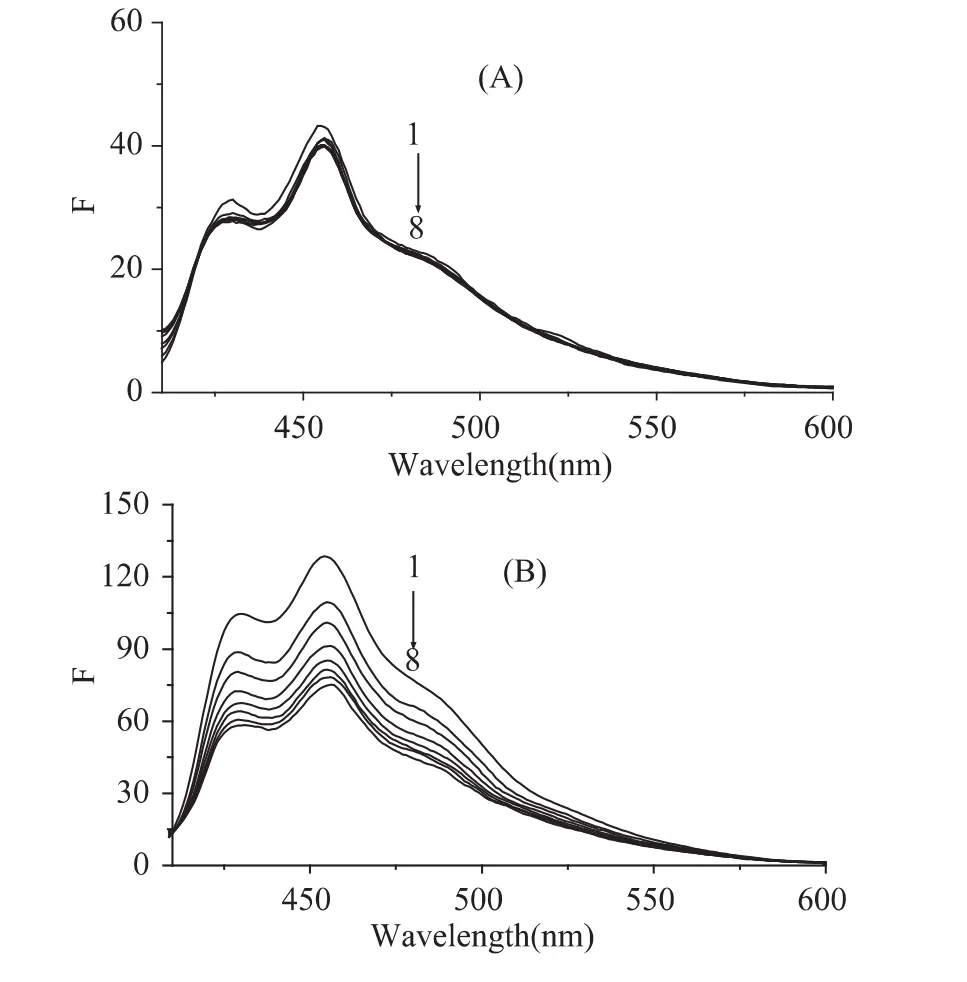
图2 MFA(A)和MFB(B)分别与BSA作用的荧光光谱Fig.2 Fluorescence quenched spectra of MFA(A)and MFB(B)by BSA at different concentration
然后固定BSA溶液的浓度,而改变MFA和MFB溶液的浓度,并进行荧光光谱扫描。由图3可知,随加入的MFA和MFB溶液浓度增加,BSA的荧光强度不断降低。这说明了MFA和MFB与BSA之间可能存在使得BSA的荧光降低的相互作用。
2.3 荧光猝灭机理和作用力类型
荧光猝灭过程可分为静态猝灭和动态猝灭[8]。若为动态猝灭,其作用过程遵循Stern-Volmer方程,F0/F=1+Kqτ0[Cmonas]=1+KSV[Cmonas] 式(1)[9]
根据上述方程测定了不同温度(25、35、45℃)时,加入MFA(图未给出)或MFB后BSA荧光强度的变化,由实验数据作出BSA的Stern-Volmer曲线
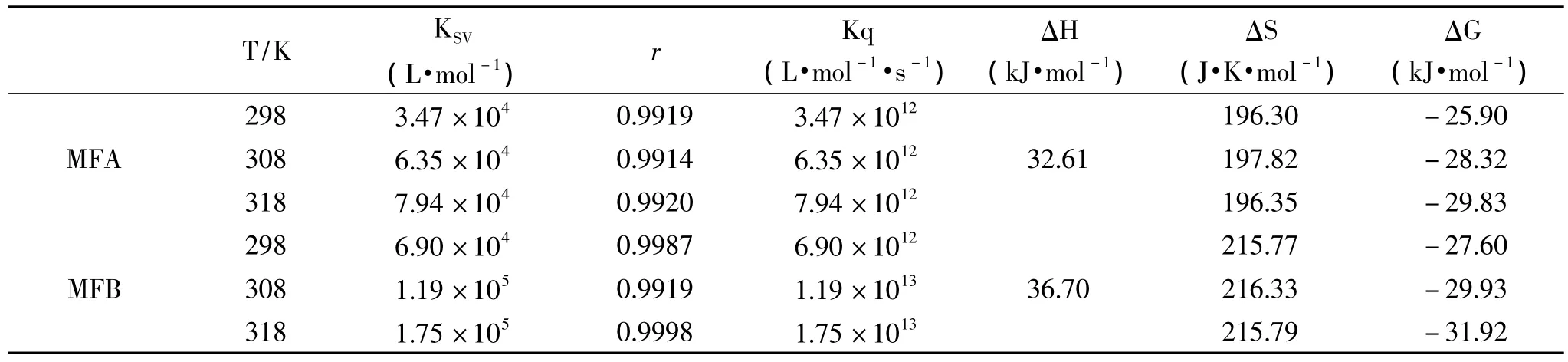
表1 在pH7.4条件下MFA和MFB与BSA作用的热力学参数Table 1 Thermodynamic parmeters of monasfluoreA and monasfluoreB-BSA interaction at pH7.4
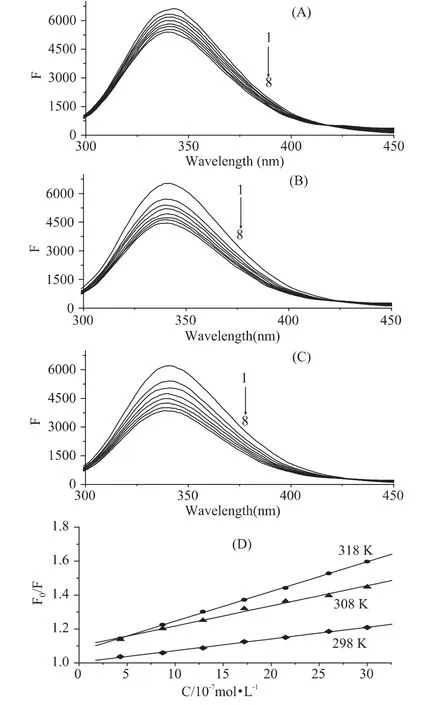
图3 在25℃(A),35℃(B)and 45℃(C)下MFB对BSA荧光淬灭光谱和Stern-Volmer(D)线Fig.3 Fluorescence quenched spectra of BSA by MFB at different concentration at 25℃(A),35℃(B)and 45℃(C),and Stern-Volmer plots of fluorescence quenching of BSA by MFB(D)
从图3(D)可看出,随温度升高,直线斜率增大,即KSV增大,表明MFB对BSA的荧光猝灭是由于分子间碰撞而引起的动态猝灭,主要由于升高温度使得荧光猝灭剂分子和荧光体有效碰撞增加,扩散系数增大,从而猝灭常数增大;相反,静态猝灭随着温度的升高,荧光猝灭剂分子和荧光体组成的复合物的稳定性下降,故猝灭常数减小[10]。
从表1结果可看出,Kq数量级在1012~1013,远远大于扩散碰撞过程中的最大Kq值,一般认为,各类猝灭剂对生物大分子的最大扩散碰撞猝灭常数为2 ×1010L·mol-1·s-1[11],从这一点考虑,MFA 和 MFB对BSA的荧光猝灭似乎不应为动态猝灭[12],但考虑到溶液中离子强度是影响猝灭常数的重要因素[8,11]之一,本实验体系为缓冲溶液,故本实验中Kq的增大可能是由离子强度引起的。
当温度变化不大时,反应的焓变ΔH可以看作一个常数,热力学参数之间的关系如下:
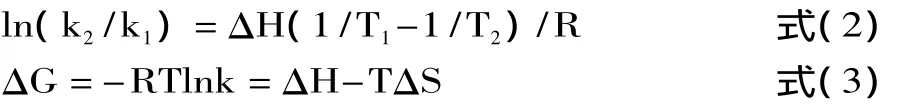
根据生物大分子与小分子结合力性质和生物大分子自身结合力性质的热力学规律[13],由表1可知,ΔG<0,表明反应是自发进行的,ΔH>0和 ΔS>0[13],表明MFA和MFB与BSA之间主要是疏水作用力。从MFA和MFB结构可以看出,由于MFB含有辛基侧链[6],疏水性明显强于含己基侧链的MFA,故MFB与BSA之间的疏水作用更明显。
3 结论
采用光谱法研究了红曲菌两种荧光代谢产物与BSA的相互作用,结果表明红曲菌两种荧光代谢产物(monasfluore A,MFA 和 monasfluore B,MFB)结合BSA内源荧光的猝灭是由于红曲菌荧光代谢产物与BSA之间形成复合物,符合动态猝灭机理。298、308、318K下,MFA与BSA和MFB与BSA的结合常数分别为:3.47 ×1012、6.35 ×1012、7.94 ×1012L·mol-1和6.90 ×1012、1.19 ×1013、1.75 ×1013L·mol-1。红曲菌两种荧光代谢产物与BSA之间的作用力为疏水作用力,由于MFB含有更长的辛基侧链,具有更强的亲脂性,因而与BSA之间的疏水作用力更强。
[1]Ma J,Li Y,Ye Q,et al.Constituents of red yeast rice:A traditional Chinese food and medicine[J].Journal of Agricultural and Food Chemistry,2000,48(11):5220-5225.
[2]Knecht A,Humpf H U.Cytotoxic and antimitotic effects of N-containing Monascus metabolites studied using immortalized human kidney epithelial cells[J].Molecular Nutrition & Food Research,2006,50(3):406-412.
[3]Su N W,Lin Y L,Lee M H,et al.Ankaflavin from Monascus-fermented red rice exhibits selective cytotoxic effect and induces cell death on Hep G2 cells[J].Journal of Agricultural and Food Chemistry,2005,53(6):1949-1954.
[4]Hsu L C,Hsu Y W,Liang Y H,et al.Anti-tumor and antiinflammatory properties of ankaflavin and monaphilone A from Monascus purpureus NTU 568[J].Journal of Agricultural and Food Chemistry,2011,59(4):1124-1130.
[5]Hsu Y W,Hsu L C,Liang Y H,et al.New bioactive orange pigments with yellow fluorescence from Monascus-fermented dioscorea[J].Journal of Agricultural and Food Chemistry,2011,59(9):4512-4518.
[6]Huang Z B,Xu Y,Li L S,et al.Two new Monascus metabolites with strong blue fluorescence isolated from red yeast rice[J].Journal of Agricultural and Food Chemistry,2008,56(1):112-118.
[7]黄志兵.红曲菌两种新的荧光代谢产物的研究[D],南昌,南昌大学,2009.
[8]陈国珍,黄贤智,郑朱梓,等.荧光分析法[M].北京:科学出版社,1990.
[9]张小威,赵凤林,李克安.环丙沙星与牛血清白蛋白相互作用的研究[J].高等学校化学学报,1999,201(7):1063-1067.
[10]Lakowicz J R.Principles of Fluorescence Spectroscopy,Second ed.[M].New York:Plenum Press,1999,237.
[11]Ware W R.Oxygen quenching of fluorescence in solution:an experimental study of the diffusion process[J].Journal of Physical Chemistry,1962,66:455-458.
[12]朱铿,童沈阳.荧光黄与蛋白质相互作用的研究[J].高等学校化学学报,1996,17(4):539-542.
[13]Ross D P,Subramanian S.Thermodynamics of protein association reactions:forcescontributing to stability[J].Biochemistry,1981,20:3096-3102.
