膜型凋亡诱导配体脱落可能参与肺腺癌对TRAIL耐受
2013-10-10王月华张慧锋赵良中李文平玲综述曹慧玲审阅
李 妍,王月华,金 宏,陈 爽,张慧锋,赵良中,李 瑶,李文平,张 铎,齐 玲综述,曹慧玲审阅
(吉林医药学院:1.检验学院,2.实验中心,3.药学院,4.基础医学院,5.科研学术处,吉林 吉林 132013)
肿瘤坏死因子相关凋亡配体(tumor necrosis factor related apoptosis inducing ligand,TRAIL)选择性、高效地诱导多种肿瘤细胞凋亡[1]。继重组人TRAIL蛋白(recombinate human TRAIL,rhTRAIL)、抗死亡受体5(death receptor 5,DR5)单抗进入临床Ⅰ、Ⅱ期后,转染TRAIL基因抗肿瘤也完成了临床前研究,并克服了前两种制剂半衰期短的缺点[2]。虽然多数肺腺癌(adenocarcinoma,ADC)对转染 TRAIL基因耐药,但TRAIL高效、低毒的优势推动我们不断研究耐药机制、探索增敏策略[3]。
1 诱骗受体导致TRAIL耐受
三聚体的 mTRAIL(或 sTRAIL)与 DR4、DR5在细胞膜处组装死亡诱导信号复合物(death inducing sig naling complex,DISC),再募集、活化下游分子来传递凋亡信号;而诱骗受体1(decoy receptor 1,DcR1)、DcR2或骨保护素(osteoprotegerin,OPG)竞争结合TRAIL阻断凋亡信号(图1)[3]。以 A549为代表的DR4、DR5和 DcR1阳性 ADC对 TRAIL高度耐受[4-5]。DISC信号在胞浆内传递的通路有多个环节参与TRAIL抵抗,包括c-FLIP、Bcl-2和NFκB相关的抗凋亡信号活化等,相关机制相对清晰。DcR1、DcR2对DISC组装抑制是产生耐药的上游环节,但对其影响DISC组装、参与TRAIL抵抗的机制,尚有待深入探究。
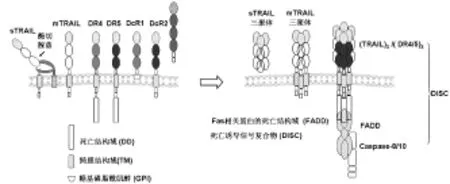
图1 TRAIL和TRAIL的受体
脂筏(lipid raft)是细胞膜内富含胆固醇和鞘磷脂的微结构域,可选择性地募集磷脂酰基醇(glycosyl phosphatidyl inositol,GPI)所锚定的分子和其他类型的跨膜分子。三聚体TRAIL和三聚体DR4(DR5)结合后,被募集到脂筏内才能组成有功能的DISC(图2)。DcR1通过GPI锚定于细胞膜,在未结合TRAIL前已稳定结合在脂筏中,而DR4、DR5和DcR2分布在脂筏外[6]。TRAIL与DR4结合后向脂筏内迁移,但脂筏内DcR1竞争结合TRAIL,并将DR4排出到脂筏外。DcR1胞浆区无“死亡结构区域(death domain,DD)”,因此不能募集 FADD形成有功能的 DISC。DcR2可在脂外筏外可成同源三聚体,与DR4或DR5竞争结合三聚体化的TRAIL,由于胞浆区DD不完整,DcR2-TRAIL复合体可转入脂筏但不能募集下游信号分子[7]。近年发现,DcR2与DR5可形成异源三聚体或多聚体,然后与TRAIL三聚体结合,(DcR2-DR5)-TRAIL复合体也转入脂筏,但与 DcR2结合Caspase-8不能活化。(DcR2-DR5)-TRAIL因同时消耗TRAIL和caspase-8,对DR5组装DISC形成较强的抑制效应[7]。
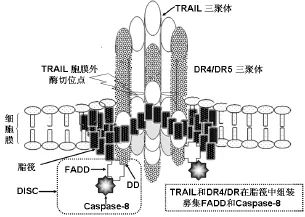
图2 TRAIL和DR4(DR5)在脂筏内组装DISC
2 sTRAIL诱导细胞凋亡的活性减弱
膜型和可溶型凋亡诱导配体(TRAIL、TNF和FasL)诱导细胞凋亡的能力存在差异,通常可溶型分子诱导细胞凋亡的活性弱[8-9]。FasL是TNF超家族中与TRAIL同源性最高的成员,淋巴细胞表面的mFasL主要由去整合素金属蛋白酶10(a desintegration and metalloproteinase,ADAM10)酶切,抑制 ADAM10则减少 sFasL释放,促进 mFas诱导细胞凋亡[10]。虽然活化免疫细胞释放的sTRAIL,可结合肿瘤细胞的DR4和DR5,导致caspase-8活化,但其诱导凋亡能力弱于 mTRAIL[10]。除 mTRAIL可组装DISC外,sTRAIL及包含了N端119~241位氨基酸的多种长度的rhTRAIL也可组装DISC诱导敏感的靶细胞凋亡,但其活性也低于mTRAIL[8-9]。近年发现,sTRAIL和mTRAIL活性差异与细胞是否表达DcR1有密切联系。DcR1与TRAIL结合的亲和力高于 DR4,DcR1可与 DR4竞争结合 rhTRAIL或sTRAIL,阻止有 DISC组装。即使 DR4结合的rhTRAIL迁移入脂筏内,也可能被DcR1“抢夺”,并由DcR1将 DR4“排挤”出脂筏,研究发现,表型为DR4+、DR5+、DcR1+、DcR2-的 A549 细胞对 rhTRAIL高度耐受[4-5]。DcR1通过该机制对 sTRAIL和rhTRAIL抑制不仅被体外研究证实,临床实践中也发现DR4和DcR1阳性结肠癌对TRAIL诱导凋亡高度耐受[11]。
3 MMP-2参与mTRAIL的酶切、脱落
mTRAIL是281个氨基酸所组成Ⅱ型跨膜蛋白,分子量为32 500,其N端241个氨基酸位于胞膜外,跨膜区和胞浆区分别为26和14氨基酸[2]。病毒感染、肿瘤、自身免疫病等疾病情况下,血清中24 000 sTRAIL含量增加[12-13]。在体外以细菌脂多糖(lipopolysaccharide,LPS)、佛波酯(phorbol myristate acetate,PMA)及干扰素(interferons,IFNs)等刺激细胞,活化的中性粒细胞、淋巴细胞和肿瘤细胞也可释放sTRAIL[13-16]。TRAIL 是 TNF 超家族发现较晚的成员,新近才证实金属蛋白酶家族成员参与TRAIL的酶切脱落。广谱金属蛋白酶抑制剂1,10-菲咯啉(1,10-phenanthroline)和ADAM10抑制剂TAPI-1(tumor necrosis factor-alpha protease inhibitor-1)可显著抑制IFN-α诱导的结肠癌细胞释放 sTRAIL,同时上调mTRAIL表达[15-16]。Secchiero等进一步证明,基质金属蛋白酶2(metrics metalloproteinase-2,MMP-2)也参与人 mTRAIL 的酶切,并释放24kDa的 sTRAIL[17]。
4 跨膜分布的mTRAIL参与细胞膜脂筏形成
免疫细胞主要以内源表达的mTRAIL杀伤肿瘤和病毒感染等靶细胞,肿瘤细胞的mTRAIL也可通过与自身或相临细胞DR4、DR5组装为DISC,诱导凋亡[16-18]。N端119~241位氨基酸是 TRAIL与受体结合的功能区;其中230位Cys残基(Cys230)参与该分子与二价锌离子螯合,稳定形成具有活性的同源三聚体。研究发现,细胞表面mTRAIL需先组装为三聚体才能向脂筏内迁移,而其在脂筏内与DR5结合还参与脂筏结构的稳定,跨膜分布的mTRAIL促进细脂筏内DISC的形成[19]。sTRAIL也具有形成DISC的功能,但sTRAIL不具备跨膜区,缺少了mTRAIL稳定脂筏子内DISC的功能。理论而言,抑制MMP-2对mTRAIL的酶切,可能促进mTRAIL-DR5在脂筏内组装DISC,从而增强凋亡信号的转导,克服对DcR1阳性肿瘤细胞对TRAIL的耐受。
5 低浓度姜黄素对MMP-2的抑制作用
姜黄素(分子式为C21H20O6,分子量368.4)是取自姜黄属植物根部的活性成分,具有治疗炎症、抗肿瘤和抗纤维化等药理作用[20]。姜黄素以活性氧(reactive oxygen species,ROS)依赖途径抑制胰腺癌、肝癌、乳腺癌和肺癌等肿瘤增殖,IC50值为 50~100 μmol/L[21]。近年来,低浓度(≤50 μmol/L)姜黄素非ROS依赖途径抗肿瘤的机制陆续被发现[22]。主要包括:①抑制组蛋白去乙酰基酶(histone deacety lases,HDACs);②通过上调p21和p27表达而抑制细胞周期运行;③通过抑制NFκB而下调细胞周期素到D1(cyclin D1)和癌基因c-myc表达;④抑制磷脂酰肌醇-3激酶(phosphatidylinositol 3 kinase,PI3K)/Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycinm,mTOR)途径,使其下游抗凋亡、促增殖的靶基因表达下降等。在美国,姜黄素治疗胰腺癌已进入临床Ⅱ期,其在预防结肠癌方面的研究也日益被重视。此外,姜黄素下调与肿瘤转移密切相关的多种蛋白,包括表皮生长因子受体、血管内皮生长因子、MMP-2、MMP-3和 MMP-9等。新近发现,25~50 μmol/L姜黄素可抑制肝星状细胞株对明胶的水解,从而降低其迁徙和侵袭,即姜黄素抑制MMP-2水解细胞外胶原蛋白[23]。
目前,姜黄素是否抑制MMP-2酶切mTRAIL还未见报道。我们在前期工作中发现,5~20 μmol/L姜黄素以非ROS依赖的方式上调mTRAIL跨膜分布,并增强A549对TRAIL基因转染所诱导的凋亡。低浓度姜黄素可能通过抑制MMP-2来抑制sTRAIL释放,促进mTRAIL跨膜分布和DISC组装,从而增强TRAIL诱导DcR1阳性肺腺癌凋亡。若要阐明姜黄素抗肿瘤的新药理作用,尚需要参照如下技术路线深入开展研究,用实验数据回答如下问题(图3):①低浓度姜黄素上调TRAIL跨膜分布是否与其抑制MMP-2的酶切有关?②跨膜TRAIL增加是否促进脂筏内DISC组装?③姜黄素与TRAIL联合是否促进DcR1阳性肺腺癌细胞凋亡信号的转导?

图3 研究膜型分子脱落参与肺腺癌对TRAIL耐药的技术路线
mTRAIL和sTRAIL均可结合死亡受体,但膜结合型分子还参与脂筏内由DR4/DR5所组装DISC的稳定性。因此,阐明膜结合型TRAIL脱落的机制、证实姜黄素的新药理作用可能为提高肺腺癌对TRAIL治疗的敏感性提供新策略。
[1]Taylor D J,Parsons C E,Han H,et al.Parallel screening of FDA-approved antineoplastic drugs for identifying sensitizers of TRAIL-induced apoptosis in cancer cells[J].BMC Cancer,2011,11:470-487.
[2]Bellail A C,Qi L,Mulligan P,et al.TRAIL agonists on clinical trials for cancer therapy:the promises and the challenges[J].Rev Recent Clin Trials,2009,4(1):34-41.
[3]Piras V,Hayashi K,Tomita M,et al.Enhancing apoptosis in TRAIL-resistant cancer cells using fundamental response rules[J].Sci Rep,2011,1:144-155.
[4]Dorothee G,Vergnon I,Menez J,et al.Tumor-infiltrating CD4+T lymphocytes express APO2 ligand(APO2L)/TRAIL upon specific stimulation with autologous lung carcinoma cells:role of IFN-alpha on APO2L/TRAIL expression and-mediated cytotoxicity[J].J Immunol,2002,169(2):809-817.
[5]Ouyang W,Yang C,Liu Y,et al.Redistribution of DR4 and DR5 in lipid rafts accounts for the sensitivity to TRAIL in NSCLC cells[J].Int J Oncol,2011,39(6):1577-1586.
[6]Shirley S,Morizot A,Micheau O.Regulating TRAIL receptor-induced cell death at the membrane:a deadly discussion[J].Recent Pat Anticancer Drug Discov,2011,6(3):311-323.
[7]Chen B,Ma B,Yang S,Xing X,et al.DR5 and DcR2 are expressed in human lumbar intervertebral discs[J].Spine(Phila Pa 1976),2009,34(19):E677-E681.
[8]Ho T C,Chen S L,Shih S C,et al.Pigment epithelium-derived factor(PEDF)promotes tumor cell death by inducing macrophage membrane tumor necrosis factor-related apoptosis-inducing ligand(TRAIL)[J].J Biol Chem,2011,286(41):35943-35954.
[9]Wajant H,Moosmayer D,Wüest T,et al.Differential activation of TRAIL-R1 and-2 by soluble and membrane TRAIL allowsselective surface antigen-directed activation of TRAIL-R2 by a soluble TRAIL derivative[J].Oncogene,2001,20(30):4101-4106.
[10]Schulte M,Reiss K,Lettau M,et al.ADAM10 regulates FasL cell surface expression and modulates FasL-induced cytotoxicity and activation-induced cell death[J].Cell Death Differ,2007,14(5):1040-1049.
[11]Granci V,Bibeau F,Kramar A,et al.Prognostic significance of TRAIL-R1 and TRAIL-R3 expression in metastatic colorectal carcinomas[J].Eur J Cancer,2008,44(15):2312-2318.
[12]Cummins N,Badley A.The TRAIL to viral pathogenesis:the good,the bad and the ugly[J].Curr Mol Med,2009,9(4):495-505.
[13]李 妍,曹云新,张 赟,等.PMA对Jurkat细胞株中可溶型分泌和膜型TRAIL表达的调节[J].细胞与分子免疫学杂志,2005,21(3):276-279.
[14]Tecchio C,Huber V,Scapini P,et al.IFNalpha-stimulated neutrophils and monocytes release a soluble form of TNF-related apoptosis-inducing ligand(TRAIL/Apo-2 ligand)displaying apoptotic activity on leukemic cells[J].Blood,2004,103(10):3837-3844.
[15]Li Yan,Jin Boquan,Song Chaojun,et al.Metalloprotease inhibitors reducing the shedding of human TRAIL[M].Jilin:HHBE,2011:108-111.
[16]李 妍,金伯泉.可溶型细胞因子受体产生机制的研究进展[J].细胞与分子免疫学杂志,2012,28(5):551-555.
[17]Secchiero P,Gonelli A,Corallini F,et al.Metalloproteinase 2 cleaves in vitro recombinant TRAIL:potential implications for the decreased serum levels of TRAIL after acute myocardial infarction[J].Atherosclerosis,2010,211(1):333-336.
[18]Spitzer D,McDunn J E,Plambeck-Suess S,et al.A genetically encoded multifunctional TRAIL trimer facilitates cell-specific targeting and tumor cell killing[J].Mol Cancer Ther,2010,9(7):2142-2151.
[19]贾 卫,庄 然,李 琦,等.凋亡诱导配体TRAIL与细胞膜脂筏形成的关系[J].细胞与分子免疫学杂志,2005,21(1):1-5.
[20]Jutooru I,Chadalapaka G,Lei P,et al.Inhibition of NFkappaB and pancreatic cancer cell and tumor growth by curcumin is dependent on specificity protein downregulation[J].J Biol Chem,2010,285(33):25332-25344.
[21]Fu S,Kurzrock R.Development of curcumin as an epigenetic agent[J].Cancer,2010,116(20):4670-4676.
[22]Chen L X,He Y J,Zhao S Z,et al.Inhibition of tumor growth and vasculogenic mimicry by curcumin through down-regulation of the EphA2/PI3K/MMP pathway in a murine choroidal melanoma model[J].Cancer Biol Ther,2011,11(2):229-235.
[23]黄建贤,朱宝和,贺 德,等.姜黄素抑制HSC-T6细胞迁徙和侵袭的机制[J].中华肝脏病杂志,2009,17(11):835-838.
