(E)-3-芳亚甲基色满酮类化合物的快速合成及其抑真菌活性
2013-10-09李红亚李术娜王树香赵齐齐朱宝成
李红亚,李术娜,王树香,赵齐齐,朱宝成
(河北农业大学生命科学学院,河北保定 071001)
高异黄酮类化合物(homoisoflavonoids)是黄酮化合物中特殊的一类,其母体结构较异黄酮多1个碳原子,在植物中很少见[1].3-芳亚甲基色满酮作为高异黄酮众多结构类型中的一种,其分布更为局限,仅在Scillanervosasubsp.Rigidifolia、葡萄风信子(Muscari.racemosum)、雪光花(Chionodoxa.luciliae)及金凤花(Caesalpiniapulcherrima)等植物中有少量发现[2-6].因此,在很长一段时间内3-芳亚甲基色满酮化合物并未引起人们的注意.近来研究发现3-芳亚甲基色满酮化合物具有广泛的生物活性,其在抗氧化[7]、抗感染[8]、抗病毒[9]、抗诱变[10-11]、降低胆固醇[12]及抗菌[13]等方面均显示出良好的生物活性.故此,3-芳亚甲基色满酮连同其衍生物的合成及生物活性研究迅速引起了药学工作者的关注[14-17],有望成为创新药物的来源.3-芳亚甲基色满酮化合物的合成方法有2种:一种是由芳基取代的丙烯酸衍生物在四氟乙酸酐催化下关环获得[18];另外一种是在传统回流条件下由酸或碱催化色满酮与芳香醛发生羟醛缩合制得[19-22],2种方法中后者较为常用.传统回流方式反应时间长,反应效率较差,并且催化剂多为氯化氢、硫酸、磷酸或甲醇钠、氢氧化钾等具有腐蚀性的强酸或强碱.为改进这一反应,Farkas等人[23]曾尝试采用乙酸酐催化该缩合反应,但是反应时间长达80h.
微波辐射能促进许多化学反应,广泛地用于有机合成.具有操作简便、合成能耗低、反应时间短、产物易纯化、产率高及环境友好等优点[24-25].
本文借助微波辐射技术,在六氢吡啶催化下通过色满酮和芳香醛的缩合反应快速合成了12个新的(E)-3-芳亚甲基色满酮类化合物2a~2l,利用IR,1H NMR,13C NMR及元素分析对其结构进行了分析和表征,初步测定了其对植物病原真菌的抑菌活性.合成路线见式1.
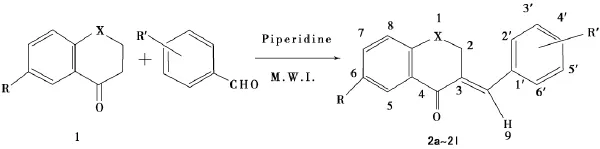
式1 (E)-3-芳亚甲基色满酮的合成Scheme 1 Synthesis of(E)-3-arylidenechroman-4-ones
1 实验部分
1.1 仪器及试剂
FTS40红外光谱仪(KBr压片)(美国BIO RAD公司);AVANCE AV-300MHZ超导核磁共振仪(TMS为内标,CDCl3为溶剂,瑞士Bruker BioSpin公司生产);MT-3CHN型元素分析仪(日本YANACO公司);X-4型显微熔点测定仪(温度计未校正,北京泰克仪器有限公司);BXS12-SXL9-1微波反应器(北京北信科仪分析仪器有限公司).试剂均为市售化学纯或分析纯,液体试剂使用前未作无水处理.供试病原菌由河北农业大学生命科学学院制药工程系提供.
1.2 标题物的合成
1.2.1 化合物1的合成
以取代苯酚和3-氯丙酸为原料,参考文献[26]方法进行.
1.2.2 目标化合物2a~2l的合成
在100mL圆底烧瓶中依次加入5mmol化合物1、5.5mmol取代苯甲醛、10滴六氢吡啶以及30mL乙醇.将其置于微波反应器内(输出功率为300W)进行反应.用硅胶薄层色谱(TLC)监测反应进程(展开剂:V(石油醚)∶V(乙酸乙酯)=3∶1).反应结束后,蒸除溶剂,用乙酸乙酯(60mL,分3次进行萃取)萃取剩余物,水洗、无水硫酸钠干燥过夜,浓缩,硅胶柱层析分离,洗脱液为V(石油醚)∶V(乙酸乙酯)=4∶1.浓缩洗脱液,得化合物2a~2l.
1.3 抑真菌活性测试
以质量分数50%的多菌灵可湿性粉剂为阳性对照,采用菌丝生长速率法[27],测定了目标化合物的抑真菌活性.将供试化合物用质量分数为5%的二甲基亚砜(DMSO)水溶液配制成质量浓度分别为100mg/L PDA培养基,测试其对5种供试真菌病原菌的抑菌活性.在已培养好供试菌株的平皿中取直径5mm的菌饼,置于含药平板内,每皿3块.以不加药剂者为空白对照.于温度为(25±1)℃培养箱内培养96h,测量菌落直径,计算菌丝生长抑制率.
相对抑制率=(对照菌落直径-处理菌落直径)×100%/对照菌落直径.
2 结果与讨论
2.1 化合物的合成与结构表征
在微波辐射下,以六氢吡啶为催化剂,通过色满酮与芳香醛的缩合反应制备了系列的3-芳亚甲基色满酮类化合物2a~2l,结果见表1.化合物2a~2l的结构通过红外光谱、核磁共振氢谱、碳谱和元素分析进行了确证.化合物理化数据和元素分析结果见表1,红外光谱和核磁共振氢谱分析数据见表2,核磁共振碳谱的数据见表3.通过1H NMR数据清楚地判断出3-芳亚甲基色满酮化合物的顺反异构[28-29].与Z构型的H-9质子信号相比,E构型中的H-9由于处于4-C=O的去屏蔽区,化学位移向低场移动,一般在7.81左右.从表2中的核磁共振氢谱数据中可以看出目标化合物的H-9质子化学位移分布在7.84~7.99内,符合E构型1H NMR特征.另外,在3-芳亚甲基色满酮类化合物的1H NMR谱图中,由于E构型中的H-2质子距离侧链苯环近,侧链苯环的去屏蔽效应导致其化学位移会向低场移动;而Z构型的H-2质子则相反,化学位移偏向高场.本文中合成的3-芳亚甲基色满酮类化合物的化学位移均处于较低场,并且因为与H-9质子的烯丙远程偶合,导致多数化合物的H-2质子信号裂分为2重峰,偶合常数为1.4~1.6Hz不等.综上,可判断目标化合物为(E)-3芳亚甲基色满酮类化合物.
此外,微波辐射可大大促进色满酮与芳香醛的缩合反应,提高反应效率.反应在2~4min内即可完成,(E)-3-芳亚甲基色满酮的产率可达78%~89%.结果见表1.与传统回流方法相比,反应速率大大提高,且产率也有所提高.以化合物2a为例,在传统回流条件下,由6-氯色满酮与苯甲醛在氯化氢饱和的乙醇溶液中回流24h以上,产率为70%.而在微波辐射、六氢吡啶催化下反应仅需3min,产率可达71.5%[29].综上,微波辐射可实现(E)-3-芳亚甲基色满酮类化合物的高效快速合成.
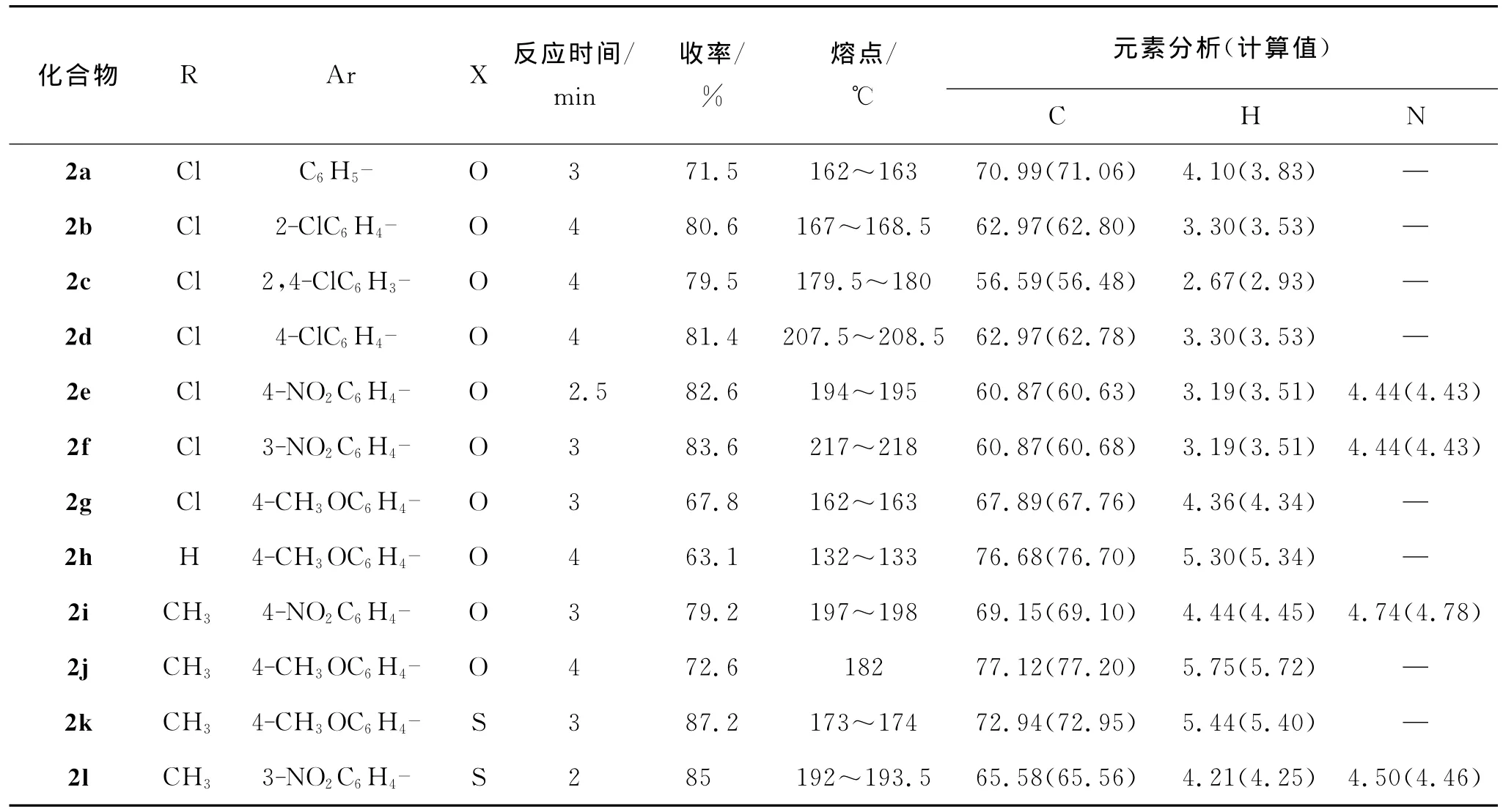
表1 化合物2a~2l的理化性质Tab.1 Physicochemical and elemental analysis data of compounds 2a~2l化合物

表2 化合物2a~2l的IR,1 H NMR数据Tab.2 IR and 1 H NMR spectral data of compounds 2a~2l

表3 化合物2a~2l的13C NMR数据Tab.3 13C NMR spectral data of compounds 2a~2l
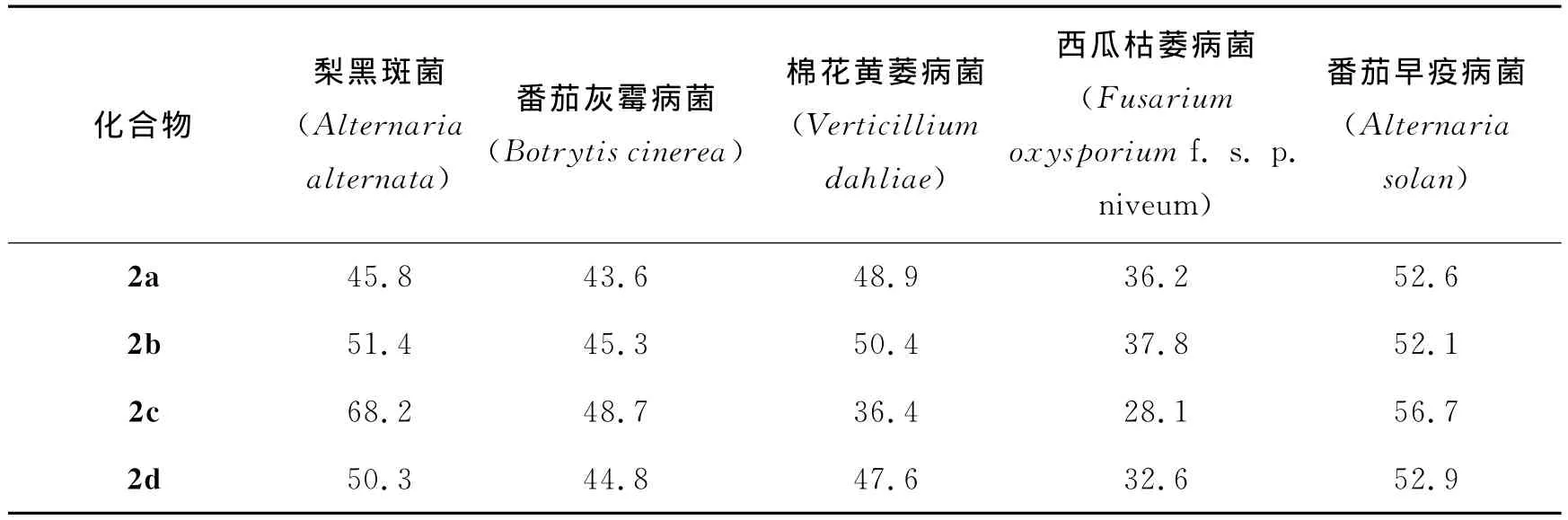
表4 化合物2a~2l的抑菌活性(100mg/L,抑制率/%)Tab.4 Fungicidal activity of compounds 2a~2l(100mg/L,inhibition rate/%)
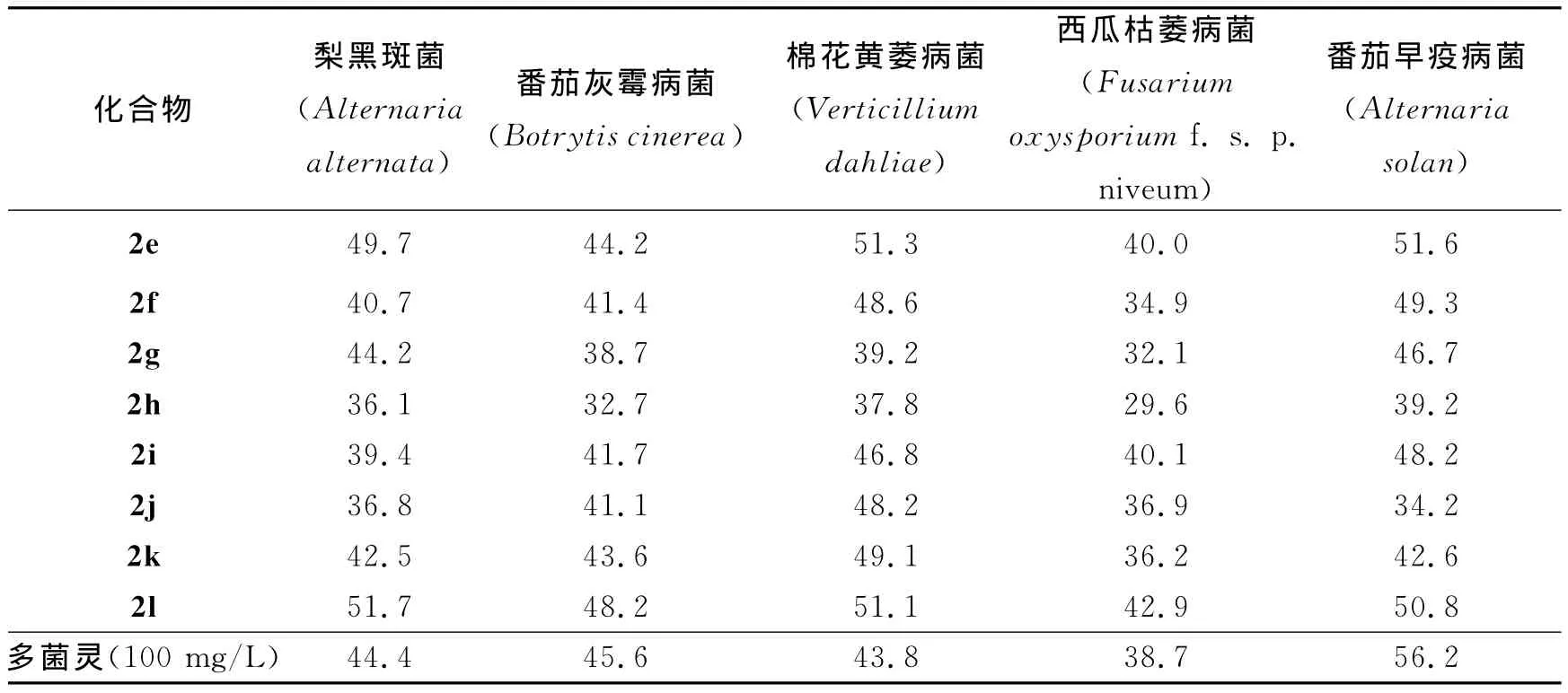
续表4Continue tab.4
2.2 抑菌活性
目标化合物2a~2l对5株供试病原真菌的抑菌活性见表4.从表4中的结果可以看出在100mg/mL质量浓度下,(E)-3-芳亚甲基色满酮类化合物对5株病原菌表现出一定的抑制活性,抑制率在28.1%~68.2%.化合物(E)-6-氯-3-(2,4-二氯)苯亚甲基色满酮2c对梨黑斑病菌、番茄灰霉病菌以及番茄早疫病菌的抑制活性最强,抑制率分别为68.2%,48.7%和56.7%,明显高于多菌灵对照组.而对于西瓜枯萎病菌和棉花黄萎病菌抑制活性较低.
[1] 江洪波,黄静,郭明娟,等.天然高异黄酮的研究进展[J].药学学报,2007,42(2):118-126.JIANG Hongbo,HUANG Jing,GUO Mingjuan,et al.Recent advances in the study of natural homoisoflavonoids[J].Acta Pharm Sin,2007,42(2):118-126.
[2] SILAYO A,NGUDJUI B T,ABEGAZ B M.Homoisoflavonoids and stilbenes from the bulbs ofScillanervosasubsp.Rigidifolia[J].Phytochemistry,1999,52:947-955.
[3] MASTEROVA I,SUCHY V,UHRIN D,et al.Homoisoflavanones and other constituents fromMuscariracemosum[J].Phytochemistry,1991,30:4569-4572.
[4] CORSARO M M,LANZETTA R,MANCINO A,et al.Homoisoflavanones fromchionodoxaluciliae[J].Phytochemistry,1992,31:1395-1397.
[5] MEPHERSON D D,CORDELL G A,SOEJARTO DD,et al.Peltogynoids and homoisoflavonoids fromCaesalpinia pulcherrima[J].Phytochemistry,1983,22:2835-2838.
[6] MAHESWARA M,SIDDAIAH V,RAO C V.Two new homoisoflavonoids from caesalpinia pulcherrima[J].Chemical and Pharmaceutical Bulletin,2006,54(8):1193-1195.
[7] SIDDAIAH V,RAO C V,VENKATESWARLU A V,et al.Synthesis,stereochemical assignments,and biological activities of homoisoflavonoids[J].Bioorg Med Chem,2006,14:2545-2551.
[8] DARMANADEN R,DHANUTRITO H,CASTEL J,et al.New derivatives of benzopyran-4-one with analgesic,antiinflammatory and antiplatelet clumping activity[J].Farmaco Sci,1984 39(10):876-877.
[9] DESIDERI N,OLIVIERI S,STEIN M L,et al.Synthesis and anti-picornavirus activity of homoisoflavonoids[J].Antiviral Chem Chemother,1997,8:545-555.
[10] WALL M E,WANI M C,MANIKUMAR H,et al.Plant antimutagens 6.Intricatin and intricatinol,new antimutagenic homoisoflavonoids from Hoffmanosseggia intricate[J].J Nat Prod,1989,52:774-778.
[11] MIADOKOVA E,MASTEROVA I,VICKOVA V,et al.Antimutagenic potential of homoisoflavonoids from Muscari racemosum[J].J Ethnopharmacol,2002,81:381-386.
[12] KIRKIACHARIAN B S,GOMIS M,KOUTSOURAKIS P.Synthese et activite de nouveaux oxyisobutyrates d'ethyle de benzylidene-2benzo[b]cyclanones,de benzylidene-3chromanones-4et de benzylidene-3camphre apparentes au clofibrate[J].Eur J Med Chem,1989,24:309-311.
[13] NAKIB T A,BEZJAK V,MEEGAN M J,et al.Synthesis and antifungal activity of some 3-benzylidenechroman-4-ones,3-benzylidenethiochroman-4-ones and 2-benzylidene-1-tetralones[J].Eur J Med Chem,1990,25:455-459.
[14] 马正月,闫国英,杨更亮,等.2,3,3a,4-四氢硫色烯并[4,3-c]吡唑类化合物的合成及其体外抗真菌活性研究[J].中国药学杂志,2009,44(8):630-633.MA Zhengyue,YANG Gengliang,YAN Guoying,et al.Synthesis of 2,3,3a,4-tetrahydrothio chromenopyrazoles derivatives and their antifungal activity in vitro[J].Chinese Pharmaceutical Journal,2009,44(8):630-633.
[15] LEVAI A,DINYA Z,SCHAG J B,et al.Synthesis of 3-Benzyl-4-chromones and 3-Benzyl-1-thio-4-chromones[J].Pharmazie,1981,36:465-468.
[16] SIDDAIAH V,MAHESWARA M,RAO C V,et al.Synthesis,structural revision,and antioxidant activities of antimutagenic homoisoflavonoids from Hoffmanosseggia intricate[J].Bioorg Med Chem Lett,2007,17:1288-1292.
[17] PERJESI P,DAS U,DE CLERCQ E,et al.Design,synthesis and antiproliferative activity of some 3-benzylidene-2,3-dihydro-1-benzopyran-4-ones which display selective toxicity for malignant cells[J].European Journal of Medicinal Chemistry,2008,43:839-845.
[18] BASAVAIAH D,BAKTHADOSS M,PANDIARAJU S.A new protocol for the syntheses of(E)-3-benzylidenechroman-4-ones:a simple synthesis of the methyl ether of bonducellin[J].Chem Commun,1998:1639-1641.
[19] SANGWAN N K,RASTOGI S N.Studies in antifertility agents:Part.XXXII±Synthesis and stereochemistry of 3,3a-trans and cis-2(H)-acetyl-3-aryl-3,3a-dihydropyrazolo[4,3-c][2H]chromenes,pyrazolo[3,4-a]benzocyc loalk-1-enes and 3,3a-trans and cis-2(H)-acetyl-3-aryl-8-methoxy-5-tosyl-3,3a,4,5-tetrahydropyrazolo[4,3-c]quinolines[J].Indian J Chem,Sect B,1981,20:135-138.
[20] WAGNER G,GARBE C,VIEWEG H,et al.Synthesis o f 3-(3-or 4-Amidinobenzyliden)chroman-4-one or-1-thiochroman-4-one[J].Pharmazie,1979,34:55-58.
[21] ROBERTS J F,ALHASSAN M,XICLUNA A,et al.Stereochemical studies of Michael-adducts obtained by reaction of the ethylmercaptoacetate with substituted 3-benzylidenechroman-4-ones and of their cyclisation into 4H-thieno[3,4-c]benzo[e]pyran derivatives[J].Bull Soc Chim Fr,1993,130:788-790.
[22] PFEIFFER P,VON BANK G.Aminobenzalchromanone[J].J Prakt Chem,1938,151:319-321.
[23] FARKAS L,GOTTSEGEN A,NOGRADI M,et al.Synthesis of homoisoflavanones-II:Constituents ofEucomisautumnalis andE.punctata[J].Tetrahedron,1971,27:5049-5052.
[24] 白银娟,赵永侠,陈旭东,等.微波促进下4-芳基亚氨基-1,2,4-三唑的合成[J].应用化学,2008,25(3):366-368.BAI Yingjuan,ZHAO Yongxia,CHEN Xudong,et al.Synthesis of 4-arylideneamino-1,2,4-trizoles under microwave irradiation[J].Chinese Journal of Applied Chemistry,2008,25(3):366-368.
[25] LI Qinghan.Microwave-assisted synthesis of asymmetric thiocarbonohydrazones under solvent-free conditions[J].Chinese Chem Lett,2009,20(11):793-796.
[26] LI Jitai,LI Hongya,LI Huizhang,et al.A rapid and efficient synthesis of thiochroman-4-ones under microwave irradiation[J].J Chem Res,2003,6:394-396.
[27] 陈年春.农药生物技术测定[M].北京:北京农业大学出版社,1991:61.
[28] KEANE D D,MARATHE K G,O’SULLIVAN W I,et al.Configuration and conformation of 3-arylideneflavanones[J].J Org Chem,1970,35:2286-2290.
[29] BENNETT P,DONNELLY J A,MEANEY D C,et al.Stereochemistry of cyclopropyl ketones from the reaction of dimethylsulphoxonium methylide with 3-benzylidenech roman-4-ones[J].J Chem Soc Perkin Trans1,1972:1554-1559.
