猪流行性腹泻病毒ShT株的分离及传代培养
2013-10-09唐满华梁桂益陈瑞爱
何 玲,唐满华,梁桂益,陈瑞爱,2
(1.广东大华农动物保健品股份有限公司,广东新兴 527400;2.华南农业大学兽医学院,广州 510642)
猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)为猪的常见易感病毒之一,对哺乳仔猪的危害最严重,感染后死亡率可达100%。我国以12月至次年2月为本病高发季节[1],并多与猪传染性胃肠炎、轮状病毒等其他肠道病原混合感染,给养猪业造成严重经济损失[2]。PEDV适应细胞培养难度高,人工细胞培养很难获得成功。Hoffman等在Vero细胞的培养液中加入胰酶,才使得PEDV的细胞培养首次获得成功[3],之后陆续有PEDV在Vero细胞中获得成功培养的报道。本实验将猪流行性腹泻病毒疑似病猪的粪便样品处理后在Vero细胞上连续传代,分离到一株猪流行性腹泻病毒,命名为ShT株,并对该病毒的培养特性、繁殖滴度进行了研究。
1 材料
1.1 病料 待检样品为粪便样,来自广东省某猪场疑似发生猪流行性腹泻的病猪。发病仔猪临床表现水样腹泻;死亡猪小肠段充满黄色液体,肠壁变薄。
1.2 细胞及培养试剂 Vero细胞由广东大华农公司技术中心生药研发室保存;胎牛血清、DMEM营养液购自 Hyclone公司,批号分别为 GWH0092,NXK0731;胰蛋白酶购自 GIBCO公司,批号为894452。
1.3 病毒鉴定引物 根据GenBank报告的PEDV N基因cDNA序列(accession NC003436),设计2对引物,分别为套式PCR的外围引物和内围引物,扩增的目的片段长度分别为467 bp和221 bp。外围引物序列为:P1:5’-TATGTCTAACGGTTCTATTCCC-3’;P2:5`-CCTTATAGCCCTCTACAAGCA -3’;内围引物序列为:P3:5’-GGGCTAGCTTCCAGGTCAAC -3’,P4:5’- CGTTACACCAGTTGGTGCTC-3’。引物由英潍捷基(上海)贸易有限公司合成。
1.4 其他主要试剂 胶体金试纸卡Anigen Rapid PEDV Ag test Kit(RG14-01)由韩国BioNote公司生产。
PEDV与猪细小病毒(PPV)特异性阳性血清:由广东大华农公司技术中心生药研发室制备并保存。
MiniBEST Viral RNA/DNA Extraction Kit(DV819A)、PrimeScript One Step RT -PCR Kit(DRR055A)、pMD20 - T Vector(D107A)、Premix Taq(D334)等购自宝生物工程(大连)有限公司;Gel Extraction Kit(DC3511-01)为Biomiga公司产品。RT-PCR反应总体积25μL,包含PrimeScript One Step enzymemix 1μL、2 × One Step Buffer 12.5 μL、RNA模板2μL,上下游引物(浓度为10μm/L)各2μL,灭菌水5.5μL。套式 PCR反应总体积25μL,包含 Premix Taq 12.5 μL,模板2 μL,上下游引物(浓度为10 μm/L)各2μL,灭菌水6.5 μL。
2 方法
2.1 病料的PCR检测 取待检粪样,4℃8000 g离心15 min,收集上清液;再用4层纱布过滤,收集滤出液,-70℃保存。采用氯仿-异戊醇方法提取病毒RNA,用设计的猪流行性腹泻病毒的外围引物按常规方法检测PEDV N基因,扩增条件为94℃预变性2 min,94 ℃变性30 s,53 ℃复性30 s,72 ℃延伸30s,30个循环,72℃延伸10 min。
2.2 病毒的分离 经PCR检测为PEDV阳性的样品12000 g离心10 min,取上清液以0.22μm无菌滤膜将含病毒的上清液过滤除菌。取24 h生长良好的Vero单层细胞,弃去培养液,按照10%接毒剂量接入上清液,即10 mL DMEM营养液中加入100μL病毒液。参考以往报道的文献资料添加胰酶至终浓度为0~60μg/mL。设置不接种病毒的含有相同浓度胰酶的细胞培养物作为阴性对照,置37℃5%CO2环境下培养,逐日观察,以48~96 h为一个传代周期,盲传3~4代。
2.3 细胞分离物的检测
2.3.1 套式PCR检测及序列测定 细胞培养物反复冻融3次后,采用氯仿-异戊醇方法提取病毒RNA,用外围引物按2.1的方法扩增猪流行性腹泻病毒的N基因。PCR产物1∶100稀释后,再用内围引物进行套式PCR扩增,扩增条件为94℃预变性2 min,94 ℃变性30 s,54℃复性 30 s,72 ℃延伸30 s,30个循环,72℃延伸7 min。将套式PCR扩增片段插入pMD-18T simple vector中,进行序列测定。将测序结果与GeneBank中公布的PEDV N基因核苷酸序列进行比对。
2.3.2 胶体金试纸卡检测 用韩国Anigen Rapid PEDV Ag test Kit检测。取培养至第27代和37代的病毒液100μL,加入装有1 mL反应缓冲液的样品收集管中,充分混匀;取出胶体金试纸卡,平放于宽敞和干燥的表面;用滴管向样品孔中缓慢并且精确地加入4-5滴混和液;反应进行时,会有紫色的条带在试纸中间的窗口中移动;5~10 min判断结果。
2.3.3 血清中和试验 采用固定病毒量稀释血清的方法。PEDV和PPV阳性血清由本实验室制备保存。PPV阳性血清作为阴性对照,DMEM液作为空白对照。
2.4 PEDV的培养特性
2.4.1 病毒的传代培养 将上一代的细胞培养物反复冻融3次,按2.2所述进行传代。整个传代过程期间,设置不接种病毒的含有相同浓度胰酶的细胞培养物作为阴性对照,逐日观察细胞病变效应。待出现明显病变时,按出现病变最早,最明显的培养条件继续传代。
2.4.2 病毒致细胞病变效应的特性 在倒置显微镜下观察并记录PEDV在Vero细胞上的CPE形成情况。
2.4.3 病毒的细胞感染滴度测定 在96孔细胞板上进行,每个稀释度接种8孔,每孔0.1mL,病毒稀释液为含有100μg/mL卡那霉素的DMEM。置37℃5%CO2环境下培养,逐日观察。根据细胞病变孔数按Reed-Muench法计算TCID50/0.1 mL。
3 结果
3.1 从粪便样和细胞培养物中扩增PEDV N基因的结果 对粪便样品进行RT-PCR检测,结果扩增出1条约为460 bp的DNA片段,其大小与预计片段理论值相符(如图1-A)。第8代病毒液用套式PCR扩增出1条约为220 bp的DNA片段,其大小与预计片段理论值相符(如图1-B)。分别将粪便样品的扩增片段和病毒液的套式PCR扩增片段插入pMD-20T vector中,进行测序。测序结果与GenBank中已公布的PEDV(accession NC003436)N基因核苷酸序列相似度达99%以上。
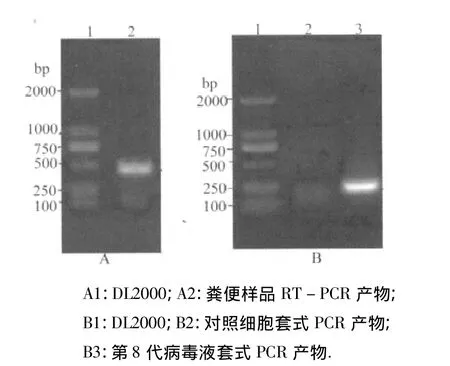
图1 PEDV PCR鉴定结果
3.2 胶体金试纸卡检测 培养至第27代和37代的病毒液10倍稀释后滴入试纸卡的样品孔中,质控线(C线)出现紫色条带,检测线(T线)出现淡淡的紫色条带,表明病毒液中含有PEDV,且其毒价不低于104TCID50/0.1 mL,因为此试纸卡的检测灵敏度为 104TCID50/0.1 mL。
3.3 血清中和试验 血清中和试验表明分离获得的病毒能被PEDV阳性血清中和,而不能被PPV阳性血清中和。进一步证实Vero细胞分离物中存在PEDV,命名为PEDV ShT株。
3.4 病毒的细胞培养特性 盲传至第4代时出现细胞病变,第5代病变已非常明显,以后随着传代次数的增加,CPE逐渐增加,并且出现的时间缩短,表现为细胞肿胀、变圆,颗粒物质增多,折光性增强和培养后期细胞的大量脱落(如图2)。
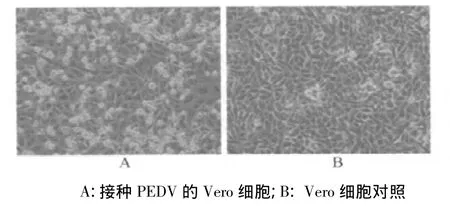
图2 接种PEDV的Vero细胞产生的病变
3.5 病毒的细胞感染滴度 取用Vero细胞培养至第20代,25代、30代的病毒液,测其细胞感染滴度,病毒稀释液为含有100μg/mL卡那霉素的DMEM。结果,其 TCID50/0.1 mL 分别为 10-7.0、10-7.13、10-7.33。
4 讨论
国内有关猪流行性腹泻病毒分离鉴定的报道不少[4-5],但是病毒的分离条件、培养增殖条件不尽相同。例如,钱永清等[6]将病毒在 Vero细胞上盲传5代后,转入Marc145细胞上培养,维持液为含一定胰酶的1640培养液,盲传至第7代出现细胞病变。本试验采用Vero细胞、含胰酶的DMEM分离到一株猪流行性腹泻病毒(PEDV ShT株)。病毒盲传第4代时就观察到细胞病变,表现为细胞肿胀变圆,折光性增加,颗粒物质增多,培养后期出现细胞的大量脱落。
用含胰酶和不含胰酶的DMEM作为稀释液测PEDV ShT株的细胞感染滴度,两者获得的结果相差甚远。因此,认为PEDV的细胞培养物毒价的比较和评定不能单纯比较数值多少,还应清楚取得该数值的测定方法与条件。另外还可以借助胶体金检测卡、动物实验等方法来辅助评价病毒细胞培养物毒价的高低。
PEDV的体外细胞适应难度大,繁殖条件复杂,病毒在细胞培养中繁殖滴度低,一直是PEDV体外增殖过程的一个重要技术瓶颈,直接影响了PEDV的生物学特性基础研究和实践中相关生物制品的发展[7]。研究中的PEDV ShT株能在Vero细胞上稳定生长,产生的病变也十分明显。结合PEDV ShT株病料来源的感染猪的临床症状及其细胞培养特性来看,其很有希望成为一较好的疫苗株。但是其能否真正成为猪流行性腹泻病毒疫苗的种毒候选株,还需要后续对其免疫原性和稳定性进行试验研究。
[1] 殷 震,刘景华.动物病毒学(第二版)[M].北京:科学出版社.1996:688-690.
[2] 倪艳秀,林继煌,何孔旺,等.猪流行性腹泻研究概况[J].畜牧与兽医,2001,33(1):38 -40.
[3] Hofmann M,Wyler R.Propagation of the virusof porcine epidemic diarrhea in cell culture[J].JClin Microbiol,1988,26:2235 -2239.
[4] 张桂红.猪流行性腹泻病毒地方株LJB/03株分离鉴定[D].黑龙江哈尔滨:东北农业大学,2008.
[5] 钱永清,闻人楚,唐永兰,等.猪流行性腹泻病毒的分离培养与鉴定[J].上海农业学报,1999,15(2):41 -44.
[6] 钱永清,苏万国,何锡忠,等.从上海郊区新分离到一株猪流行性腹泻病毒[J].上海畜牧兽医通讯,2003,6:15.
[7] 毛雅元,张桂红,葛俊伟,等.猪流行性腹泻病毒地方株LJB/03株分离及培养特性[J].病毒学报,2010,26(6):483-488.
