猪繁殖与呼吸综合征化学发光检测技术研究
2013-10-09张社民郝云鹏张瑞琴
张社民,温 涛,郝云鹏,张瑞琴
(1.山西省芮城县畜牧兽医局,山西芮城 044600;2.吉林大学畜牧兽医学院,长春 130062;3.太原钢铁公司养殖场,太原 030003)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种以呼吸障碍及怀孕母猪流产为主要特征的疾病,在我国时有发生,引起了极大的经济损失[1]。目前,针对该病主要采用抗原抗体筛查、疫苗接种等方式予以防控。
PRRSV的血清学诊断方法较大程度上受到抗原影响,早在1997年,Cho等[2]发现不同的毒株制备的抗原对于所制备的ELISA试剂盒的检测广度影响较大,其中利用PRRSV89-46448株制备的抗原包被ELISA较其他毒株(LHVA-93-3,PA-8,93-44927,932-24025B,GH -6,MN -1B,LV)效果最佳。除ELISA外,PRRSV抗体检测方法还有彩色免疫金银染色法及乳胶凝集试验,但因敏感度和定量方面的问题,导致其应用较少[3-4]。PRRSV抗体检测方法主要的分析对象是PRRSV的M、N、GP5蛋白,由于上述蛋白所产生的抗体与不同毒株结合的特异性并不十分清楚,相应检测方法的临床意义并不明确,无法依其结果指导生产。1977年Tsuji等首次提出并验证了化学发光免疫分析技术(Chemiluminescence immunoassay,CLIA),并已成功应用于多个领域[5-7]。但将CLIA与ELISA结合应用于检测,尚未见报道。
为了能准确检测PRRSV抗体,进一步了解病毒的感染规律,本研究根据双抗原夹心ELISA检测方法,结合化学发光检测体系建立了检测血清中PRRSV抗体与疾病相关性的化学发光酶联免疫分析方法(CLEIA)。
1 材料
1.1 血清 标准阳性和标准阴性血清为本实验室研制,保存于-20℃;待检血清为从当地5个规模养猪场送检的260份猪血清,置于-20℃备用。
1.2 抗原 GST-N重组蛋白由本实验室利用大肠杆菌系统表达并纯化,-20℃储存备用。
1.3 主要试剂 辣根过氧化物酶(HRP)标记的重组核衣壳蛋白由北京博迈德科技发展有限公司提供;TMB底物显色液由北京佰亿新创科技有限公司提供;PriClin300、Tween20由Sigma公司提供。
1.4 主要仪器 AUY-120型电子天平,日本岛津仪器系统有限公司;BHP9504型微孔板发光分析仪,滨松光子有限公司;微量加样器,芬兰Labsystems公司;单条可拆96孔发光板,深圳金灿华公司;GB11241-89型水温箱,北京市医疗设备厂;DELTA 320 pH计,梅特勒-托利多仪器(上海)有限公司。
2 方法
2.1 CLEIA试验步骤 本试验采用酶促化学发光免疫检测的方法,以纯化后的重组N蛋白一部分作为包被抗原,以HRP标记的N蛋白一部分为标记抗原,采用双抗原夹心一步法的反应模式。
2.2 CLEIA工作条件的优化 包括包被液的选择、标准品稀释液的选择、包被抗原浓度的选择、最佳反应体系的选择、酶标记抗原最佳工作时间的选择。
2.3 标准品的制备 将确定浓度的标准品分别稀释成0(S0)、5(S1)、10(S2)、25(S3)、50(S4)、100(S5)ng/mL五个浓度点,按CLEIA工作流程,做出标准曲线,测定自配标准品各点浓度值,采用计算测定值与标示值的平均比值的方法来进行校对。同时对标准品与相应浓度的样品进行平行性分析测定,做线性拟合时,各标准点发光值减去S0发光值,然后与标准点浓度值进行双对数数学模型(Log X-Log Y)拟合。
2.4 特异性试验
2.4.1 阻断试验 观察PRRS血清阻断性试验,判定标准应为:经过PRRS病毒重组抗原阻断的阳性血清的OD值比未阻断的阳性血清的OD值减小,而阴性血清的OD值基本上没有发生变化。随着血清稀释倍数的增大,阻断后的阳性血清的OD值逐渐与阴性血清的OD值接近,当血清稀释到160倍,可以达到完全阻断。
2.4.2 特异性交叉反应试验 用最适的条件进行ELISA试验,分别将引起猪繁殖障碍的四种主要疾病猪瘟、伪狂犬病、猪细小病毒、猪圆环病毒2型的阳性血清作为待检样品,同时做PRRSV阳性和阴性对照,根据OD450值进行结果的判定。
2.5 重复性试验
2.5.1 批内重复性试验 用同一批制备的重组蛋白包被反应板,取10份抗体水平不同的血清,在同一时间、同一条件下,同一批试验中按双抗原夹心ELISA操作程序进行测定,每份血样平行做5孔,对结果进行统计学分析。不同血清样品的变异系数不超过10%。
2.5.2 批间重复性试验 随机选取3块不同批次包被的酶标板,在相同条件下检测8份抗体水平不同的血清样品,按双抗原夹心ELISA操作程序进行测定,计算同一份血清样品在不同批次间OD值的变异系数来检测批间检测样品的重复性。
3 结果
3.1 包被缓冲液的确定 按CLEIA操作步骤,选择3种缓冲液,即pH 4.8的柠檬酸盐缓冲液、pH 7.4的磷酸缓冲液及pH 9.6的碳酸缓冲液,稀释包被抗原,其他条件不变。三种包被缓冲液S0、S5的发光值及S5/S0的值见表1。

表1 不同包被缓冲液的S0、S5的发光值及S5/S0的值
由表1可以得出,以柠檬酸盐为包被缓冲液时,其S0点的发光值明显低于其他包被液,且S5/S0的值明显高于其他包被缓冲液,因此,选择柠檬酸盐作为包被缓冲液。
3.2 标准品稀释液的确定 按CLEIA操作步骤,选择3种稀释液,即马血清、山羊血清、牛血清,稀释抗原,其他条件不变。三种标准品稀释液健全性试验结果见图1。三种标准品稀释液S0、S5的发光值及S5/S0的值见表2。

图1 不同标准品稀释液稀释后抗原浓度
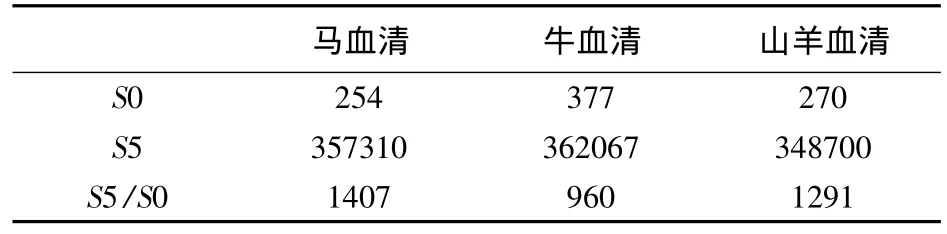
表2 不同标准品稀释液的S0、S5的发光值及S5/S0的比值
由图1可以看出,用马血清稀释的抗体时,抗体浓度与稀释倍数的相关性明显好于山羊血清和牛血清。同时,由表2可以看出,用马血清稀释的抗体后,其S0点发光值低于其他稀释血清,S5/S0值也明显高于另外两种血清,因此,选择马血清作为标准品稀释液。
3.3 包被浓度的确定 按CLEIA操作步骤,根据确定的最佳包被液将抗原分别稀释为0.5、1、2 μg/mL,其他条件不变,根据S5/S0的值确定最佳包被浓度。三个浓度的包被缓冲液S0、S5的发光值及S5/S0的值见表3,由表3可以看出,当包被浓度为1μg/mL,其S5发光值达到最大,且S5/S0也明显高于其他浓度,因此,选择1μg/mL作为包被浓度。
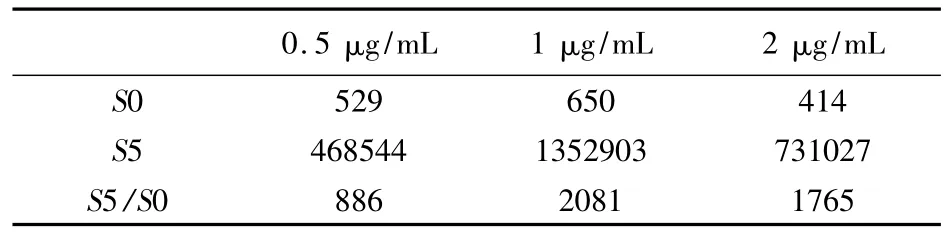
表3 不同浓度的包被缓冲液S0、S5的发光值及S5/S0的值
3.4 酶标记抗原工作浓度的确定 按CLEIA工作流程,将辣根过氧化物酶标记的抗原分别以1∶5000、1 ∶10000、1 ∶20000 倍稀释,其他条件不变。三个工作浓度的酶标抗原的S0、S5的发光值及S5/S0的值见表4。酶标抗原在1∶5000倍的工作浓度下,S5/S0值明显高于其他两个工作浓度,因此,选择1∶5000倍稀释作为酶标抗原工作浓度。
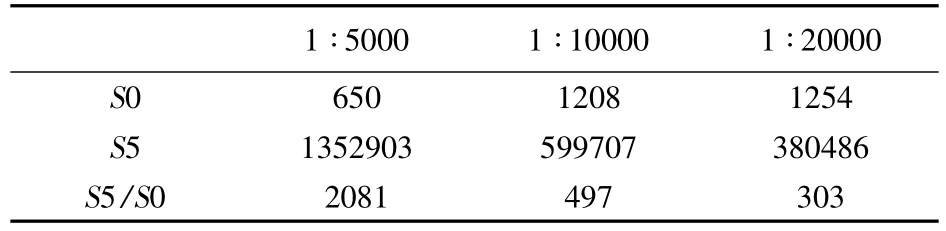
表4 不同工作浓度的酶标抗原的S0、S5的发光值及S5/S0的值
3.5 最佳反应体系的确定 按CLEIA工作流程,分别采用50μL校准品或待检品与50μL酶标记抗原的反应体系,50μL校准品或待检品与100μL酶标记抗原的反应体系,25μL校准品或待检品与100μL酶标记抗原的反应体系,进行反应,其他条件不变。三种反应体系的S0、S5的发光值、S5/S0的值及线性关系见表5。在采用50μL校准品或待检品与50μL酶标记抗原的反应体系时,S5/S0的值及线性关系明显好于其他两个反应体系,因此,选择50μL校准品或待检品与50μL酶标记抗原的反应体系。
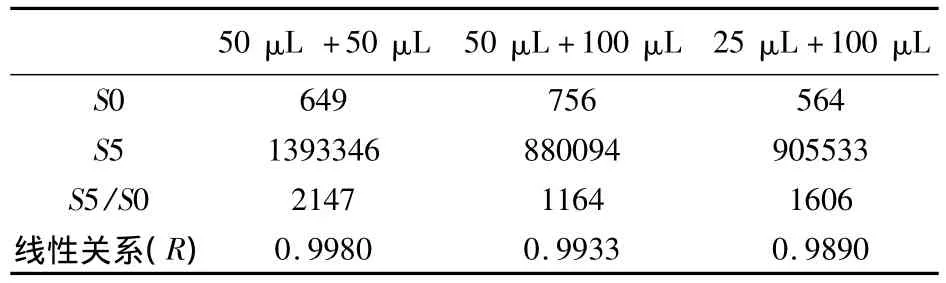
表5 不同反应体系的S0、S5的发光值、S5/S0的比值及线性关系
3.6 酶标记抗原最佳工作时间的确定 按CLEIA工作流程的三种反应体系(3.5项)进行反应,其他条件不变,根据S5/S0的值和线性关系确定最佳反应体系。三个酶标抗原工作时间的S0、S5的发光值、S5/S0的值及线性关系见表6。酶标抗原工作时间在60 min时,S5/S0的值及线性关系明显好于其他两个工作时间,因此,选择60 min作为酶标抗原工作时间。
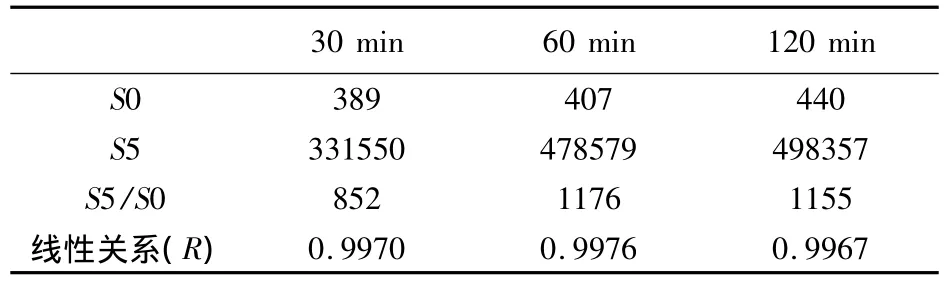
表6 不同酶标抗原工作时间的S0、S5的发光值、S5/S0的比值及线性关系
3.7 试剂盒各项技术参数的结果
3.7.1 剂量-反应曲线的线性 于不同试验日分别测定8个不同批次试剂的校准品,用双对数数学模型拟合,计算其剂量-反应曲线相关系数(r)值。结果(表7)表明,本试剂盒的线性关系均保持在0.995以上。
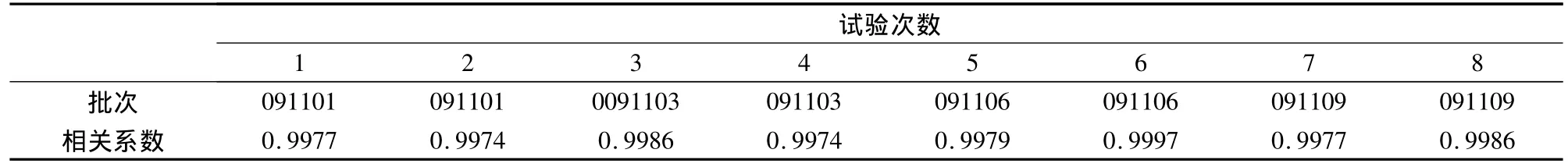
表7 剂量-反应曲线相关系数试验结果
3.7.2 灵敏度 以S0校准品进行10次重复测定,其平均值加上三倍标准差求出所对应的浓度值,分别用不同批次的试剂盒进行五次试验,结果见表8。灵敏度试验应不少于3批(包括3批),本方法测定五批的灵敏度,结果为0.49ng/mL。

表8 灵敏度试验结果
3.7.3 精密度
3.7.3.1 分析内精密度 配制成低、中、高质控血清,在同一批试验中测定它们的化学发光强度值,计算出其浓度值,每个质控血清平行做10孔,计算其变异系数。分析内精密度结果见表9。由此可以看出本试剂盒对高、中、低血清的分析内精密度均小于10%。

表9 分析内精密度试验结果
3.7.3.2 分析间精密度 配制成低、中、高质控血清,分别用不同批次的试剂盒测定它们的浓度值,每批平行做10孔,计算三批的变异系数,分析间精密度结果见表10。由此可以看出本试剂盒对高、中、低血清的分析间精密度均小于12%。

表10 分析间精密度试验结果
3.7.4 干扰反应 在7份已经确定值的血样中分别加入胆红素、血红蛋白、甘油三脂、枸橼酸钠、EDTA-Na2、肝素、草酸钠,混匀后用试剂盒检测PRRSV浓度,计算其检出率。干扰试验的结果见表11。
3.7.5 HOOK效应 利用高浓度的抗体,将抗体浓度倍比增加,直到发光值随着抗体浓度的增加而降低时,得到的抗体浓度为出现HOOK效应的浓度。HOOK效应试验结果见表12。由表12可以看出,产生HOOK效应时被测物的浓度(即被测物的浓度增加其 RLU值反而降低)在1500ng/mL左右。

表11 干扰试验结果

表12HOOK效应试验结果
3.7.6 稳定性 将试剂盒分别在37℃加速破坏5d和10d后,与4℃放置的试剂盒进行比较。试验结果见表13。结果表明,该药盒在37℃放置5d和10d后,与4℃放置的试剂盒相比,其变化不显著,根据37℃放置1d相当于4℃放置40d的经验计算,可知该试剂盒的有效期不少于12个月。

表13 稳定性试验结果
3.7.7 准确性
用定值的混合血清按不同比例稀释高浓度的标准抗原,得到高、中、低三个浓度的样品,然后用该试剂盒进行检测,在不同时间进行五次试验,计算其平均回收率,结果见表14。由表14可以看出,该试剂盒在检测高、中、低三个浓度样品的平均回收率均在要求的90% ~110%之间,符合要求。

表14 回收性试验结果
3.8 试剂盒的应用性(本试剂盒与酶联免疫分析法(ELISA)比较) 对84份血清标本,分别用化学发光免疫分析法和酶联免疫分析法同时测定。以本法CLEIA的测定值为x轴,酶联免疫分析法的测定值为y轴,结果经统计学处理得相关系数方程式为:Y=1.7398X - 2.1336,相关系数为:r=0.9486(图2)。结果表明化学发光免疫分析法与酶联免疫分析法呈高度相关。

图2 本法与ELISA的相关性分析
4 讨论
4.1 利用ELISA检测PRRSV抗体需解决的问题
近年来,我国境内的PRRSV变异现象十分活跃[8]。目前,临床上主要用 ELISA方法检测PRRSV的抗体。2005年,江云波等利用原核表达PRRSV GP5及M融合蛋白,建立了ELISA检测方法,发现GP5与M蛋白的抗体水平与中和抗体的水平之间线性关系并不高。同年,吴延功等利用重组PRRSV N蛋白作为抗原包被制备ELISAs试剂盒,具有良好的特异性和敏感性。仝利剑等建立猪蓝耳病病毒抗体双抗原夹心ELISA方法[9],夏向荣等也做了相似的工作,但均未就其与中和性抗体的关系作进一步的阐述[10-11]。
4.2 剂量-反应曲线的建立与定量分析方法的建立
化学发光免疫分析过程中,每批测试均须用一系列不同浓度的参考标准品在相同的条件下制作标准曲线,即剂量-反应曲线。在绘制曲线时通常以浓度值为横坐标,发光值为纵坐标,用双对数数学模型做线性拟合剂量-反应曲线时反映检测是否准确,线性相关系数R越接近于1,发光值和浓度值相关性越强,检测的浓度值准确,反之,则不适合检测。一般来说,在化学发光免疫分析中,相关系数R>0.99才适于检测。本研究中,经过多次试验所得到的线性关系(R)均大于0.995,已超过了国家规定的R>0.99的检测标准。
4.3 化学发光免疫分析与HOOK效应的关系
HOOK效应是在二位点夹心化学发光免疫分析中,当浓度值高到一定剂量时,其剂量-反应曲线不再呈正比例曲线,而是出现向下弯曲状,似一只钩子。虽然此时的浓度值很高,但是发光值却很低,从而使检测结果偏低。这种现象在一步法和两步法检测中均会出现,只是在一步法中出现较早[12-13]。该现象的出现可能是由于抗体浓度过高,没有形成包被抗原-抗体-酶标抗原复合物,而形成了包被抗原-抗体复合物或酶标抗原-抗体复合物,酶并没有联接到固相上,在洗板时将其洗掉,因此检测时发光值偏低。本试验中对HOOK效应的研究显示,当PRRSV浓度达到1500 ng/mL左右时,将出现HOOK效应。所以在使用时,如出现明显症状,但检测的浓度值却很低时,应考虑到HOOK效应,将血清用零标准点稀释后再作检测以确定其浓度值。
5 结论
本试剂盒的测值与酶联免疫分析的测值显著相关,相关系数为0.9486,说明本试剂盒的测值和酶联免疫分析的测值相当,可达到同等检测水平。本试剂盒适用于PRRSV抗体的检测、诊断和流行病学调查,为猪繁殖与呼吸综合征的防控提供了一种新的检测技术。
[1] 贾 赟,芦银华,张素芳,等.猪圆环病毒2型、猪繁殖与呼吸综合征病毒及猪细小病毒混合感染的流行病学调查[J].中国病毒学,2004,5:86 -88.
[2] ChoHJ,DeregtD,JooHS.AnELISAforporcinereproductive andrespiratorysyndrome:productionofantigenofhighquality[J].CanJVetRes,1996,60(2):89 - 93.
[3] 李新生,陈经英,崔 沛,等.彩色免疫金银染色法检测猪繁殖与呼吸综合征病毒的研究[J].河南农业科学,2005,(9):94 -98.
[4] 许立华,苏鑫铭,刘华雷,等.检测猪繁殖与呼吸综合征抗体的重组N蛋白乳胶凝集试验的建立[J].中国病毒学,2004,19(4):401-403.
[5] ArakawaH,MacdaM,TsujiA.Enzymeimmunoassayofcortisol bychemilunminescencereactionoflumjnol- peroxidase[J].BunsekiKagaku,1977,26:322 -326.
[6] 韩佩珍.化学发光免疫分析[J].国外医学·放射医学核医学分册,2000,24:196 -200.
[7] 李振甲.国内外标记免疫分析技术研究现状[J].中华医学检验杂志,1999,22(5):278 -280.
[8] 侯丽丽,赵铁柱,遇秀玲,等.高致病性猪繁殖与呼吸综合征病毒分子流行病学调查[J].中国兽医学报,2006,6:677 -682.
[9] 仝利剑,赵建增,张社民,等.猪蓝耳病病毒抗体双抗原夹心ELISA方法的建立及初步应用[J].中国兽医学报,2010,10:1273-1276.
[10]吴延功,徐天刚,王志亮,等.重组N蛋白抗原检测PRRSV抗体的ELISA研制——Ⅲ.ELISA试剂盒保存条件[J].中国兽医学报,2006,(4):5 -7.
[11]夏向荣,李玉峰,姜 平,等.PRRSV抗体竞争ELISA检测方法的建立与标准化研究[J].畜牧与兽医,2005,(11):7 -10.
[12] RodaA,GuardigliM,PasiniP,etal.Bioluminescenceandchemiluminescenceindrugscreening[J].AnalBioanalChem,2003,377(5):826-833.
[13] WangHX,StottRA,ThorpeGHH,etal.Anenhancedchemiluminescenceenzymeimmunoassayforserumprogesterone[J].Steroids,1984,44(4):317 -328.
