c-Met蛋白、端粒酶在肝细胞癌中的表达及临床意义
2013-10-09张玫娜郭志鹏王广义
曹 扬,张玫娜,郭志鹏,王广义
(吉林大学白求恩第一医院,吉林 长春130021)
原发性肝癌(primary liver carcinoma,PLC)是常见恶性肿瘤之一,我国主要高发于东南沿海地区。死亡率高,在我国恶性肿瘤中死因排第二位.肝癌死亡率呈升高态势,但标化死亡率已显示升高幅度趋缓.肝癌防治应当继续成为我国肿瘤防控的重点[1]。癌细胞的永生化是肿瘤细胞区别于正常细胞的重要特征,也是肿瘤生长和转移的关键。端粒酶(Telomerase)是一种逆转录酶,目前大量的研究证明肿瘤细胞中端粒酶的活性与其细胞的无限增殖存在密切的关系。人端粒酶催化亚单位(human telomer-ase reverse transcriptasc hTERT)是端粒酶组成成分之一,且hTERT的表达与端粒酶的活性呈平行关系[2,3]。已知c-Met蛋白是肝细胞生长因子 (hepatocyte growth factor,HGF)的单一受体,研究证明其表达与肿瘤细胞侵袭转移能力密切相关。然而目前尚未有研究表明肝细胞癌中端粒酶与c-Met蛋白的表达是否具有相关性,故本研究应用免疫组织化学法对42例肝细胞癌(hepatocellular carcinoma HCC)和 10 例 癌 旁 细 胞 中 c-Met蛋 白 和hTERT基因蛋白在肝细胞癌中的表达进行检测,分析二者在肝细胞癌中的表达意义和相关性,进而探讨二者对肝细胞癌侵袭、转移和预后的影响,为临床肝细胞癌的诊断治疗和预后判定提供理论依据
1 对象与方法
1.1 标本
肝细胞癌标本42例,为2007-2010年吉林大学第一医院病理科存档的肝细胞癌石蜡标本。其中男性:26例,女性16例;年龄30-79岁,平均60.8岁;有包膜:19例,无包膜23例;肝硬化:34例;乙肝表面抗原阳性(HBsAg):36例;有肝内及远处转移32例,无转移10人。另取10例肝细胞癌癌旁组织标本作为对照组。
1.2 主要试剂
兔抗人TERT端粒酶(bs-0233R)多克隆抗体及兔抗人c-met/HGFR(bs-0668R)多克隆抗体,免疫组化染色试剂盒(SP-0023)和DAB显色试剂盒均购自北京博奥森生物技术有限公司。
1.3 实验方法
严格按S-P免疫组化染色检测试剂盒所附操作程序进行操作。
1.4 结果判断
c-Met蛋白以胞浆和胞膜染成黄色或棕黄色;hTERT以细胞核和/或细胞浆呈棕黄色颗粒为阳性结果。每张切片与高倍镜(10×20)随机取5个视野,分别观察两者阳性强度和阳性率。先按染色强度(a)如下评分:无色为0分;浅黄为1分;黄为2分;棕黄为3分。然后再按阳性细胞所占百分比b(%)评分:阳性细胞<5%为0分;阳性细胞5%-25%为1分;阳性细胞26%-50%为2分;阳性细胞51%-75%为3分;阳性细胞>75%为4分。结果分析:a×b在0分计(-);0-2分计为(+);2-6分计为(++);6-12分计为(+++)。
1.5 统计学处理
阳性率组间比较采用χ2检验,等级分组资料组间比较采用非参秩和检验分析,相关分析用非参数相关(Spearman)分析,采用SPSS13.0统计软件包进行统计学检验,P<0.05为差异有统计学意义。
2 结果
2.1 c-Met和hTERT在肝细胞癌和癌旁组织中的表达
c-Met蛋白和hTERT在肝细胞癌组织中的表达阳性率分别为76.19%和88.09%,对照组分别为30%和40%。两组间阳性率比较差异均有统计学意义(P<0.05),见表1,图1。
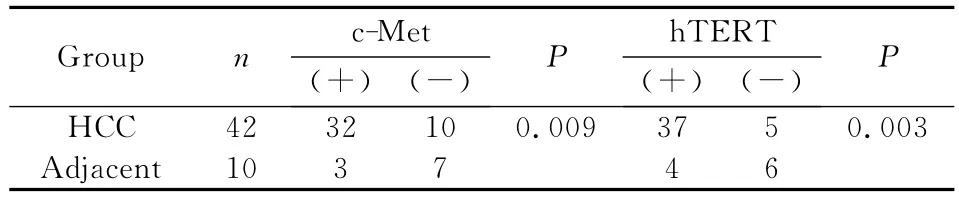
表1 c-Met、hTERT在肝细胞癌和癌旁组织中的表达比较
2.2 c-Met和hTERT在肝细胞癌中表达的相关性分析
行Sperman相关分析得出相关系数为r=0.140,两者之间无相关性(P>0.05),见表2。
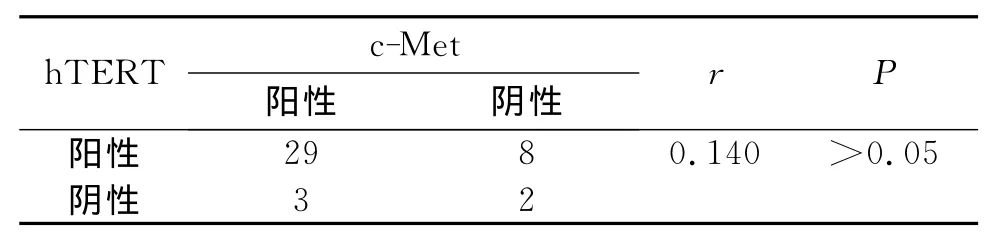
表2 c-Met、hTERT在肝细胞癌组织表达的相关性
2.3 c-Met蛋白和hTERT的表达与肝细胞癌病理参数的关系
c-Met的表达与性别、年龄、肝硬化及 HBsAg无关(P>0.05),与肿瘤的转移有关(P<0.05);hTERT与性别、年龄、肿瘤的转移及HBsAg均无关(P>0.05),与肝硬化有关(P<0.05),见表3。

表3 c-Met和hTERT的表达与肝细胞癌病理参数的关系
2.4 c-Met在hTERT阳性和阴性的肝细胞癌组织中表达
hTERT阳性肝细胞癌组织中c-Met(+++)、(++)、(+)和(-)分别为15、9、5和8例。hTERT阴性肝细胞癌组织中c-Met(+++)、(++)、(+)和(-)分别为0、2、1和2例。两组间比较有统计学差异(P<0.05),见表4。
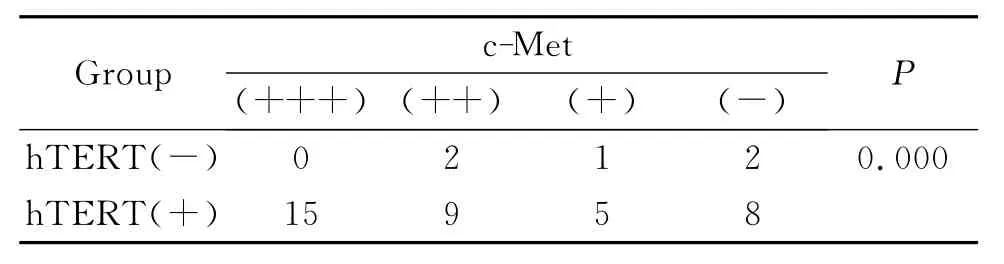
2.4 c-Met在hTERT阳性和阴性的肝细胞癌组织中表达
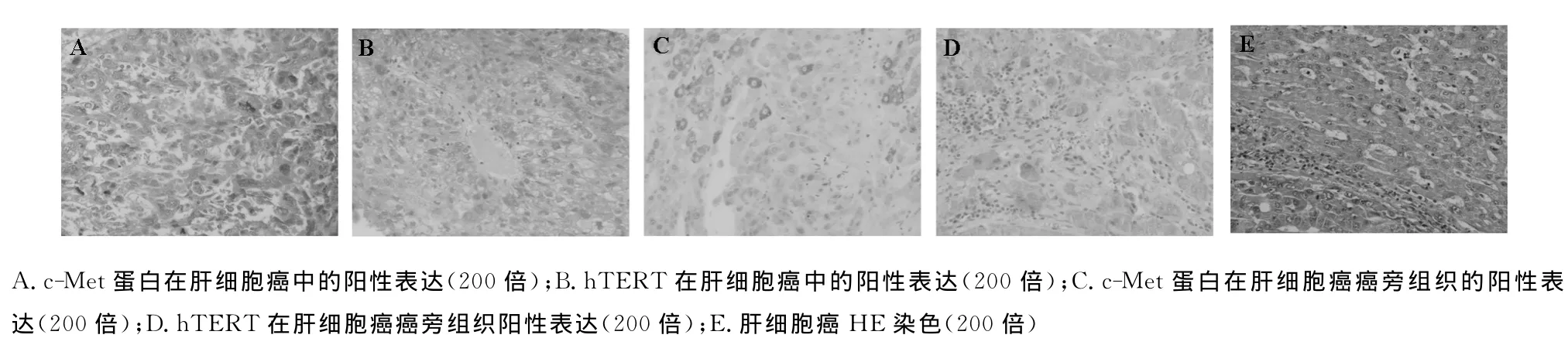
图1 c-Met和hTERT在肝细胞癌和癌旁组织中表达
3 讨论
肿瘤细胞有别于正常组织细胞其一在于细胞的侵袭转移能力,肿瘤细胞的转移过程主要包括:肿瘤细胞自身的黏附性降低、瘤细胞与细胞外基质(ECM)相互作用即基质溶解和移动、瘤细胞从原位点沿着缺损的ECM向周围侵袭或进入淋巴管、血管向远处转移[4]。研究认为 HGF/c-Met蛋白的信号转导通路可使β2连环蛋白的酪氨酸残基发生磷酸化,使之不能与E2钙粘蛋白胞内部分结合形成复合体,阻碍了E2钙粘蛋白和细胞骨架的连接作用,最终导致细胞之间的粘附作用减弱。基质金属蛋白酶-9(Matrix metalloproteinases-9,MMP-9)是基质金属蛋白酶家族中的重要一员,又称明胶酶B,大量的能降解基底膜和细胞外基质的多种成分,进而促进细胞的侵袭和转移,Abounader R等[5]研究认为 HGF/c-Met蛋白的信号转导通路可诱导MMP-9的生成进而促进肿瘤细胞的转移。本研究结果显示c-Met蛋白的表达与肿瘤的转移之间有统计学意义(P<0.05)。Maulik G 等研究也认为HGF与其受体c-Met结合并启动该受体酪氨酸激酶的活性,进而启动ECM的降解最终参与肿瘤细胞的浸润[6]。
研究认为肿瘤血管形成是恶性肿瘤生长、浸润和转移的基础,当肿瘤组织生长到直径大于1-2mm时,其进一步生长需要新生血管为其提供必要的营养物质。肿瘤血管形成是一个复杂的多因素过程。近年来的研究发现HGF可以引起血管内皮细胞的增殖,具有诱导血管生成的作用;并且可以通过自分泌和旁分泌的形式与c-Met相结合直接刺激血管内皮细胞或影响其他血管生长因子(如VEGF、bFGF)的表达和分泌,间接促进血管的生长。还有研究认为受到 HGF活化的c-Met蛋白受体动员骨髓内皮祖细胞分化为血管内皮细胞,刺激内皮细胞的增殖、迁移、形成血管样结构[7,8]。
肿瘤细胞区别于正常组织细胞其二在于细胞的无限增殖永生能力。大量研究表明,细胞获得永生能力与端粒酶的激活密切相关,由于端粒酶的激活,使端粒的长度维持一种动态平衡,使肿瘤细胞获得无限制增殖的能力。端粒酶活化是肿瘤发生的一个显著的生物学特征[9]。端粒酶主要由两部分组成:模板RNA和hTERT,后者以前者起逆转录酶的作用,后者与细胞端粒酶活性高低密切相关,hTERT的变化可较准确的反映细胞中端粒酶活性的变化[10]。本实验hTERT在肝细胞癌组织和癌旁中的表达阳性率分别为88.09%和40%。两组间阳性率比较差异有统计学意义(P<0.05)。
本实验结果显示c-Met蛋白与端粒酶的表达无相关性r=0.140(P>0.05),但端粒酶阳性的肝细胞癌中c-Met蛋白的表达量要明显的多于端粒酶阴性的肝细胞癌组织(P>0.05)。此结果侧面的反应了端粒酶阳性的肝细胞癌的侵袭转移能力要明显的强于端粒酶阴性的肝细胞癌组织。因此对二者定量的检测可能给临床的治疗及预后带来一定的指导意义。
[1]Chen JG,Zhang SW,Chen WQ,et al.Analysis of liver cancer mortality in the national retrospective sampling survey of death causes in China,2004-2005[J].Zhonghua Yu Fang Yi Xue Za Zhi.,2010,44(5):383.
[2]Middleman EJ,Choi J,Venteicher AS,et al.Regulation of cellular immortalization and steady-state levels of the telomerase reverse transcriptase through its carboxy-terminal domain[J].Mol Cell Biol,2006,26(6):2146.
[3]Sabah M,Cummins R,Leader M,et al.Immunohistochemical detection of hTERT protein in soft tissue sarcomas:correlation with tumor grade[J].Appl Immunohistochem Mol Morphol,2006,14(2):198.
[4]Pantel K,Brakenhoff RH.Dissecting the metastatic cascade[J].Nat Rev Cancer,2004,4(6):448.
[5]Abounader R,Ranganathan S,Lal B,et al.Reversion of humanglioblastoma malignancy by U1small nuclear RNA/ribozyme targeting of scatter factor/HGF and c-met expression[J].J Natl Cancer Inst,1999,91(18):1548.
[6]Maulik G,Shrikhande A,Kijima T,et al.Role of the hepatocyte growth factor receptor,c-Met,in oncogenesis and potential for therapeutic in-hibition[J].Cytokine Growth Factor Rev,2002,13(1):41.
[7]Kim E S,Sal g i a R.MET pat hw ay as a therapeu tic target[J].J Thorac On col,2009,4(4):444.
[8]SattlerM,Sa l giaR.TheMET ax is as at herapeu tic target[J].Update Cacer Ther,2009,3 (3):109.
[9]龙 军,付曲波,黄才斌,等.端粒、端粒酶及其基因转录调控与肿瘤[J].赣南医学院学报,2008,28(3):467.
[10]Hu J,Banerjee A,Goss DJ.Assembly of b/HLH/z proteins c-Myc,Max,and Mad1wit h cognate DNA:importance of proteinprotein and protein-DNA interactions[J].Biochemistry,2005,44(35):11855.
