鲍曼不动杆菌的耐药性及β-内酰胺酶耐药基因的研究
2013-10-09邓丽华施德仕杨荣胜许美荣胡莉萍
邓丽华,施德仕,杨荣胜,许美荣,胡莉萍
(徐州医学院附属医院 检验科,江苏 徐州221002)
鲍曼不动杆菌是临床常见的致病菌之一,其耐药率高,耐药机制复杂,给临床治疗带来很大困难,被冠名为革兰阴性杆菌的MRSA[1],特别是产β-内酰胺酶菌株常造成感染的流行与暴发,甚至出现多重耐药,这已成为一个全球性问题[2-5]。为了解我院鲍曼不动杆菌耐药性及β-内酰胺酶基因流行特点,我们检测了临床分离的50株鲍曼不动杆菌,并用分子生物学技术检测了5种较常见的β-内酰胺酶相关基因 TEM-1、IMP、0XA-23、0XA-24、AmpC,以期发现本地区的产β-内酰胺酶鲍曼不动杆菌的特点,现报告如下。
1 材料与方法
1.1 主要仪器和试剂 美国BD公司Phoenix-100型全自动细菌鉴定药敏分析系统,PCR扩增仪ABI2720为美国ABI公司产品,DYY一8C型电泳仪为北京市六一仪器厂产品,ZF-20D暗箱式紫外分析仪购自巩义市予花仪器公司,PCR MasterMix试剂盒购自北京百泰克生物技术有限公司。
1.2 菌株来源 2011年1月至2011年11月徐州医学院附属医院住院患者痰、中段尿、脑脊液、血液等不重复标本中分离的50株鲍曼不动杆菌。
1.3 药物敏感试验 采用最低抑菌浓度(MIC)法,全部菌株均使用美国BD公司Phoenix-100全自动细菌鉴定药敏分析系统检测,结果判定按美国临床实验室标准化委员会(CLSI)2010年版标准执行。质控菌株大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853购自卫生部临床检验中心。
1.4 鲍曼不动杆菌DNA的制备 将经过Phoenix-100型全自动细菌鉴定药敏分析系统鉴定后储存于-70℃低温冰箱的50株鲍曼不动杆菌转入血平板,经18-24h培养后,挑取3-4个菌落转入到1ml生理盐水中,离心半径6㎝,10 000r/min离心1min,在细菌沉淀中加入0.16ml无菌去离子水,充分震荡混匀,然后100℃水浴10min,再在冰盒里冰浴10 min,离心半径6㎝,10 000r/min离心1min后取上清液作为作为DNA模板,-20℃冰箱保存备用。
1.5 随机引物PCR扩增分型 参考文献[6]的实验结 果,选 用 随 机 引 物 ERIC1R(5’-ATGTAAGCTCCTGGGGATTCAC-3’) 和 ERIC2 (5’-AAGTAAGTGACTGGGGTGAGCG -3’).进 行PCR反应扩增。后将PCR产物在1.5%的琼脂糖凝胶中,150V电泳20min后用凝胶成像仪观察DNA条带的分布并对其基因型进行分析。
1.6 扩增引物 TEM-1、0XA-23、0XA-24、IMP、AmpC型基因扩增引物的设计和基本方法参照文献[7],由上海生工生物工程有限公司合成,各种靶基因引物序列和目的产物长度见表1。
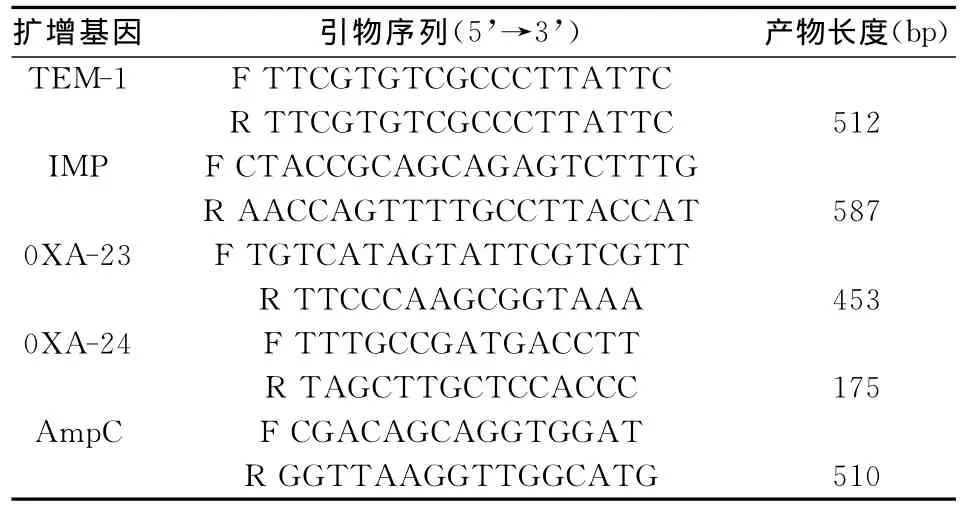
表1 PCR引物序列
1.7 基因检测 均为PCR法检测。共检测5种β-内酰 胺 酶 基 因,包 括 TEM-1、0XA-23、0XA-24、IMP、AmpC,各种靶基因PCR扩增体系体积20μl,其中2×Taq PCR Master Mix 10μl,10μmol/L的上、下游引物各 μl,灭菌ddH2O 7μl,DNA 模板1 μl。离心混匀后置PCR仪上进行自动化扩增反应。TEM、IMP反应条件:94℃预变性5min。94℃60 s,55℃ 60s,72℃ 50s。0XA-23、0XA-24反应条件:94℃预变性5min,94℃30s,48℃30s,720C35 s。AmpC反应条件:94℃预变性5min。94℃30s,50℃30s,72℃50s。以上反应经30次循环后,72℃延伸7min。以DNA MarkerI和D2000为相对分子质量标准。取5μl扩增产物点样于含核酸染料的1.5%琼脂糖凝胶,150V电泳20min后紫外凝胶电泳成像仪下观察结果并照相。
1.8 耐药基因序列分析 取PCR产物送上海生工生物工程有限公司,由上海生工生物工程有限公司协助完成。
2 结果
2.1 药敏试验结果 50株鲍曼不动杆菌对多粘菌素B全部敏感,而对其余18种抗生素耐药率为52%-100%,除多粘菌素B外全部耐药的24株,主要来自于ICU,标本类型主要为痰标本,50株鲍曼不动杆菌对临床常用β-内酰胺类抗生素有较高的耐药率,对第三、四代头孢菌素的头孢他啶、头孢噻肟、头孢吡肟的耐药率均达80%以上,对亚胺培南和美罗培南的耐药率也达62%以上,对除多粘菌素B外目前常用的抗生素耐药率达52%以上。50株鲍曼不动杆菌对抗菌药物的耐药性见表2。
2.2 50株鲍曼不动杆菌分型结果 50株鲍曼不动杆菌分成8个基因型,其中B型34株,G型4株,F、H型各2株,其余均各为1株,B型菌株为主要的流行株,其余均为散发菌株。34株B型中,有22株来自ICU,7株来自脑外科,3株来自普外科,2株来自呼吸内科,34株菌有26株为多重耐药的鲍曼不动杆菌,且均携带3种及以上β-内酰胺酶基因。基因分型见图1。

表2 50株鲍曼不动杆菌药物敏感试验结果
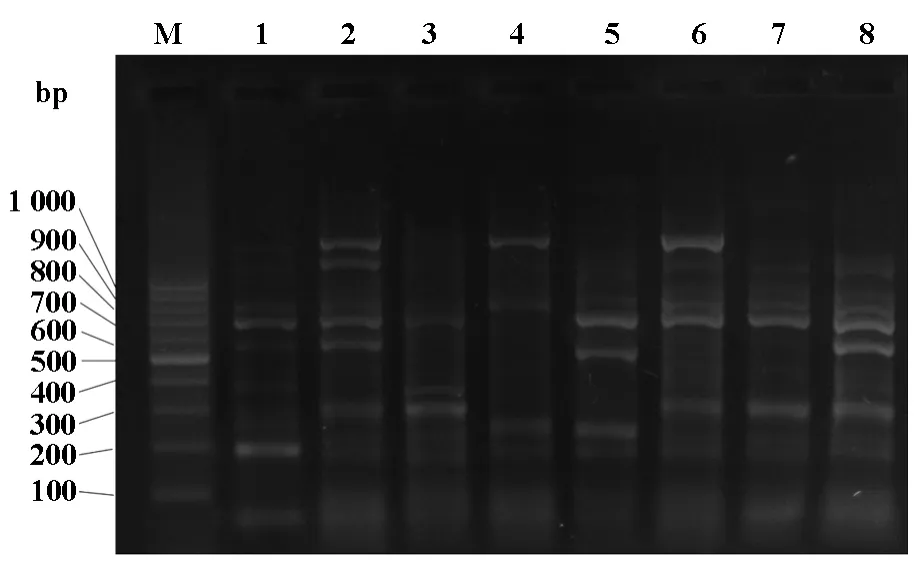
图1 鲍曼不动杆菌基因分型
2.3 β-内酰胺酶基因检测结果 50株鲍曼不动杆菌β-内酰胺酶的基因型分布为 TEM-1阳性率100%(50/50),AmpC阳性率92%(46/50),0XA-24阳性率62%(31/50),0XA-23阳性率42%(21/50),IMP阳性率14%(7/50)。随机选择10株鲍曼不动杆菌PCR产物进行测序,其结果在国际互联网上进行BLAST检索分析,基因测序结果与GenBank序列完全一致,同源性符合率为99~100%。PCR基因扩增结果见图2。
2.4 药敏结果与β-内酰胺酶基因型分布比较 本组细菌多数对头孢类抗生素及β-内酰胺类复合制剂耐药,其耐药基因有多种基因组合方式,以TEM-1+ AmpC+0XA-24阳性为最常见,共29株,占58%,该组细菌对第三、四代头孢类抗生素、β-内酰胺类复合制剂及碳青酶烯类抗生素部分耐药,有12株的基因组合为 TEM-1+ AmpC +0XA-24+0XA-23阳性,占24%,该组细菌对头孢类抗生素、β-内酰胺类复合制剂及碳青酶烯类抗生素均耐药,只有2株菌同时携带5种耐药基因,这2株菌除粘菌素B外全部耐药。
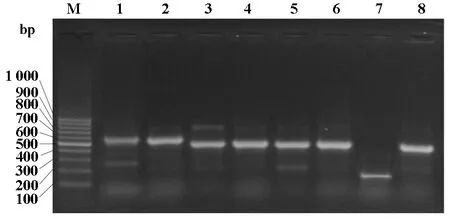
图2 β-内酰胺酶基因PCR基因扩增图谱
3 讨论
鲍曼不动杆菌是医院感染中较为常见的病原菌之一,它可引起多种医院感染,包括呼吸道感染、败血症、外伤创面感染、脑膜炎、尿路感染和呼吸机相关性肺炎等,由鲍曼不动杆菌感染导致的病死率呈上升趋势,主要是因为鲍曼不动杆菌常常是多重耐药,甚至泛耐药,给治疗带来极大困难。我们从收集的50株鲍曼不动杆菌临床资料上看,主要来源于ICU,标本种类为痰,说明我院的鲍曼不动杆菌主要引起呼吸系统感染。其在ICU分离率较高,这可能与ICU的病人大多有严重的基础疾病,住院时间较长,免疫力低且长期大量使用广谱抗生素和接受各种插管及呼吸机辅助治疗,发生感染的机会增加。ICU发生院内感染率为其它科室的5-10倍,感染耐药菌的机会高2-3倍[8]。本研究结果显示,50株鲍曼不动杆菌对头孢菌素类抗生素高度耐药,对哌拉西林/他唑巴坦、亚胺培南、美洛培南等也有较高耐药率,均达60%以上。有文献报道[9],目前治疗耐碳青霉烯类的鲍曼不动杆菌感染可选抗生素极为有限,国外经验用舒巴坦或氨苄西林/舒巴坦、头孢哌酮/舒巴坦及莫西沙星治疗,由于BD公司Phoenix-100型全自动细菌鉴定药敏分析系统没有头孢哌酮/舒巴坦药物,此50株鲍曼不动杆菌对头孢哌酮/舒巴坦耐药率是否与我们的氨苄西林/舒巴坦相当,我们将对此作进一步研究。
鲍曼不动杆菌的耐药机制非常复杂,其中以产生β-内酰胺酶为主要机制。细菌产生β-内酰胺酶,破坏抗菌药物β-内酰胺环,使抗菌药物失去活性从而对不同类的β-内酰胺类和碳青霉烯类药物耐药。β-内酰胺酶包括超广谱β-内酰胺酶(TEM-1)、头孢菌素酶(AmpC)、金属酶(IMP)和D类OXA碳青霉烯酶(0XA-24、0XA-23)。从本研究结果来看,鲍曼不动杆菌不仅具有多重耐药性,而且IEM-1、0XA-24、AmpC等β-内酰胺酶基因携带率高,50株鲍曼不动杆菌均检出β-内酰胺酶基因,并且同一菌株携带多种耐药基因可能是导致本地区鲍曼不动杆菌对β-内酰胺类及碳青霉烯类抗生素耐药率高的重要原因之一。
本研究显示存在菌株克隆传播,占分析菌株总数最多的B型共34株,分布于ICU、脑外科,普外科,呼吸内科,该菌株为主要的流行株,且分离于不同时间,不同患者,本院是一所大型综合性教学医院,见习生、实习生、进修生等轮转科室的医护人员,或转科治疗的患者等流动人员均有传播病原菌的可能。
值得一提的是,此次研究的50株鲍氏不动杆菌中有24株是“全耐株”鲍曼不动杆菌,即“泛耐药株”,泛耐药株指除多粘菌素B外,对临床常用抗菌药物全部耐药的菌株,几乎无药可治[10]。需注意跟踪监测,如何控制这些泛耐药菌株的产生与扩散,必将成为新的重大课。尽管试验显示多粘菌素B有良好的体外抗菌活性,但是多粘菌素B具有较大的肾毒性和神经毒性,多重或泛耐药鲍曼不动杆菌感染促使多粘菌素B已可能作为治疗的最后药物选择,令人担忧的是耐多粘菌素B鲍曼不动杆菌流行克隆株或新耐药株已有报道[11]。为防止和抑制多重耐药鲍曼不动杆菌株的增加,临床上应加强对该类菌株的耐药性监测,治疗由多重耐药鲍曼不动杆菌引起的感染时,应高度重视与微生物室保持联系和沟通,根据药敏结果有针对性地选择抗菌药物,减少盲目用药,并应加强消毒隔离管理制度,防止耐药菌株的传播与流行,保护抗生素资源,做到合理用药,提高治疗疾病的水平。并且同时应加强抗菌药物的监管,因此卫生部制定的《抗菌药物临床应用指导原则》是很有必要的,它对抗生素的合理应用及控制耐药株的产生定会起到重要的作用。
[1]Guenthner SH,Hendly JO,Wenzel RP.Gran-negative bacilli as nontransient flora on the hands of hospital personne[J].J Clin Microbiol,1987,25(3):488.
[2]Corbella X,Montero A,Pujol M,et al.Emergence and rapid spread of carbapenem resistance during a large and sustained hospital outbreak of multiresistant Acinetobacter baumannii[J].J Clin Microbiol,2000,38(11):4086.
[3]Nemec A,Krizova L,Maixnerova M,et al.Emergence of carbapenem resistance in Acinetobacter baumannii in the Czech Republic is associated with the spread of multidrug-resistant strains of European cloneⅡ[J].J Antimicrob Chemother,2008,62(3):484-489.
[4]Ayalew K,Nambiar S,Yasinskaya Y,et al.Carbapenems in pediatrics[J].Ther Drug Monitor,2003,25(5):593.
[5]Zarrilli R,Ciannouli M,Tomasone F,et al.Carbapenem resistance in Acinetobacter baumannii:the molecular epidemic features of an emerging problem in health care facilities[J].J Infect Dev Ctries,2009,3(5):335.
[6]Guifang Wei,Li Pan,Huimin Du et al.ERIC-PCR fingerprintingbased community DNA hybridization topinpoint genome-specific fragments as molecular markers to identify and track populations common to healthy human guts[J].Journal of Microbiological Methods,2004,59:91.
[7]王 敏,王姝姝,姚 迪,等.鲍曼不动杆菌临床分离株表型、基因型和耐药基因的对比研究[J].中华微生物和免疫学杂志,2010,30(9):821.
[8]李 蓉,李文林,石小于,等.ICU常见病原菌及鲍曼不动杆菌质粒上耐药基因的研究[J].中国抗生素杂志,2008,33(6):375.
[9]徐英春,王 贺,孙宏莉,等,细菌耐药监测让我们走近临床[J].中华检验医学杂志,2007,30(5):485.
[10]王 朔,曹照明,张克霞,等.重症监护病房鲍氏不动杆菌耐药性分析[J].现代检验医学杂志,2010,25(5):121.
[11]凌保东.鲍曼不动杆菌抗生素多重耐药性:耐药机制与感染治疗对策[J].中国抗生素杂志,2010,35(4):241.
