微载体灌注培养Marc-145细胞制备猪繁殖与呼吸综合征疫苗
2013-10-09漆世华秦红刚谢红玲温文生吴玉石
杨 雷,李 伟,漆世华,秦红刚,韩 兴,谢红玲,温文生,吴玉石
(武汉中博生物股份有限公司,武汉 430070)
猪繁殖与呼吸综合征(Porcine Reproductive and Respiratory Syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种严重危害养猪业的传染病[1]。该病于 1987年最早发现于美国[2]。1991年,荷兰中央兽医研究所确定该病的病原是一种新的RNA病毒,并命名为Lelystad病毒[3-4]。1996 年郭 宝清 等[5]首 次 从 国 内疑 似PRRS感染猪群中分离出PRRSV,从而证实了本病在我国的存在。2006年4月[6]我国猪群暴发了高致病性繁殖与呼吸综合征,高致病性猪繁殖与呼吸综合征是由高度变异的PRRSV引起的猪的烈性传染病,是我国新出现的重大动物疫病,已成为当前危害我国养猪业的主要疾病之一。
我国目前控制PRRS的主要方法是使用疫苗进行免疫预防,高滴度的病毒液是疫苗生产中非常重要的一个环节。目前国内Marc-145细胞制备PRRS疫苗均采用转瓶生产工艺,由于存在瓶与瓶之间细胞密度不整齐、劳动强度大、生产成本高,且操作过程易污染等缺点,自2012年2月1日起,农业部已停止受理转瓶培养生产方式的的兽用细胞苗生产线项目兽药GMP验收申请。因此,传统转瓶工艺的应用必将越来越受到限制。自20世纪60年代微载体生物反应器培养技术建立以来,国外许多国家对其在疫苗生产中的应用进行了广泛研究,细胞悬浮培养已是当前国际上生物制品生产的主流模式[7]。在国内利用生物反应器生产口蹄疫病毒,其抗原含量比转瓶培养提高10倍以上,疫苗的不良反应得到进一步改善[8]。利用生物反应器微载体培养Marc-145细胞繁殖PRRSV具有许多优点,例如提高生产能力,减少对劳动力的需求,降低污染的风险,同时通过灌注培养不断更换培养基,提供充足的营养成分且带走代谢产物,优化细胞培养环境,大大提高了细胞的生长密度,从而可以获得较大量高滴度的PRRSV。本实验对生物反应器灌注培养技术应用于PRRS疫苗生产作了进一步研究,取得了很好的效果。
1 材料与方法
1.1 细胞 病毒培养用Marc-145细胞来源于中国兽医药品监察所,将该细胞连续传30代进行致肿瘤实验,其结果为阴性。细胞培养液为含8%胎牛血清的细胞培养基DMEM(清大天一,批号110405)。
1.2 毒种 生产用毒种为PRRSV PC弱毒株,由中国兽医药品监察所和中博生物股份有限公司构建的基因工程疫苗株,病毒维持液为含1%胎牛血清的细胞培养基DMEM。攻毒用毒株为PRRSV GD第5代毒株,由中国兽医药品监察所分离鉴定并提供。
1.3 微载体 微载体为Cytodex-1(Pharmacia)。Cytodex-1水化处理方法是用无钙镁离子的PBS溶液洗涤2次,37℃浸泡2 h,121℃高压灭菌30 min,置4℃贮存待用,使用前用细胞培养液洗涤2次。
1.4 生物反应器细胞培养 分别用1×104/mL和1×105/mL浓度的Marc-145细胞接种于NBS310型生物反应器中进行微载体培养。培养体积10 L,微载体浓度10 g/L,控制pH在7.2,温度为37℃,溶解氧(DO)值设为50,搅拌速度为30~50 r/min。培养细胞过程中监测葡萄糖含量,每天取样检测细胞数量,根据葡萄糖的消耗量和细胞生长情况调节灌注速度。
1.5 疫苗制备 细胞培养至一定密度后,开始灌注维持液,当灌注2个工作体积后接种病毒,停止灌注,进行病毒吸附,2~3 h后开始灌流收获病毒液,每天取样测定病毒滴度。在测定的病毒含量大于106.0TCID50/mL病毒液中加入适量的冻干保护剂,经冷冻干燥制备试验疫苗,进行质量检验。
1.6 病毒含量测定 将不同时间段收获的病毒液用无血清DMEM细胞培养液作10倍系列稀释,取10-3、10-4、10-5、10-64 个稀释度,分别接种已长成良好单层、弃去细胞培养液的96孔Marc-145细胞培养板,每个稀释度接种6孔,每孔0.1 mL,同时设正常细胞对照组。置37℃、5%CO2培养箱中吸附1 h,每孔补加含4%胎牛血清的细胞培养液0.1 mL,置37℃、5%CO2培养箱中培养观察5 d,根据Reed-Muench法计算TCID50。
1.7 效力测定 将悬浮培养的3批PRRSPC株病毒液制备成活疫苗,每批分别免疫28日龄PRRS抗原抗体双阴健康仔猪5头,免疫剂量1头份(每头份病毒含量≥105.0TCID50),颈部肌肉注射,免疫28 d后连同未免疫对照猪一起,用PRRSV GD第5代毒株105.0TCID50/mL攻毒,颈部肌肉注射3 mL/头猪,效力检验结果以攻毒后临床观察及体温测定结果,21 d后剖检肺部出现的实质性病理变化或死亡等指标为发病判定标准,计算保护率。
2 结果
2.1 不同细胞接种浓度对细胞培养的影响 分别用1×104/mL和1×105/mL的细胞浓度接种反应器,观察发现,在接种6 h后,90%细胞贴附上微载体,并开始伸展;第2天后细胞生长速度增快。随着细胞增殖速度增加,灌注量也随之适当增加,在本实验灌注培养条件下,细胞的形态一直保持较好。
以1×105/mL细胞浓度接种反应器,培养至第4天细胞密度达6×106~7×106/mL,细胞状态稳定,维持时间长,利于病毒生产;而以接种细胞浓度为1×104/mL接种反应器后,培养至第6天密度才能达到高峰,但仍有部分微载体上未长满或仅有几个细胞贴壁,甚至出现空球,由于细胞培养时间过长,不利于病毒生产。细胞增殖曲线见图1。
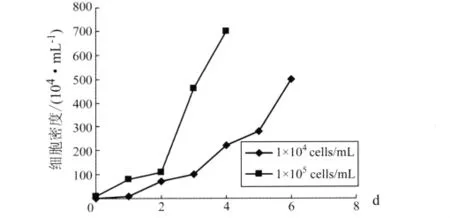
图1 不同细胞接种量的细胞增殖曲线
2.2 病毒感染复数对毒价的影响 以1×105/mL细胞密度接种反应器,于第4天细胞密度达7×106/mL左右时接种病毒,接种前换用维持液,当灌注2个工作体积后接种病毒。病毒感染复数分别为0.01和0.001,取样测定毒价后发现,毒价高峰出现在第3~4天,以后逐渐下降。两种感染复数的毒价差别不显著,0.01MOI的毒价整体水平略高于0.001MOI,且毒价高峰较早于后者,结果见图2。
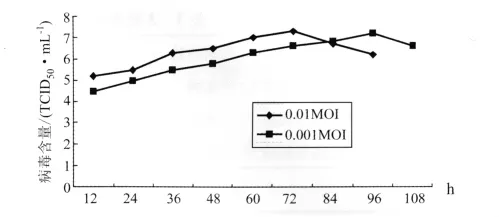
图2 不同感染复数的病毒增殖曲线
2.3 灌流体积 培养细胞过程中每天监测培养液中葡萄糖含量及检测细胞数量,根据葡萄糖的消耗量和细胞生长情况调节灌注速度,灌注速率为0~3个工作体积/d,接种病毒后,调节灌注速度和收获速度,在整个细胞培养过程中控制葡萄糖含量在5 mmol/L左右。整个培养过程中灌注速度和葡萄糖含量测定结果见表1。
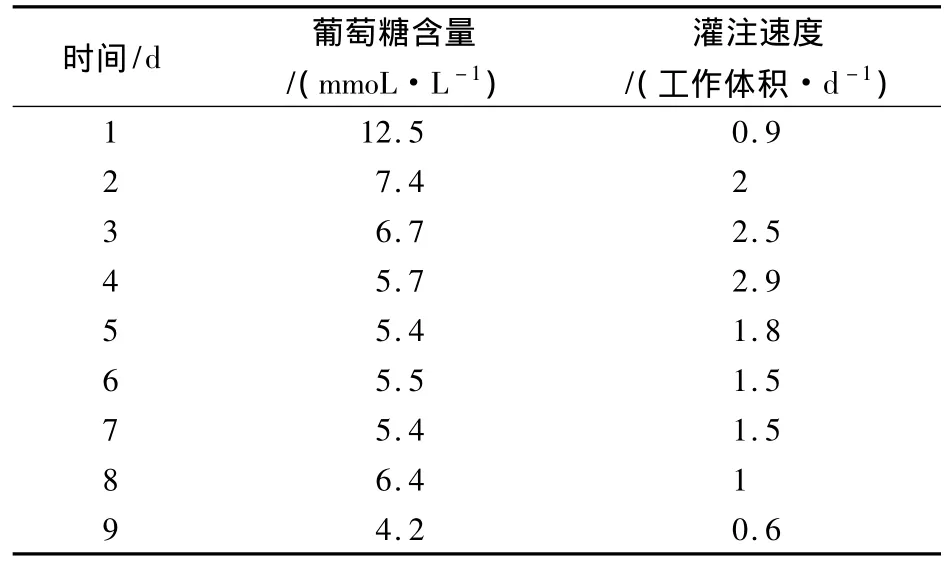
表1 灌注速度和葡萄糖含量测定结果
2.4 病毒含量测定 以1×105/mL细胞密度接种反应器,将细胞培养至7×106/mL左右时接种病毒,接种前换用维持液,当灌注2个工作体积后以感染复数为0.01接种病毒,于感染每12 h为时间段取样测定收获病毒的含量,结果见表2。

表2 不同时间段收获的病毒含量测定
从测定的结果可以看出在感染后36 h内收获的病毒含量低于106.0TCID50/mL,感染后96 h细胞完全病变,停止收获病毒液。将收获的病毒含量≥106.0TCID50/mL的病毒液用于配苗。
2.5 疫苗制备及质量 以1×105/mL细胞密度接种反应器,将细胞培养至7×106/mL左右时接种病毒,感染复数为0.01,于感染后36 h开始收获,至96 h后停止灌流。将收获的病毒含量大于106.0TCID50/mL病毒液进行冻融后加入冻干保护剂经冷冻干燥制成疫苗。将制备的3批疫苗进行无菌、支原体、外源病毒、病毒含量、安全、效力、剩余水分和真空度等检验,检测结果见表3。疫苗的免疫效力测定结果见表4。结果表明,3批疫苗的免疫保护率均为5/5,而对照组5/5发病,表明按本工艺制备的疫苗其免疫原性没有发生变化,疫苗质量稳定。

表3 3批猪繁殖与呼吸综合征活疫苗的质量检验结果
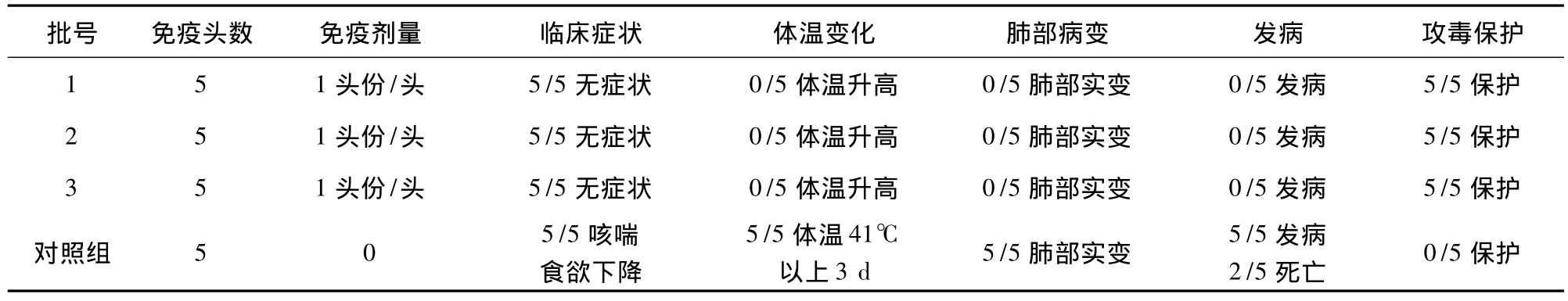
表4 3批猪繁殖与呼吸综合征活疫苗的免疫效力攻毒试验结果
3 讨论
疫苗开发是一个不断创新的过程,目前国内兽用疫苗的生产多采用转瓶生产工艺,由于受到转瓶表面积和培养条件的限制,细胞密度低,劳动强度大,操作过程易污染,传统的转瓶生产工艺在新的疫苗生产中越来越受限。微载体培养技术的出现彻底克服了传统工艺表面积不足的限制,能在有限的空间内提供巨大的表面积,实现了培养操作的自动化控制,降低了污染的机会和减少了人力的投入,并且细胞在良好的生理状态下生长,可以获得高密度贴壁细胞,因此具有现代化大规模培养贴壁细胞的显著优势。
本文研究的PRRS活疫苗生产工艺采用的灌注培养法,营养物质不断补充,代谢产物不断去除,使细胞处于一种稳定的营养状态,大大提高了细胞密度。通过调节灌注流量,不仅在细胞增殖时稳定培养环境,而且在接种病毒后细胞仍能得到足够的营养和平衡的环境。本项实验显示,在14 L生物反应器中细胞接种量在105/mL左右时,细胞生长4 d后密度可达7×106/mL左右,以0.01MOI感染病毒,接毒 36 h后收获病毒液,其毒价在 106.0TCID50/mL以上。细胞增殖培养过程中,随着细胞数量的增大,灌注速度加快;接种病毒后,由于细胞被感染和部分老化脱落,代谢速度减缓,需逐步降低灌注速度,在整个培养过程中每天调节灌注速度使培养液中的葡萄糖浓度维持在5 mmol/L左右。将收获的病毒液加入适量的冻干保护剂经冷冻干燥制成活疫苗,试制的3批疫苗的病毒含量分别为106.8TCID50/mL、107.0TCID50/mL 和 107.0TCID50/mL,无菌、支原体等项目的检验均合格,3批疫苗的免疫保护率均为5/5。研究表明,生物反应器灌注培养Marc-145细胞法可用于PRRS活疫苗的生产,适合大规模工业化生产,有较好的应用前景。
[1] Meulenberg J.PRRSV,the virus[J].Vet Res,2000,31(1):11 -21.
[2] Keffaber K K.Reproductive failureofunknown etiology[J].American Association of Swine Practitioners(News),1989,1:1 -10.
[3] Terpstra C,Wensvoort G,Pol JM A.Experimental reproduction of porcine epidemic abortion and respiratory syndrome(mystery swine disease)by infection with Lelystad virus:Koch’s postulates fulfilled[J].Veterinary Quarterly,1991,13(3):131 -136.
[4] Wensvoort G,Terpstra C,Pol JM,et al.Mystery swine disease in The Netherlands:the isolation of Lelystad virus[J].Veterinary Quarterly,1991,13(3):121 -130.
[5] 郭宝清,陈章水,刘文兴,等.从疑似PRRS流产胎儿分离猪繁殖与呼吸综合征病毒(PRRSV)的研究[J].中国畜禽传染病,1996,87(2):1 -5.
[6] Zhou Y J,Yu H,Tian Z J,et al.Genetic diversity of the ORF5 gene of porcine reproductive and respiratory syndrome virus isolates in China from 2006 to2008[J].Virus Research,2009,144:136-144.
[7] 张 韧,秦玉明,陈文庆,等.悬浮培养技术在生物制药中的应用和展望[J].中国兽药杂志,2011,45(3):56 -60.
[8] 李 荣,周劲松,刘国英,等.口蹄疫疫苗的悬浮培养工艺研究[J].中国兽药杂志,2011,5(7):14 -16.
