硫酸黏菌素毒性及其残留检测研究进展
2013-11-23代重山李继昌王小飞丁文建
代重山,李继昌,李 健,刘 洋,王小飞,丁文建,孙 博
(1.东北农业大学动物医学学院,哈尔滨 150030;2.Facility for Anti-infective Drug Development and Innovation,Monash Institute of Pharmaceutical Sciences Monash University,Victoria 3052,Australia)
硫酸黏菌素(colistin sulfate),也叫硫酸多黏菌素E,属多肽类抗生素,对革兰氏阴性杆菌具有较强的抗菌作用,特别是对多重耐药革兰氏阴性致病菌(如铜绿假单胞菌、鲍曼不动杆菌、克雷肺炎杆菌)有特效,具有抗内毒素作用,作为饲料添加剂还有促进动物生长作用,受到畜牧兽医工作者的广泛关注[1]。中国、美国、欧盟、日本等许多国家批准作为饲料添加剂或兽药。我国在20世纪90年代末由山东鲁抗医药集团成功研制了硫酸黏菌素原料、硫酸黏菌素可溶性粉、硫酸黏菌素预混剂,并于2002年被农业部批准为国家三类新兽药。肖希龙等[2]研制了硫酸黏菌素注射液,已广泛应用于治疗动物大肠杆菌及沙门氏菌感染。目前,黏菌素已重新被各国科学家重视,其药效学、药动学、毒理学、残留检测已被广泛研究,本文就其毒性及检测方法进行综述。
1 硫酸黏菌素的理化特性
硫酸黏菌素是一种至少含有30多种不同成分的混和物,主要成份为硫酸黏菌素A(也称多黏菌素EI)和硫酸黏菌素 B(也称多黏菌素 E2),占77%以上[3]。其结构由七环和末端的三肽组成的十肽菌素,尾部的脂肪酸通过酰胺键连接到末端的三肽,七环有亲水端和疏水端,三肽端只有亲水端。带有正电荷的氨基酸和尾部的脂肪酸使黏菌素具有兼容性,可溶于水,也可溶于脂类。它为白色或微白色粉末,无臭、味苦,有吸湿性,易溶于水,在乙醇中微溶,不溶于酯、醚、酮、氯仿等有机溶剂。化学性质较稳定,高压加热灭菌对其含量及pH影响不大[4-5]。在米糠、豆饼、淀粉等辅料中4℃存放,5年活力不变;37℃存放,活力最多只下降5%左右。硫酸黏菌素的水溶液在pH值2~6时相当稳定,在强酸及强碱中易于分解。
2 硫酸黏菌素抗菌作用及其应用
硫酸黏菌素对革兰氏阴性菌有强大的抗菌作用,在畜牧兽医领域可作为饲用抗生素使用,防止由大肠杆菌、沙门氏菌等革兰氏阴性菌引起的消化道疾病,提高幼畜、雏禽的成活率,并提高饲料转化率,促进畜禽生长[1]。硫酸黏菌素除单独使用外,还可与杆菌肽锌以1∶5的比例联用制成复合预混剂,或与活菌制剂和酶制剂配合使用[6]。可与磺胺类药物、螺旋霉素、红霉素、甲氧新霉素、土霉素配伍使用,具有较好疗效,与维生素联用做动物止泻药[7]。此外,硫酸黏菌素也可用于烧伤和外伤引起的铜绿假单胞菌局部感染和眼、耳、鼻等部位敏感菌的感染或口服使用治疗动物肠道细菌感染。随着硫酸黏菌素注射剂的开发及应用,通过静脉注射或肌肉注射方式治疗猪及禽类肠道大肠杆菌病已广泛使用[8]。
为规范其使用,减少药物乱用带来的毒副作用,WHO规定了其效价,即1 mg硫酸黏菌素相当于20500活性单位[7]。家禽日推荐剂量为3.5 mg/kg,犊牛、猪、兔子日推荐剂量为5 mg/kg。可将其添加至饮水、牛奶、饲料中,或注射用药,其中,饮水添加量每升水添加25~50 mg,每100 g全价饲料添加量为2~4 g[7]。对雏鸡注射推荐剂量为每天0.2 mg,一般 1 ~3 d[9]。
3 硫酸黏菌素在动物体内的代谢及毒副作用
3.1 体内代谢 硫酸黏菌素口服给药及局部给药均不易吸收。Sato等[10]给鸡和猪灌注50 mg/kg两个剂量,约2 h后在血浆和胆汁中达到最高浓度,分别为10.2、5.7 μg/mL 和 8.3、9.0 μg/mL;猪口服25 mg/kg硫酸黏菌素后,分别为1.0和4.0 μg/mL,具有明显的种属和剂量差异性,在肌肉和肝脏在停药后1~8 h均未检测到药物的残留,肾脏两个剂量组在停药2 h检测到微量残留但未达到可检测的水平。但肌肉注射时,吸收良好,一般在注射后0.5~1 h达到最高血药浓度,对猪注射5和2.5 mg/kg,青年牛肌肉注射2.5 mg/kg,鸭肌肉注射3.0 mg/kg时,均在30 min后血药浓度达到峰值[8,11-12];对奶牛静脉注射 5 mg/kg 硫酸黏菌素后,最高血药浓度为16 μg/mL。血药消除半衰期一般无剂量差异,约为2~6 h,治疗后血浆中无残留。硫酸黏菌素具有高剂量低分布的特点,约33% ~74%分布于细胞外液,主要经过肾脏代谢,且血药浓度与肾功能关系密切[9]。Zeng 等[8]研究发现,在鸭胸部注射3.0 mg/kg硫酸黏菌素后,在肌肉中消除半衰期最大,为29.44 h,其次为胸部注射部位肌肉(13.84 h)、肝脏(10.93 h)和肾脏(6.69 h)。
此外,由于动物血脑屏障的作用,黏菌素进入脑组织的量较少。但有研究表明,动物发生细菌感染时,给药后可使更多的药物进入脑组织,这也是黏菌素发生神经毒性的主要原因之一[13]。
3.2 毒副作用
3.2.1 急性毒性 硫酸黏菌素口服用药时毒性相对较低,小鼠口服半数致死量(LD50)为431.39 mg/kg[2],15 日龄雏鸡的口服 LD50为 20709 mg/kg[14]。当临床口服剂量过大时,可引起食欲减退、恶心、呕吐和腹泻等症状。肌肉注射或静脉注射给药药效强,但毒性相对较大,小鼠肌肉注射LD50分别为38.72 mg/kg[11]。本实验室前期研究发现,小鼠单次静脉给药半数致死量为13.52 mg/kg[15]。小鼠急性中毒症状基本相似,开始表现为运动失调,兴奋不安,后逐渐呆滞不动,此后腹式呼吸明显,全身无力、瘫痪,直至死亡[11,15]。
3.2.2 肾毒性及神经毒性 黏菌素诱发的肾毒性及神经毒性为临床的主要副作用,其中肾毒性发生率(约40% ~50%)远高于神经毒性(约7%)[16],但其毒性机制目前还不清楚。
硫酸黏菌素主要损伤肾小管上皮细胞,造成肾小管上皮细胞肿胀、坏死及凋亡。严重者导致肾小管管型结构,大面积梗死[17]。且连续给药时,黏菌素将在组织中蓄积,导致相关组织受到一定损害。研究证明,黏菌素诱发动物肾毒性可能机制如下,一方面是黏菌素可直接作用于肾脏,分子结构中D型氨基酸及其在生理条件下所携带的阳离子可与肾小管上皮细胞直接作用,即黏菌素存在的5个游离氨基可与哺乳动物细胞膜上带阴性电荷的磷酸根(PO-
4)结合,造成肾小管上皮细胞的坏死及凋亡[1,9]。另一方面认为,黏菌素脂肪酸长链结构诱发其肾脏氧化应激损伤[17-18]。课题组前期研究发现,维生素C与黏菌素联合用药,可明显降低肾毒性发生率[19-20],此外,抗氧化剂褪黑素也能明显改善肾毒性氧化应激损伤[17]。Ozyilmaz等[18]研究证实,大鼠腹腔注射黏菌素10 mg/kg,连续给药6 d,肾脏组织中丙二醛(MDA)含量显著增加,超氧化物歧化酶(SOD)显著降低,当给予抗氧化剂N-乙酰半胱氨酸时,肾组织中SOD及MDA有明显的改善,此外,肾组织中诱发型一氧化氮合酶(i-NOS)及内皮一氧化氮合成酶(e-NOS)含量均得到显著改善。
本实验室研究发现:小鼠静脉注射硫酸黏菌素7.5 mg/kg,每天2次(每次间隔12 h),连续给药7 d,结果发现,小鼠出现明显的周围神经毒性症状,坐骨神经传导速率(NCV)、动作电位显著降低,神经髓鞘及轴索发生严重变性[21]。肖希龙[11]等研究发现,给断奶仔猪肌内注射15.0 mg/kg(每天1次,连续5 d)剂量连续给药,4~5 d后有明显的神经中毒症状。然而,神经毒性机制目前尚不清楚,一般认为,黏菌素脂肪酸长链结构可能与脂类含量较高神经元相互作用而引发神经毒性,也有学者认为,黏菌素与乙酰胆碱竞争性抑制,随后引起Ca2+离子消耗,致使去极化相延长,随后导致神经症状的发生,并认为这种神经毒性的发生时可逆的[16]。
3.2.3 其他毒性 高剂量黏菌素给药后,可伴随发生一定的肝毒性,肖希龙[11]等研究证实,给断奶仔猪肌内注射注射硫酸黏菌素10 mg/kg,连续4 d后,可致肝脏发生轻微的损伤。此外,黏菌素也可对肺脏发生一定的毒性作用,Ozyilmaz等[18]研究发现,大鼠腹腔注射黏菌素10 mg/kg,连续给药6 d,肺脏发生严重的氧化应激性损伤。使用粘菌素也可出现过敏反应,如瘙痒、皮炎和药物热等,可能是由药物激活型的刺激作用和组胺释放作用所致。
4 硫酸黏菌素的残留检测方法
我国和欧盟规定的硫酸黏菌素在不同组织中最高残留限量见表1。对其进行残留检测的方法主要有微生物法、免疫分析法、毛细管电泳法、高效液相色谱法和液质联用技术等。
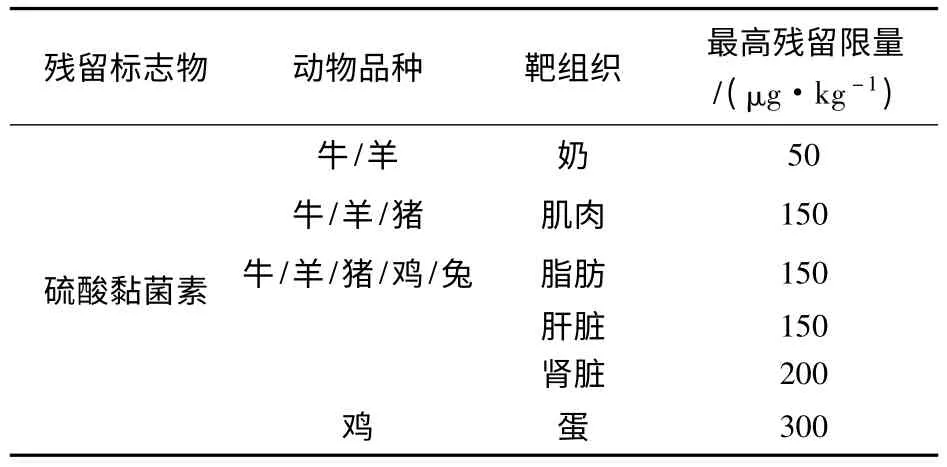
表1 硫酸黏菌素在动物性食品兽药的最高残留限量
4.1 微生物法 微生物法是多肽类抗生素残留检测中应用较广的一种检测方法,是根据抗生素对微生物生理机能和代谢的抑制作用来对样品中的药物残留进行定性或定量分析。由于其相对费用较低,一般实验室都能操作,且适合大量样品检测,故仍是各国对黏菌素的残留测定主要方法,包括杯碟法、纸片法(PD)、试纸法(STOP)等。Behera 等[22]通过多黏菌素的药敏试验检测,比较了肉汤稀释法、琼脂稀释法、E-test法、纸片扩散法,发现E-test和琼脂稀释法与肉汤稀释法显示良好的一致性,而纸片扩散法可适用于诊断实验室的初步筛选。温芳和肖希龙[23]在国内首次以支气管炎博代特氏菌(Bordetella bronchiseptica)ATCC4617作为检测菌株,用PBS提取鸡肌肉组织,用5%硫酸提取鸡肝脏和肾脏组织中的硫酸黏菌素,应用剂量法设计原理制备肌肉、肝脏和肾脏组织标准曲线。硫酸黏菌素检测限肌肉组织为0.15 μg/g,肝脏和肾脏组织均为0.20 μg/g,低于我国农业部和欧盟规定的硫酸黏菌素最高残留限量。肌肉、肝脏和肾脏组织标准曲线在0.025~6.4 μg/mL范围内线性关系良好,相关系数分别为 0.9970、0.9994、0.9990。
4.2 免疫分析法 免疫分析法有放射性免疫分析法、酶联免疫分析法(ELISA)等多种,其中ELISA法是一种以抗原与抗体的特异性、可逆性结合反应为基础的检测方法,较为常用。Kitagawa等[24]用黏菌素-蛋白质共轭物免疫兔,获得黏菌素抗体,将药物的一个氨基结合到牛血清白蛋白(BSA)的硫醇基,用N-(m-顺丁烯二酞亚胺苯甲酰)琥珀(MBS)作交联剂共扼,多黏菌素E用β-D-半乳糖苷酶标记,交联剂为N-(γ-顺丁烯二酞亚胺丁酰)琥珀,该法检测限为30.0 ng/mL,可用于检测或定量组织及食品中黏菌素。ELISA法特异性强,灵敏度高,快速简便,可准确定性、定量,已被证实,它适用于现场检测和大量样品的快速检测,是一种较理想的兽药残留筛查方法[25]。但该法抗体制备比较困难,在不能肯定样品中的兽药品种时,有一定的盲目性,易出现假阴性、假阳性现象。但ELISA法采用的试剂盒一般价格较贵,且仅能对单一兽药进行检测,使其应用范围受到了一定的限制。
4.3 HPLC法 近年来,高效液相色谱法因其选择性好、灵敏度高、速度快和操作自动化等优点已成为分析化学领域广泛应用的一种分析方法。目前,作为新型高效固定相的整体柱技术已走向实用化。整体柱是一种利用有机或无机聚合方法在色谱柱内进行原位聚合的连续床固定相,利用其进行高效液相色谱分析具有低压、高速、重现性好、选择性强等特点。丁焕中等[26]建立了硫酸黏菌素残留柱前衍生化高效液相色谱-荧光检测方法,在猪、鸡的肌肉、肝、肾组织中按 0.05、0.15、1.00 μg/g 三个添加水平做硫酸黏菌素的回收率试验,其回收率≥80%,变异系数≤12%。结果表明,该方法重复性好,灵敏度高,简便,可用于动物组织中黏菌素残留的检测。Suhren和 Knappstein[27]通过 HPLC法检测经黏菌素治疗的母牛的奶产品,最大残留限量为50 μg/kg时,回收率为106.1%,变异系数为13.6%。检测限和定量限分别为9.3和14.3 μg/kg。反相高效液相色谱法(RP-HPLC)和荧光衍生技术是多肽类抗生素检测的常用方法,Gmur等[28]则将老鼠和狗血浆中的多黏菌素E提取后进行荧光衍生,再用RP-HPLC进行分析测定,荧光检测器检测,结果表明该实验的准确度、精密度都很好,线性范围为0.05~5.00 μg/mL。
4.4 毛细管电泳法 毛细管电泳法是凝胶电泳技术的发展和HPLC的补充,具有微量、快速、高效的特点。其中,胶束电动毛细管色谱法(MECC)可同时分离分析离子型和电中性样品分子,适用于抗生素的检测。闫永娜等[29]采用MECC对黏菌素中的主要成分多黏菌素E1和E2进行了分离,并测定了多黏菌素E1、E2的含量,且分别考察了电泳电压、表面活性剂种类、Brij-35(月桂醇聚氧乙烯醚)浓度、乙腈含量、磷酸盐缓冲液的pH值、氯化钠浓度等实验参数对实验结果的影响,从而确定了最佳的分离条件,使得E1和E2得到了较好的分离,分离度达到1.94。以多黏菌素E1为例,柱效和峰面积的日间及日内测定的相对标准偏差(RSD)均小于5%。故该方法简便、快速、准确、重现性好。
4.5 液质(LC-MS)联用技术 质谱作为高效液相色谱的高端检测器,可以较好地给出待测物质的定性分析结果,所以LC-MS技术既具备色谱高效分离的优点,又具有质谱可以准确鉴定化合物结构的特点,可同时达到定性、定量的检测目的,而且所需样品量少,灵敏度高,快速准确,特别适用于兽药残留分析研究中的确证性分析,目前,该方法为我国进出口动物源性动物源性食品中硫黏菌素残留量检测的主要应用方法,能方便地对纳克级的兽药残留组分进行检测与结构确证。Van den Bossche等[30]利用LC-MS法鉴别了混有多黏菌素B和多黏菌素E的牛奶样品,可将其分离出39个峰值,并确定30多种成分的含量。Sin等[31]以多黏菌素B为内标物,用LC-MS/MS法分析了牛奶、动物组织样品中杆菌肽、黏菌素主要成分的残留量,牛奶经三氯乙酸去蛋白质并离心净化,动物组织则借助SPE技术净化,二者净化后的样品液进一步经RP-HPLC分离后,在多反应监测(MRM)模式下进行质谱扫描。杆菌肽A、黏菌素的检测低限分别为100和50 μg/kg,所有样品日间(n=7)和日内(n=4)回收率范围分别为89.12% ~110%(RSD<10%)和90.14% ~112%(RSD<13%)。林维宣等[32]选用牛奶为研究对象,建立了一种可同时测定多黏菌素B、黏菌素、杆菌肽和维吉尼霉素等4种多肽类抗生素残留量的液相色谱-串联质谱法(LC-MS/MS)检测方法,样品经甲醇 -0.1%甲酸体系提取,正己烷脱脂,固相萃取柱净化后,利用LC-MS/MS进行定性和定量分析。其中黏菌素检出限为25 μg/kg,回收率为92.24% ~97.87%,效果较好。
5 结语
硫酸黏菌素具有强大的抗革兰氏阴性细菌作用,口服给药时,毒性较小;其静脉或肌肉注射已应用于临床,但肾毒性及神经毒性阻碍其广泛应用。硫酸黏菌素残留检测方法,主要包括微生物法、免疫分析法、毛细管电泳法、HPLC和LC-MS技术等。毛细管电泳法及LC-MS技术检测精密度较高,已受到广泛关注。先前的研究表明,硫酸黏菌素口服饲喂后,吸收较少,残留量较低。但是,在黏菌素作为注射剂治疗畜禽细菌传染病的新时期,相关药动学及其残留检测却研究的较少,可能会增加其毒性及耐药性的发生率,亟待进一步研究。
[1]陈杖榴,朱蓓蕾,佟恒敏,等.兽药药理学[M].北京:中国农业出版社,2002:225-226.
[2]肖希龙,林 斌,张纯萍.硫酸多粘菌素E注射液的制备方法:中国,CN1344564[P].2002-04-17.
[3]Sweetman S(ed).Martindale:The complete drug reference[M].Pharmaceutical Press,Electronic Version,London.2006.
[4]Falagas M E,Kasiakou1 S K.Colistin:the revival of polymyxins for the management of multidrug-resistant gram-negative bacterial infections[J].Clin Infect Dis,2005,40:1333-1341.
[5]周 艳,方 静,李英伦.粘杆菌素研究及其应用[J].中国饲料,2006,16:15-17
[6]王 斌,刘建军.硫酸粘杆菌素、活菌制剂及酶制剂对仔猪生长的影响[J].动物科学与动物医学,2003,20(8):51-52.
[7]FAO/WHO.Colistin:Residue evaluation of certain veterinary drugs[R].Joint FAO/WHO Expert Committee on Food Additives,66th meeting 2006:6-34.
[8]Zeng Z,Wu J,Yang G,Chen Z,et al.Study of colistin depletion in duck tissues after intramuscular and oral administration[J].J Vet Pharmacol Ther,2010,33(4):408-410.
[9]US Food and Drug Administration(FDA).Freedom of information summary,NADA,141-069.1998[EB/OL].[2012-05-30].http://www.betterchem.con/vet/cvm_foi/section2/141069011 398.html.
[10]Sato H,Ouchi M,and Koumi J.Studies on the distribution of colistin sulfate in the body.Distribution and change with time in chickens and pigs by oral administration[J].Japanese J Antibio(translation),1972,25:239-245.
[11]肖希龙,林 斌,张纯萍.硫酸多粘菌素E注射液及其药物动力学研究[J].中国农业科学,2003,36(3):329-335.
[12]Sato H,Ouchi M,Koumi J.Studies on the distribution of colistin sulfate in the body.Distribution and change with time in chickens and pigs by oral administration[J].Japanese J Antibio(translation),1972,25,239-245.
[13]Jin L,Li J,Nation R L,et al.Impact of p-glycoprotein inhibition and lipopolysaccharide administration on blood-brain barrier transport of colistin in mice[J].Antimicrob Agents Chemother,2011,55(2):502-507.
[14]张德显.硫酸多黏菌素E致鸡神经毒性及机制的研究[D].哈尔滨:东北农业大学,2011.
[15]林 巍.硫酸黏菌素致小鼠神经毒性初探及其毒代动力学研究[D].哈尔滨:东北农业大学,2012.
[16]Falagas M E,Kasiakou S K.Toxicity of polymyxins:A systematic review of the evidence from old and recent studies[J].Crit Care,2006,10:R27.
[17]Yousef J M,Chen G,Hill P A,et al.Melatonin attenuates colistin-induced nephrotoxicity in rats[J].Antimicrob Agents Chemother,2011,55(9):4044-449.
[18]Ozyilmaz E,Ebinc F A,Derici U,et al.Could nephrotoxicity due to colistin be ameliorated with the use of N-acetylcysteine?[J].Intensive Care Med,2011,37(1):141-146.
[19]Yousef J M,Chen G,Hill P A,et al.Ascorbic acid protects against the nephrotoxicity and apoptosis caused by colistin and affects its pharmacokinetics[J].J Antimicrob Chemother,2012,67(2):452-459.
[20]代重山,李继昌,林 巍,等.黏菌素神经毒性的研究进展[J].中国兽药杂志,2012,46(5):54-57.
[21]Dai C,Li J,Lin W,et al.Electrophysiology and ultrastructural changes in mouse sciatic nerve associated with colistin sulfate exposure[J].Toxicol Mech Methods,2012,earlyonline:1-5.
[22]Behera B,Mathur P,Das A,et al.Evaluation of susceptibility testing methods for polymyxin[J].Int J Infect Dis,2010,14(7):e596-601.
[23]温 芳,肖希龙.鸡组织中硫酸粘杆菌素残留的微生物学检测方法研究[J].中国兽药杂志,2006,(40):29-33
[24]Kitagawa T,Ohtani W,Maeno Y,et al.Sensitive enzyme immunoassay of colistin and its application to detect residual colistin in rainbow trout tissue[J].J Assoc Off Anal Chem,1985,68:661-664.
[25]李俊锁,丘月明,王 超.兽药残留分析[M].上海:上海科学技术出版社,2000:473-474.
[26]丁焕中,吴洁珊,武 力,等.动物组织黏菌素残留柱前衍生化高效液相色谱-荧光检测方法的建立[J].中国兽医科学,2009,39(5):461-464
[27]Suhren G,Knappstein K.Detection of colistin in spiked and incurred milk samples by LC-and ELISA-technique[J].Analytica Chimica Acta,2005,529:97-101
[28]Gmur D J,Bredl C R,Steele S J,et al.Determination of polymyxin E1 in rat plasma by high performance liquid chromatography[J].J Chromatogr B Analyt Technol Biomed Life Sci,2003,789:365-372.
[29]闫永娜,王利娟,杨更亮,等.胶束电动毛细管色谱法测定硫酸多粘菌素E药物中的多粘菌素E1和E2[J].色谱,2009,27(6):860-863
[30]Van den Bossche L,Van Schepdael A,Chopra S,et al.Identification of impurities in polymyxin B and colistin bulk sample using liquid chromatography coupled to mass spectrometry[J].Talanta,2011,83(5):1521-1529
[31]Sin D W M,Ho C,Wong Y C,et al.Analysis of major components of residual bacitracin and colistin in food samples by liquid chromatography tandem mass spectrometry[J].Analytica Chimica Acta,2005,535:23-31
[32]林维宣,孙兴权,田 苗,等.液相色谱-串联质谱法检测牛乳中多肽类抗生素残留量[J].中国乳品工业,2009,37(3):46-48.
