放射性肺损伤大鼠的数字化基因表达谱分析
2013-10-08王炳胜刘秀芳
刘 欣,王炳胜,刘秀芳
数字化基因表达谱(digital gene expression profile)是利用新一代高通量测序和高性能的计算机分析技术,全面、经济、快速地检测某一特定组织在特定状态下的基因表达情况,这一技术已被广泛应用于疾病发病机制研究、药物研发等领域。放射性肺损伤是指胸部肿瘤患者在接受放射治疗的过程中,正常肺组织因受到一定剂量放射线的照射而造成的不同程度的损伤,临床表现为早期急性放射性肺炎和晚期肺纤维化,发生率为 16.3%~50.7%[1],严重影响患者的生活质量。放射性肺炎常发生在放疗结束后1~3个月,临床表现为发热、干咳、少痰、胸闷、胸痛等。严重者表现为高热、剧烈咳嗽、咯血痰、呼吸困难,不能平卧,甚至发生急性呼吸衰竭而导致病人死亡。放射性肺纤维化多发生于治疗结束后3~6个月,表现为慢性呼吸衰竭等一系列相应症状和体征。放射性肺损伤一旦发展到纤维化阶段,几乎不可逆转,是限制放疗疗效的一个重要因素。多数学者认为放射性肺损伤的发生和肿瘤坏死因子、白介素等细胞因子级联反应有密切的关系[2],但其分子生物学机制尚未明确。本实验通过小剂量多次照射大鼠制造放射性肺损伤模型,用数字化基因表达谱分析放射性肺损伤发生时肺组织的差异表达基因,以寻找放射性肺损伤发生过程中的关键基因,为临床靶向治疗提供新的思路及理论依据。
1 材料与方法
1.1 实验动物 健康雌性成年Wistar大鼠20只,体质量(200±20)g,合格证号:0172808。购自华阜康生物科技股份有限公司,分笼饲养。在SPF级实验室正常饲养3 d,无异常者入组实验。将20只实验大鼠随机分为单纯照射组(模型组)10只、空白对照组(对照组)10只。
1.2 主要试剂及仪器 Illumina Gene Expression Sample Prep Kit和Illumina测序芯片,Illumina Cluster Station和Illumina HiSeqTM2000系统均购于Illumina公司;6MV-X线直线加速器购于上海高科技放疗设备有限公司。
1.3 方法
1.3.1 动物造模:模型组均采用6MV-X直线加速器照射右肺,照射前均使用0.4%戊巴比妥钠10 ml/kg腹腔麻醉,俯卧于平台,模拟机下定位,铅块遮挡左肺及纵隔,照射野面积3 cm×3 cm,每次5 Gy,每周1次,总剂量30 Gy。对照组只进行麻醉,不予照射。
1.3.2 取材:于首次照射模型大鼠开始计时,两组均于第6、12周末各随机抽取5只大鼠,用0.4%戊巴比妥钠10 ml/kg腹腔麻醉后立即开胸取右肺组织,保存于-80℃冰箱备用。
1.3.3 数字化基因表达谱信息分析流程
1.3.3.1 Tag的制备:提取 6 μl总 mRNA,利用Oligo(dT)磁珠吸附纯化mRNA,并以Oligo(dT)引导反转录合成双链cDNA。采用四碱基识别酶NlaⅢ,识别并切断cDNA上的CATG位点,利用磁珠沉淀纯化带有cDNA 3'端的片段,将其5'末端连接Illumina接头1。利用MmeI酶切CATG位点下游17 bp处,通过磁珠沉淀去除3'片段后,在Tag 3'末端连接Illumina接头2,从而获得两端连有不同接头序列的21 bp标签library。经过15个循环的PCR线性扩增后,通过6%TBE PAGE胶电泳纯化95碱基条带,解链后,单链分子被加到Illumina测序芯片上并固定,每条分子经过原位扩增成为一个单分子簇测序模板,加入4色荧光标记的4种核苷酸,采用边合成边测序法测序。测序得到的原始图像数据通过荧光信号读取碱基的方法转化为序列数据,称为原始Tag。
1.3.3.2 Tag的纯化:原始序列带有一段3'adaptor序列,并且含有少量低质量序列以及各种杂质成分。经过一系列数据处理,得到纯化的Tag。
1.3.3.3 基因表达的注释:经过测序质量评估、测序饱和度分析、实验重复性分析、纯化Tag拷贝数分布统计、纯化Tag比对统计等一系列处理后对基因表达进行注释[3]。
1.3.3.4 差异基因的筛选:参照Audic等[4]的数字化基因表达谱差异基因检测方法,开发了严格的算法筛选两样本间的差异表达基因。在本研究中,差异表达基因定义为假阳性率≤0.005且差异倍数在2倍以上(即Log2Ratio≥1)的基因。
1.3.3.5 确定差异表达基因行使的主要生物学功能:通过基因本体(gene ontology,GO)功能显著性富集分析、差异基因表达模式聚类分析等一系列后续处理后得出结果,确定差异表达基因行使的主要生物学功能。
2 结果
第6周末,模型组相比对照组的差异表达基因有1050个,其中上调基因为669个,下调基因为381个;根据特定规则找出显著富集的GO条目,发现这些基因主要和细胞代谢过程相关。通过差异基因表达模式聚类分析显示,上调基因主要与DNA链断裂、细胞凋亡、特异性炎症有关,下调基因主要与DNA/RNA合成代谢、细胞分裂有关,筛选出的差异表达基因见表1。
第12周末,模型组相比对照组的差异表达基因有2050个,其中上调基因为833个,下调基因有1271个。找出显著富集的GO条目,发现这些基因主要和应激反应、免疫过程有关。差异基因表达模式聚类分析结果显示,上调基因主要与炎症因子、细胞凋亡、DNA损伤修复、纤维化相关,下调基因主要与DNA/RNA合成代谢、细胞分裂有关。筛选出的差异表达基因见表2。
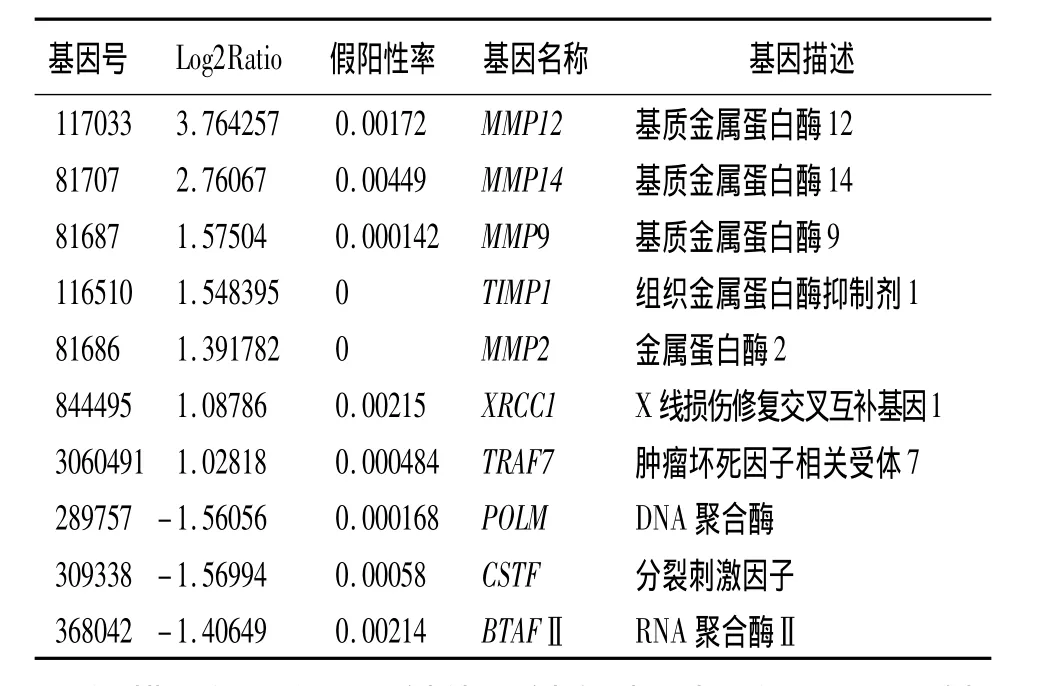
表1 实验大鼠第6周末模型组对比对照组差异表达基因
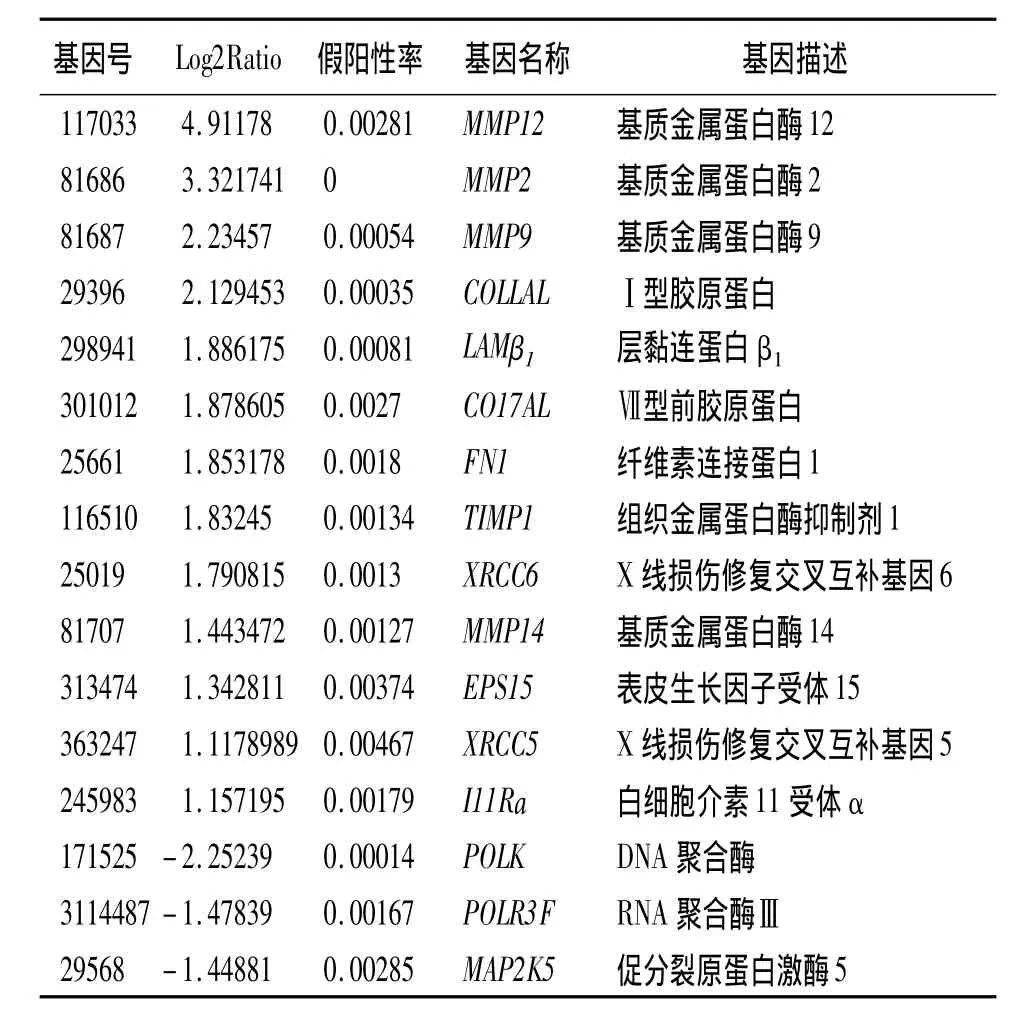
表2 实验大鼠第12周末模型组对比对照组差异表达基因
3 讨论
放射性肺损伤主要分为早期放射性肺炎和晚期放射性肺纤维化,早期放射性肺炎主要发生于放疗后的1~3个月,放射性肺纤维化主要发生于放疗后的3~6个月[5-8]。本实验采用小剂量分次照射大鼠右肺,类似于临床胸部肿瘤患者的放疗方式,检测时间定在照射开始后第6、12周末,可分别观察早期放射性肺炎及晚期放射性肺纤维化发生初期时的差异表达基因。
DNA是电离辐射主要的靶分子之一,在细胞辐射损伤中发挥重要的作用。DNA链断裂是细胞辐射损伤的重要形式,DNA双链断裂可造成细胞致死性损伤[3]。研究表明,即使是低剂量的X射线也能激发细胞的损伤修复机制[9]。本研究显示,在照射后第6、12周末时均有DNA链断裂、细胞凋亡等相关基因高表达,DNA/RNA合成代谢、细胞分裂等相关基因低表达,且在12周末时这些基因差异表达更明显。表明放射性肺损伤造成细胞DNA链断裂,并因此使细胞凋亡增多,DNA合成、细胞分裂等活动减少。因在第12周末时肺损伤较严重,故这些基因差异表达更明显。
基质金属蛋白酶(MMPs)是一组金属依赖性蛋白酶,能特异性的降解细胞外基质,并可以被组织金属蛋白酶抑制剂(TIMPs)特异性抑制。MMPs/TIMPs是影响细胞外基质降解最主要的一组酶系,两者的平衡在多种疾病的发生发展中都起到重要作用[10]。生理状态下细胞外基质处于不断产生和不断降解的动态平衡中,细胞外基质成分过度沉积是肺纤维化形成的关键,而胶原蛋白、纤维素连接蛋白及层粘连蛋白均是细胞外基质的重要成分。因此,MMPs/TIMPs及胶原蛋白、纤维连接素、层黏连蛋白均与肺纤维化的形成有密切关系。本研究模型组对比对照组在第 6、12周末均有 MMP2、MMP9、MMP12、MMP14、TIMP1的高表达,且各基因在 12周末时差异表达更明显,而12周末模型组胶原蛋白、层黏连蛋白及纤维素连接蛋白等纤维化相关基因明 显 高 表 达,提 示 MMP2、MMP9、MMP12、MMP14、TIMP1参与了放射性肺损伤的形成,且在放射性肺损伤的不同时期差异基因表达不同。Araya等[11]通过体外培养人支气管上皮细胞株,照射后发现MMP-2表达增高;Susskind等[12]报道了肺癌、乳腺癌患者放疗后血浆中 MMP-9升高;Lee等[13]发现放射线可以导致MMP-2/TIMP-1平衡的改变,从而使Ⅳ型胶原蛋白降解减少,细胞外基质沉积。MMP-12大多由巨噬细胞产生,主要作用于弹性蛋白,在肺纤维化形成过程中起重要作用[14]。Manetti等[15]证明MMP-12在系统性硬化病患者中血浆水平增高,并与其肺纤维化及血管损伤严重程度相关。李新春等[16]发现放射线照射后 MMP-12酶活性增高,并可能通过降解基底膜弹力纤维促进成纤维细胞转化,启动肺纤维化的发生。本研究亦发现在筛选出的差异表达基因中,MMP12差异表达更显著,提示MMP12或可能是放射性肺损伤发生的关键基因。MMP-14是一个有效的细胞外基质降解酶,它可以水解多种细胞外及细胞膜相关物质蛋白,其表达水平与肿瘤转移密切相关[17]。但近年来并未有MMP-14与放射性肺损伤相关的报道。本研究中MMP14在放射性肺损伤早期及晚期均有明显高表达,提示MMP14在放射性肺损伤发生过程中发挥重要作用,或可能是放射性肺损伤的又一敏感基因。
综上所述,本研究用数字化基因表达谱分析了放射性肺损伤发生过程中的差异基因表达,了解到在放射性肺损伤形成的不同时期差异基因表达不同,MMP2、MMP9、MMP12、TIMP1 参与了放射性肺损伤的形成,并可能在激活炎症因子方面起到重要作用。MMP2、MMP9、MMP12、MMP14、TIMP1 均为放射性肺损伤的敏感基因,但其与放射性肺损伤发生的具体关系不是十分清楚,有待进一步研究;MMP12或可能是放射性肺损伤形成的关键基因,MMP14或可能是放射性肺损伤的又一敏感基因。
[1] 张英杰,李建彬,田世禹,等.肺癌放疗所致放射性肺损伤的相关因素分析[J].中华肿瘤防治杂志,2008,15(16):1264-1267.
[2] Arpin D,Perol D,Blay J Y,et al.Early variations of circulating interleukin-6 and interleukin-10 levels during thorscic radiotherray are predictive for radiation pneumonitis[J].J Clin Oncol,2005,23(34):8748-8756.
[3] Sutherland B M,Georgakilas A G,Bennett P V,et al.Quanitifying clustered DNA damage induction and repair by gel electrophoresis,electronic imaging and number average length analysis[J].Mutat Res,2003,531(1-2):93-107.
[4] Audic S,Claverie J M.The significance of digigal gene expression profiles[J].Genome Res,1997,7(10):986-995.
[5] 张晓敏,王炳胜,葛艳丽,等.益气活血中药治疗放射性肺损伤临床疗效观察[J].中国综合临床,2011,27(9):908-910.
[6] 接亚敏,韩北秋,乔文波,等.放射性肺损伤相关临床因素的研究[J].中华肿瘤防治杂志,2011,18(15):1201-1203.
[7] 王晓萍,张道富,张新良,等.汉防己甲素防治放射性肺损伤的临床观察[J].中华肿瘤防治杂志,2010,17(18):1457-1459.
[8] 曹小飞,官健,陈龙华,等.放射性肺损伤大鼠肺组织Bcl-2和Bax表达变化及其意义的探讨[J].中华肿瘤防治杂志,2010,17(16):1249-1252.
[9] Staaf E,Brehwens K,Haghdoost S,et al.Gamma-H2AX foci in cells exposed to a mixed beam of X-rays and alpha particles[J].Genome Integr,2012,3(1):8.
[10] Amalinei C,Caruntu I D,Giusca S E.Matrix metalloproteinases involvement in pathologic conditions[J].Rom J Morphol Embryol,2010,51(2):215-228.
[11] Araya J,Maruyama M,Sassa K,et al.Ionizingradiationenhaneesmatrix metalloproteinase-2 produetion in human lung epithelial cells[J].Am TPhysiol Lung Cell Mol-Physiol,2001,280(1):30-38.
[12] Susskind H,Hymowitz M H,Lau Y H,et al.Inereased Plasma levels of matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 in lung and breast eaneerarealtered during chest radiotherapy[J].Int J Radiation Oncology BiolPhy,2003,56(4):1161-1169.
[13] Lee W H,Warrington J P,Sonntag W E,et al.Irradiation alters MMP-2/TIMP-2 system and collagen typeⅣdegradation in br[J].Int J Radiat Oncol Biol Phys,2012,82(5):1559-1566.
[14] Matute Bello G,Wurfel M M,Lee J S,et al.Essential role of MMP-12 in Fas-induced lung fibrosis[J].Am J Respir Cell Mol Biol,2007,37(2):210-221.
[15] Manetti M,Guiducci S,Romano E,et al.Increased serumlevels and tissue expression of matrix metalloproteinase-12 in patients with systemic sclerosis:correlation with severity of skin and pulmonary fibrosis and vascular damage[J].Ann Rheum Dis,2012,71(6):1064-1072.
[16] 李新春,宋良文,杨蕾蕾,等.MMP-12异常表达对放射性肺损伤大鼠肺内成纤维细胞转化的影响[J].解放军医学杂志,2009,34(3):267-270.
[17] Bodnar M,Szylberg L,Kazmierczak W,et al.Differentiated expression of membrane type metalloproteinases(MMP-14,MMP-15)and pro-MMP2 in laryngeal squamous cell carcinoma.A novel mechanism[J].J Oral Pathol Med,2012,23(8):231-234.
