蜂蜇伤战士血清相关蛋白分析
2013-10-08眭维国李凤艳陈洁晶欧明林
眭维国,李凤艳,陈洁晶,欧明林,张 岳,林 华,薛 雯,戴 勇
近年来,被毒蜂蜇伤而导致伤亡的病例越来越多。据报道,在美国每年至少有50人因为昆虫叮咬死亡,但实际死亡人数可能远不止这个数。因为很多突然死亡的病例被误认为是其他原因引起的[1]。蜂蜇伤多发生于山区,夏秋季较为常见。毒蜂尤其是黄蜂蜇伤可并发过敏性休克及多脏器功能性损害,表现为血管内溶血、横纹肌溶解、急性肾功能衰竭、肝脏损害(肝功能异常甚至肝功能衰竭)、心脏损害(心肌炎、心律失常、心肌梗死)、弥散性血管内凝血(DIC)、神经系统损害(脑梗死、脑炎、神经病变、脑脊髓神经根炎等),其中以肾脏损害最常见,严重时常危及生命。黄蜂毒液为碱性,主要成分有组胺、血清毒、儿茶酚胺、黄蜂激肽素、磷脂酶A、磷脂酶B、透明质酸酶、蛋白酶、胆碱酯酶、蜂毒多肽、5-羟色胺[2-3]。
蜂蜇伤会导致过敏性反应,被蜂蜇伤发生过敏性反应的成年患者有3%立即死亡[4]。已有报道指出:蜂类体内的糖蛋白(如水解磷脂酶A2和透明质酸酶)就是蜂毒过敏原。但有关过敏反应的机制尚不明确。被蜂蜇伤患者机体有差异蛋白质表达,这些蛋白质能够威胁患者生命。Dombrowski等[5]发现,一些可溶性的、与膜相关的血清蛋白组成了复杂的人类补体网络系统,也与蜂蜇伤患者的过敏反应相关。蛋白质组学的研究已经被引入进了几乎所有的生物医药研究领域。本实验从蛋白组学角度出发,通过分析蜂蜇伤战士与正常人之间存在的差异表达蛋白,寻找中毒者机体损伤机制中新的相关生物标记。
1 材料与方法
1.1 一般资料 蜂蜇伤组:血清样本来源于解放军181医院于2008年10月—2010年2月收集的11例蜂蜇伤标本,其中男9例,女2例。年龄20~43(31.7±8.5)岁。正常对照组:8名正常人血清样本来源于解放军181医院体检中心。所有正常人无被蜂蜇伤病史,且均为蜂毒实验反应阴性受试者。男6例,女2例。年龄20~50(39.6±9.6)岁。全部对象于早晨6∶00~8∶30空腹采集静脉血。蜂蜇伤组和正常对照组的一般资料无统计学差异(P>0.05),具有可比性。
蜂蜇伤部位一般以头部最为常见,其次是颈部和四肢。蜂毒进入血液后7例表现为过敏反应,严重者导致过敏性休克。4例由于就诊不及时导致肾、肝等脏器不同程度并发症的产生。最少的1例被蛰伤15处,多者达到100处。临床诊断指标:尿素氮(BUN)201.18~466.66 mmol/L,尿酸(UN)54.00~ 110.02 μmol/L,血 肌 酐 (Cr)2.33~5.45 μmol/L。
1.2 试剂与仪器 ProteoSeekTMAlbumin/IgG Removal试剂盒、DTT、IAA、溴酚蓝、考马斯亮蓝 R250染液、银反应溶液、乙腈(ACN)。
Ettan IPGphor 3等电聚焦仪(GE Healthcare)、SE600垂直电泳仪(GE Healthcare)、2D Proexpress凝胶扫描系统(Perkin Elmer)、Image Master 2D 5.0凝胶分析软件(GE Healthcare)。
1.3 方法
1.3.1 血清中总蛋白质的抽提:静脉血置于室温下30 min后,3000 r/min离心 15 min。根据 Proteo-SeekTMAlbumin/IgG Removal试剂盒说明进行高丰度蛋白的去除。蛋白质浓度的定量使用Bradford蛋白测定法,-80℃保存。
1.3.2 蛋白质浓度定量-Bradford法:临用前将5×Bradford用超纯水稀释为1×Bradford,并用0.45 μm滤膜过滤避光待用。用超纯水30倍稀释样品,并以样品稀释倍数稀释溶解缓冲液,用2.76 mg/ml BSA稀释液配制为 0.1、0.2、0.3、0.4、0.5 mg/ml溶液。取稀释后样品、标准蛋白溶液、超纯水各10 μl于96孔板,加190 μl 1×Bradford试剂混匀,振荡5 min,用酶标仪于波长为595 nm处测定吸光度值。以BSA浓度为横坐标,吸光度值为纵坐标作标准曲线,查得稀释后样品浓度,乘以样品稀释倍数即得样品蛋白浓度。
1.3.3 二维聚丙烯酰胺凝胶电泳
1.3.3.1 固相pH梯度等电聚焦:分析型凝胶取相当于90 μg(银染)或500 μg(考染)蛋白的细胞裂解液上清,加入水化液至总体积250 μl,混匀后均匀分布在主动水化的胶条槽内。取出胶条,剥去保护膜,将胶面朝下,按酸性端靠近胶条槽正极方向覆盖在样品上,避免产生气泡。在胶条上方从两端添加1.5 ml矿物油,盖上胶条槽盖,水平放置在等电聚焦仪Ettan IPGphor 3上。实验选择pH梯度4~9的13 cm固化pH梯度条进行双向凝胶电泳(2-DE)。恒温20℃按如下条件自动进行主动水化和等电聚焦:Step30 V ×12 h,Step100 V ×2 h,Step200 V ×1 h,Step500 V ×1 h,Grd1000 V ×1 h,Grd 3000 V ×1 h,Grd 8000 V ×3 h,Step 8000 V 至总伏小时数(Vh)达到分析型为45 KVh,制备型凝胶65 KVh时聚焦结束。
1.3.3.2 还原和烷基化:取出胶条,用少许超纯水清洗胶条背面的矿物油并吸干残余水分,胶条在含1%DTT(w/v)的平衡液中摇床水平振荡平衡15 min,并用少许超纯水润洗1次,吸干残余水分,置于2.5%IAA(w/v)平衡液中摇床水平振荡平衡15 min,平衡液体积均为10 ml。
1.3.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE):平衡结束后移至12.5%的SDS-PAGE上端,进行第二向垂直平板SDS-PAGE(SE600)。电泳条件:温度15℃,恒功率1 w/胶,电泳30 min,然后调至11 w/胶电泳至溴酚蓝移动至胶下缘约5 mm处停止。
1.3.4 染色
1.3.4.1 银染(分析型凝胶):室温下,摇床上进行,固定液固定30 min后弃去固定液,加入敏化液,敏化30 min后用超纯水冲洗3次,每次10 min。加入银反应溶液,反应20 min,加入终止液,终止10 min。
1.3.4.2 考染(制备型凝胶):室温下,摇床上进行,用考马斯亮蓝R250染液染色4 h;将凝胶转入脱色液中,平缓摇动4~8 h,其间更换脱色液3~4次。直至凝胶背景合适,蛋白质点鲜明为止。
1.3.5 SDS-PAGE凝胶扫描及图像分析:染色后的SDS-PAGE凝胶均用2D Proexpress凝胶扫描系统进行扫描。Image Master 2D Platinum 5.0分析软件对图像进行强度校正、点检测、背景消减、匹配、量化。蛋白点检测参数设置为:平滑值:4,显著值:2.5,最小面积:50。在分析型凝胶上通过比较找出对照组与处理组之间产生2.0倍以上差异表达的蛋白质点,并在制备型凝胶图像上同步标注。
1.3.6 基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)鉴定:将200 μl枪头约1 cm 处剪断,将所需蛋白点用已剪断的枪头切点后进行水洗、平衡、脱色、再平衡处理离心去液体后加100 μl DTT于56℃震荡60 min,冷却弃去上层液体。100 μl 55 mM IAA于暗处室温震荡30 min,弃上清。加100 μl ACN于通风柜中静置10 min胶粒变成细小白色,除上清,干燥2~5 min。最后在抽真空状态下进行胰蛋白酶消化实验[6]后进行点样,进行MALDITOF-MS分析。
1.3.7 数据库检索:将进行MALDI-TOF-MS实验后所得到的数据结合Image Master 2D 5.0软件分析的图谱找到表达不同的蛋白点并将其分类,通过SWISS-PROT和NCBInr数据库查找差异表达蛋白质并进行功能分析[7]。
2 结果
2.1 2DE结果 通过2-DE实验和银染以及考染后得到两组血清双向凝胶电泳图,见图1。使用Image Master 2D 5.0图像分析软件在蜂蜇伤组血清中检测出(312±18)个蛋白质点,在正常对照组中检测出(256±20)个蛋白质点。从图中可知在蜂蜇伤组中新增5个蛋白点,3个蛋白点上调,7个蛋白点下调。
2.2 MALDI-TOF-MS蛋白验证结果 分析得到17种差异表达蛋白的名称。蜂蜇伤组新增5个蛋白点,具体见表1。3个上调蛋白点见表2。7个下调蛋白点见表3。8个蛋白点无法进行鉴定可能由于银染或者误差引起。从数据库中查得蛋白的PI与2-DE实验的范围相同,证明实验的准确性。其中有一些相同蛋白由于他们酸碱性的改变导致相同蛋白质的PI和分子量不同从而分布在不同位置上,例如图中的蛋白点14、15、16。这些蛋白广泛分布在蜂蜇伤组血清中,并且存在不同程度的表达,其生物学功能(见表1~3)包括与抗原结合、激活肽酶、与细胞骨架蛋白质结合、激活跨膜转运蛋白、细胞骨架结构成分的组成等,其对蜂毒研究发挥重要的作用。

图1 正常对照组(A)和蜂蜇伤组(B)血清双向凝胶电泳图(IEF pH 4~9)等电聚焦PH方向为由图顶部自上而下
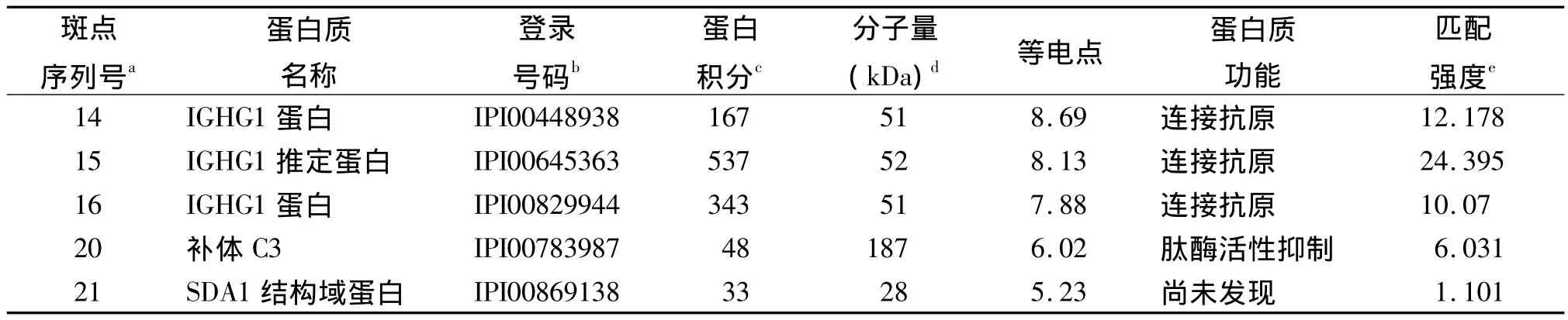
表1 通过MALDI-TOF MS和MS/MS联合分析确定蜂蜇伤组出现的新蛋白点
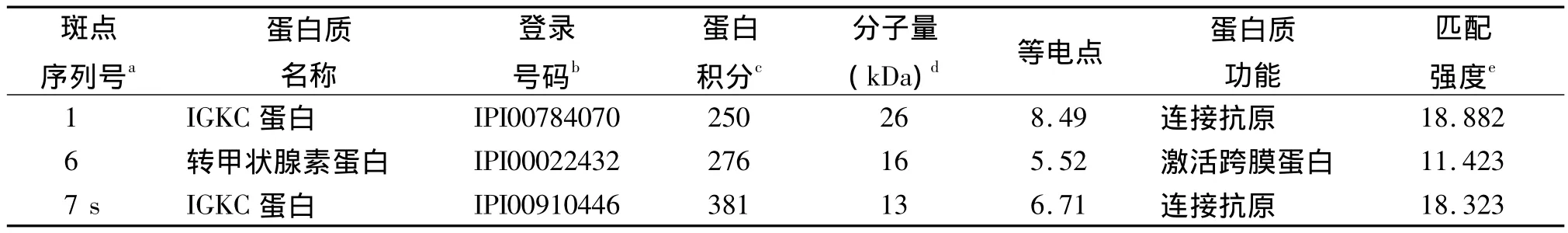
表2 通过MALDI-TOF MS和MS/MS联合分析确定蜂蜇伤组表达上调的蛋白点
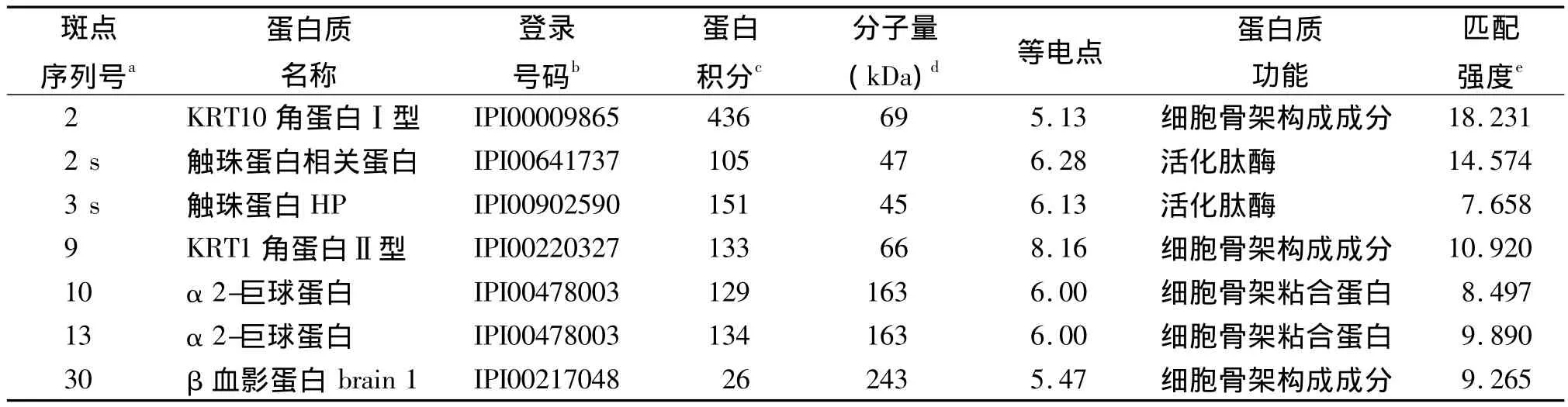
表3 通过MALDI-TOF MS和MS/MS联合分析确定蜂蜇伤组表达下调的蛋白点
3 讨论
蜂蜇伤多发生于夏季,由于此季节经常外出活动容易遭到蜂类袭击,蜂毒进入血液之后产生过敏性反应,严重者可导致身体脏器受损,进而发生多脏器功能障碍综合征(MODS)甚至导致死亡。另外,根据不同的蜇伤部位和个体免疫能力会产生不同症状,有人产生严重的过敏性反应但有些人却不会[8]。有报道表明,蜂蜇伤后2 s内将其毒刺拔出其中毒程度明显下降,同时应立即就医,从而减轻恶化程度。
蜂毒所含毒素主要成分是生物胺类、激肽类和酶类。生物胺类如组胺、5-羟色胺及乙酰胆碱是引起局部疼痛的主要物质,酶类如磷酸酶和透明质酸酶等可引起变态反应;肽类如神经毒素对周围神经及中枢神经有毒性作用,特别是含有21个氨基酸组成的肽类[9]。可引起溶血、横纹肌溶解及凝血功能障碍。破裂红细胞碎片及肌溶蛋白对肾小管阻塞和毒性作用可致肾小管坏死、急性肾衰竭。重度蜂蜇伤后容易发生MODS,发生的顺序以肾脏及血液系统出现最早,其次为消化道、循环系统、肝脏、呼吸系统、神经系统,受累脏器越多,死亡概率越大[10]。肾脏及血液系统均早期受累,器官功能衰竭也最严重。有研究表明随蜂蜇伤中毒程度的加重,血清细胞因子水平升高[11-12]。它们作为细胞因子网络中的调节因子可调控体内多种炎性细胞因子的产生和活性,协同参与了蜂蜇伤中毒的发生、发展过程并影响预后。及时采取有效措施清除血中蜂毒毒素及急性肾功能衰竭后潴留的代谢毒素。降低炎症细胞因子水平,减轻过于强烈、持久的全身性炎症反应造成的器官损伤才是抢救重度毒蜂蜇伤患者的关键。
本实验利用2-DE与MALDI-TOF-MS技术对我院2年来11例蜂蜇伤患者的血清中蛋白进行鉴定。2-DE技术可以将组织和血清样本中的蛋白准确并有效的分离检测出来[13]。通过数据库查找得到在蜂蜇伤患者中有5种新增蛋白,IGHG1蛋白,SDA1蛋白域,C3补体;3个上调蛋白点为IGKC蛋白,甲状腺素转运蛋白;7个下调蛋白点为KRT10角蛋白Ⅰ型、触珠蛋白相关蛋白、触珠蛋白HP、HPR蛋白、Ⅱ型角蛋白KRT1、α2-巨球蛋白、β血影蛋白brain 1。从SWISS-PROT和NCBI数据库中可知5种新增蛋白具有与抗原结合和抑制肽酶激活的作用,由表1可知IGHG1蛋白存在于不同的蛋白点中同时由于酸碱性的改变出现不同的PI和分子量的不同。3个上调的蛋白点所表达的功能与新增蛋白点有着相似的功能并且产生着重要的作用。其中甲状腺素转运蛋白(TTR)会影响人的神经系统[14]。TTR被认为是疾病特异性肽,其内源性高表达蛋白的片段与疾病发生相关联[15]。实验发现产生细胞骨架功能的蛋白KRT1角蛋白II型、α2-巨球蛋白、β血影蛋白brain 1产生明显的下调。Webb等[16]曾报道α2-巨球蛋白与蜂蜇伤患者中毒相关联,但是SDA1蛋白域的生物学功能还不能确定,故还需进一步研究。
[1] Kalogeromitros D,Makris M,Koti I,et al.A simple 3-day"rush"venom immunotherapy protocol:documentation of safety[J].Allergol Immunopathol(Madr),2010,38(2):69-73.
[2] Toro K,Borka K,Kardos M,et al.Expression and Function of C5a Receptor in a Fatal Anaphylaxis After Honey Bee Sting[J].J Forensic Sci,2011,56(2):526-528.
[3] Dai Y,Hu C,Wang L,et al.Serum peptidome patterns of human systemic lupus erythematosus based on magnetic bead separation and MALDI-TOF mass spectrometry analysis[J].Scand J Rheumatol,2010,39(3):240-246.
[4] Golden D B.Insect sting anaphylaxis[J].Immunol Allergy Clin North Am,2007,27(2):261-272.
[5] Dombrowski Y,Peric M,Koglin S,et al.Honey bee(Apis mellifera)venom induces AIM2 inflammasome activation in human keratinocytes[J].Allergy,2012,67(11):1400-1407.
[6] Collet B,Guitton N,Saïkali S,et al.Differential analysis of glioblastoma multiforme proteome by a 2D-DIGE approach[J].Proteome Sci,2011,9(1):16.
[7] Dai Y,Hu C,Huang Y,et al.A proteomic study of peripheral blood mononuclear cells in systemic lupus erythematosus[J].Lupus,2008,17(9):799-804.
[8] Karakis G P,Sin B,Tutkak H,et al.Genetic aspect of venom allergy:association with HLA classⅠand classⅡ antigens[J].Ann Agric Environ Med,2010,17(1):119-123.
[9] Müller U R.Hymenoptera venom proteins and peptides for diagnosis and treatment of venom allergic patients[J].Inflamm Allergy Drug Targets,2011,10(5):420-428.
[10] Rudders S A,Banerji A,Katzman D P,et al.Multiple epinephrine doses for stinging insect hypersensitivity reactions treated in the emergency department[J].Ann Allergy Asthma Immunol,2010,105(1):85-93.
[11] Nandi M,Sarkar S.Acute kidney injury following multiple wasp stings[J].Pediatr Nephrol,2012,27(12):2315-2317.
[12] Przybilla B,Ruëff F.Insect stings:clinical features and management[J].Dtsch Arztebl Int,2012,109(13):238-248.
[13] Issaq H,Veenstra T.Two-dimensional polyacrylamide gel eletroforesis(2D-PAGE):advances and perspectives[J].Biotechniques,2008,44(5):697-698.
[14] Fleming C E,Nunes A F,Sousa M M.Transthyretin:more than meets the eye[J].Prog Neurobiol,2009,89(3):266-276.
[15] Santos L D,Pieroni M,Menegasso A,et al.A new scenario of bioprospecting of Hymenoptera venoms through proteomic approach[J].J Venom Anim Toxins Incl Trop Dis,2011,17(4):364-377.
[16] Webb D J,Gonias S L.A modified human alpha 2-macroglobulin derivative that binds tumor necrosis factor-alpha and interleukin-1 beta with high affinity in vitro and reverses lipopolysaccharide toxicity in vivo in mice[J].Lab Invest,1998,78(8):939-948.
