超声和CT的联合应用在甲状腺滤泡性病变诊断和鉴别诊断中的价值
2013-09-28舒艳艳包凌云韩志江陈文辉雷志凯丁金旺
舒艳艳 ,包凌云 ,韩志江 ,陈文辉 ,雷志凯 ,丁金旺
(1.杭州市萧山区第一人民医院放射科,浙江 杭州 311200;2.杭州市第一人民医院,浙江 杭州 310006)
超声检查及超声引导下细针穿刺活检在甲状腺结节的诊断中具有重要价值,尤其是乳头状甲状腺癌,其敏感性超过90%[1],然而,包括由腺瘤性甲状腺肿和滤泡性腺瘤构成的滤泡性腺瘤样结节(Fol-licular adenomatoid nodules,FAN) 和滤泡细胞癌(Follicular carcinoma,FC)是超声检查及超声引导下细针穿刺活检的灰色区而极易误诊[1-2]。CT虽然在发现结节及结节定性诊断方面不及超声检查[3-5],但在显示较大病变与周围结构的关系、增强CT对病变血供的显示上具有独特的优势,并且在胸骨后甲状腺肿、甲状腺癌中央组淋巴结转移及粗大或环形钙化的观察上优于超声检查[6-7],而成为超声检查的有力补充。据笔者检索,目前国内外尚无关于超声和CT的联合应用在甲状腺滤泡性病变诊断和鉴别诊断中价值的报道。本研究将同时具备回声均匀、周围低回声声晕、边缘规则作为典型的超声诊断FAN的征象[8],以强化程度高于周围甲状腺组织作为典型的CT诊断FAN的征象[3],旨在总结FAN与FC的超声与CT表现的同时,评价超声和CT的联合应用在甲状腺滤泡性病变诊断和鉴别诊断中的价值。
1 资料和方法
1.1 一般资料
搜集杭州市第一人民医院2007年1月—2013年1月和杭州市萧山区第一人民医院2011年1月—2013年1月经手术病理证实并具有完整超声和 CT资料的 109例 122枚 FAN、13例 13枚 FC。109例 FAN中,男25例,女84例,年龄23~73岁,平均(46±11)岁;13 例 FC 中,男 4 例,女 9 例,年龄36~76 岁,平均(51±13)岁。所有患者均因颈部不适、肿块或体检发现。
1.2 检查方法
超声:采用Esaote My Lab 70 XVG型、Philips HD 11 XE型、Philips HDI 5000型超声诊断仪,探头频率为4~13 MHz和5~12 MHz。患者仰卧位,头部后仰暴露颈前区,对病灶进行纵切面、横切面和斜切面扫查,观察甲状腺结节的数目、大小、形态、边界、周边声晕、内部回声、钙化、结节内部和周边血供以及双侧颈部淋巴结情况。CT:采用美国GE Light speed 16和Philips Brilliance 16螺旋CT机,患者取仰卧位,颈部尽量仰伸,扫描范围从口咽部至锁骨上缘,扫描螺距1.0,层厚3.75mm,层距3.75mm。所有检查均为平扫加增强,对比剂为优维显80 mL,高压注射器经肘部静脉团注,注射流率2~3 mL/s,延迟50~60 s进行扫描。
1.3 滤泡性病变的分类方法
对PACS系统同时具备超声与CT的甲状腺资料进行分析,其中1 426例具有完整的病理资料。通过石蜡病理切片诊断进行分类,其中以病理诊断为“腺瘤性甲状腺肿或结节性甲状腺肿伴腺瘤样增生”及 “甲状腺滤泡性腺瘤”作为FAN的诊断标准,以“甲状腺滤泡细胞癌”作为FC的诊断标准。
1.4 分析方法
分别由两名主治或主治以上的超声影像科及放射影像科医生在不知病理结果的前提下,分别对PACS中入选的超声资料和CT资料进行分析。主要分析病变形态(规则或不规则)、超声内部回声或CT平扫密度(均匀或不均匀)、钙化状态(有或无)、钙化形态(细颗粒状钙化、粗钙化、环状钙化及无钙化)、淋巴结转移(有或无)、超声低回声声晕(有或无)、CT强化程度(高于周围甲状腺组织、等于或低于周围甲状腺组织)及增强后边界(较平扫模糊或清晰)。圆形、卵圆形或沿甲状腺形态的类三角形为规则形,其他形态为不规则形。除坏死及钙化外,病变内部回声或CT平扫密度一致者为均匀,其它为不均匀。增强后病变CT值超过周围正常或相对正常(如合并甲状腺炎)的甲状腺组织5 HU,认为强化程度高于周围甲状腺组织。细钙化为d≤2mm的钙化灶,粗钙化为d>2 mm的钙化灶;环状钙化为完整或不完整的环状钙化。
1.5 统计分析方法
采用SPSS 19统计分析软件,通过Fisher精确检验法,对典型超声征象、典型CT征象、强化程度低于周围甲状腺组织的CT征象及环状钙化在FAN与FC诊断中的价值进行分析,P<0.05具有统计学差异。
2 结果
2.1 病变大小和位置
122枚FAN中,左侧59枚,右侧63枚,直径0.5~6.4 cm,平均(2.2±1.2)cm;13枚 FC 中,左侧 7枚,右侧 6 枚,直径 1.1~6.6 cm,平均(2.5±1.9)cm。
2.2 典型超声及CT征象在FAN与FC中的表现
121 枚 FAN(图 1~4)和 11 枚 FC(图 5,6)(因环状钙化后方声衰显著而影响观察的1枚FAN和2枚FC除外)的典型超声征象(图1,4,5)及122枚FAN与13枚FC的典型CT征象(图1~3)比较,见表1。

表1 FAN与FC的典型超声与CT征象(单位:枚)
对FAN与FC的典型超声征象进行Fisher精确检验,P>0.05,提示典型超声征象在FAN与FC鉴别诊断中无统计学差异,即典型的超声征象不能有效的鉴别FAN与FC。对FAN与FC的典型CT征象进行Fisher精确检验,P<0.05,提示典型 CT征象在FAN与FC鉴别诊断中具有统计学差异,即典型的CT征象有助于FAN的诊断。
2.3 钙化在FAN与FC中的价值
本组资料中,超声与CT所观察到的钙化形态一致,其中FAN的细钙化、粗钙化、环状钙化的病变分别为4枚、8枚、4枚,FC中的环状钙化4枚 (图6)。对FAN与FC的环状钙化进行Fisher精确检验,P<0.05,提示环状钙化在FAN与FC鉴别诊断中具有统计学差异,环状钙化提示FC的诊断。
2.4 CT增强后病变边界
122枚FAN与13枚FC增强前后边界比较见表2。

表2 增强后FAN与FC的边界比较(单位:枚)
对FAN与FC的增强后边界征象进行Fisher精确检验,P<0.05,提示增强后边界较平扫清晰在FAN与FC鉴别诊断中具有统计学差异,增强后边界较平扫清晰有助于FC的诊断。
2.5 淋巴结及远处转移
13例FC中,1例发生同侧Ⅳ、Ⅴ、Ⅵ区淋巴结转移及两肺多发转移,1例发生股骨转移。
3 讨论
腺瘤性甲状腺肿是由结节性甲状腺肿局部或弥漫性腺瘤样增生形成,其内细胞成分增多而滤泡成分减少,周围包膜较结节性甲状腺肿厚而完整,与滤泡性腺瘤相仿,Seo等[8]认为甲状腺腺瘤是结节性甲状腺肿细胞增生而发展到一个更高阶段的表现,二者在超声及CT上难以鉴别,且均是临床治疗手段相同的良性病变,故本组资料将腺瘤性甲状腺肿和滤泡性腺瘤共同归入FAN组。FC分为弥漫浸润型和微小浸润型[8-9],是仅次于乳头状甲状腺癌的第二常见恶性肿瘤,其发病机理与碘缺乏有关,随着碘盐的普及和病理诊断标准的改进,目前FC已经非常少见[10],与FAN不同之处在于组织学上的包膜浸润和血管侵犯。
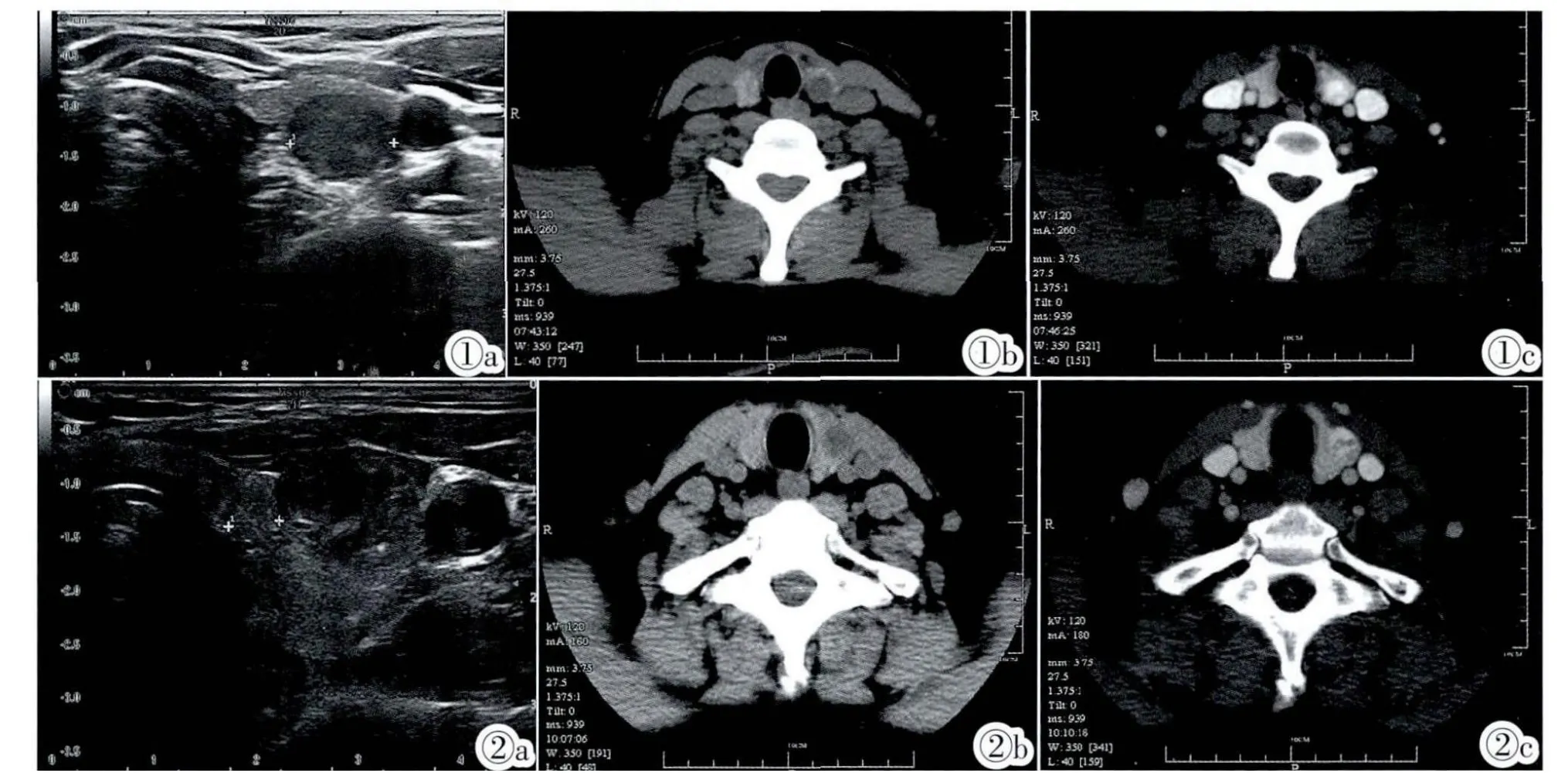
图1 左侧甲状腺FAN。图1a:病变呈圆形,均匀等稍低回声,内侧缘见低回声声晕;图1b:CT平扫呈类圆形均匀低密度;图1c:增强后明显强化,高于周围甲状腺组织。 图2 左侧甲状腺FAN。图2a:病变呈椭圆形,不均匀的等低回声;图2b:CT平扫密度不均匀;图2c:增强后明显强化,高于周围甲状腺组织。Figure 1. FAN in the left thyroid.Figure 1a:Sonography showed a round lesion with mild homogeneous low echo and low echo acoustic halo.Figure 1b:Plain CT scan showed a round lesion with homogeneous density.Figure 1c:The enhancement of the lesion exceeds that of the peripheral thyroid. Figure 2.FAN in the left thyroid.Figure 2a:Sonography showed a round lesion with similar or low echo.Figure 2b:The lesion showed low density on plain CT scan.Figure 2c:The enhancement of the lesion exceeds that of the peripheral thyroid.
病变的超声特征与其组织学表现相关:典型的FAN内部结构一致、包膜完整、膨胀性生长的圆形或椭圆形,故超声上具有相应的均匀回声、周围低回声晕环、边缘规则的表现而与结节性甲状腺肿及乳头状甲状腺癌不同[8,10],本组资料中具有典型超声表现的病变占72.7%(88/121);而病变生长速度及成分不一、包膜厚薄不均时,则表现为回声不均匀、边界不规则、无晕环或晕环厚薄不均匀等,不典型的超声表现占本组资料的27.3%(33/121)。FC尤其是微小浸润型FC,包膜或血管浸润范围相对较轻时,单纯依靠超声难以发现包膜或血管的相应改变,则FC与FAN在超声表现中难以鉴别,本组病例中,具有FAN典型超声表现的FC占45.5%(5/11),即典型超声表现在FAN与FC鉴别诊断中无统计学差异,提示同时具备均匀回声、周围低回声晕环、边缘规则尚不能够鉴别FAN与FC。回声的高低及晕环的厚度是超声用来描述滤泡性病变的另外两个参数,Solbiati等[11]认为等高回声及较厚的晕环提示FC的诊断,而Seo等[8]则认为回声的高低及晕环的厚度在FAN与FC鉴别诊断中无意义,故本组资料中未将争议较大的回声的高低及晕环的厚度作为诊断FAN的典型征象。

图3 右侧甲状腺FAN。图3a:病变不规则,呈均匀低回声;图3b:CT平扫呈均匀低密度;图3c:增强后明显强化,高于周围甲状腺组织。图4 左侧甲状腺FAN。图4a:左侧甲状腺类椭圆形均匀低回声病变;图4b:CT平扫呈均匀低密度;图4c:增强后强化程度低于周围甲状腺组织。 图5 左侧甲状腺FC。图5a:左侧甲状腺类圆形病变,呈均匀稍低回声,周围见低回声声晕;图5b:CT平扫呈均匀低密度;图5c:增强后强化程度低于周围甲状腺组织。 图6 左侧甲状腺FC。图6a:左侧甲状腺环状钙化灶,钙化后方声衰显著而影响病变内部观察;图6b:CT平扫见光整钙化环,其内呈均匀低密度;图6c:增强后强化程度与周围甲状腺组织一致。Figure 3. FAN in the right thyroid.Figure 3a:Sonography showed an irregular lesion with homogeneous low echo.Figure 3b:The lesion showed low density on plain CT scan.Figure 3c:The enhancement of the lesion exceeds that of the peripheral thyroid. Figure 4.FAN in the left thyroid.Figure 4a:Sonography showed a round lesion with homogeneous low echo.Figure 4b:The lesion showed homogeneous low density on plain CT scan.Figure 4c:The enhancement of the lesion lower than that of the peripheral thyroid. Figure 5.FC in the left thyroid.Figure 5a:Sonography showed a round lesion with mild homogeneous low echo and an acoustic halo around it.Figure 5b:The lesion showed homogeneous low density on plain CT scan.Figure 5c:The enhancement of the lesion was lower than that of the peripheral thyroid. Figure 6. FC in the left thyroid.Figure 6a:Sonography showed the interior of the lesion did not show up due to the acoustic attenuation produced by ring calification around it.Figure 6b:Plain CT scan showed regular ring calification with homogeneous low density inside.Figure 6c:The enhancement of the lesion equal to that of the peripheral thyroid.
正常甲状腺组织及异常病变的血供情况与其内滤泡大小和细胞成分的多少有关:正常甲状腺组织由中等大小甲状腺滤泡构成,滤泡间隙见多发微小毛细血管网。如果FAN由较多的细胞成分而较少的滤泡成分构成,滤泡所占据的微血管区域少于正常甲状腺组织,超声血流图上表现为富血供,CT则表现为强化程度高于周围甲状腺组织;如果FAN由多而大的滤泡成分构成,而细胞成分较少时,多而大的滤泡占据了微血管分布区域,超声血流图上表现为少血供[12],CT则表现为强化程度低于周围甲状腺组织。FC的血流图与CT强化程度除了与病变内滤泡及细胞成分相关外,尚与FC浸润病变周围及内部血管有关,病变周围及内部血管浸润可引起病变内部缺血而表现为乏血供的超声血流图表现,而CT则表现为强化程度低于周围甲状腺征象。因受到不同测量者、不同测量方式、不同机型等因素的影响较大,超声血流图不适用于回顾性分析[8],故本组资料未对血流图进一步分析。本组122枚FAN中,68.9%(84/122)的病变在CT上表现为强化程度高于周围甲状腺组织,13枚FC中,仅15.4%(2/13)的病变的强化程度高于周围甲状腺组织,提示强化程度在FAN与FC的鉴别诊断中具有统计学差异,即强化程度高于周围甲状腺组织有助于FAN的诊断,而强化程度低于周围甲状腺组织有助于FC的诊断。对照本院同期[3-5]甲状腺乳头状癌的CT增强表现,未发现强化程度高于周围甲状腺组织的乳头状癌的存在,提示可以通过“强化程度高于周围甲状腺组织”的征象对甲状腺乳头状癌进行排除。强化程度低于周围甲状腺组织的FC易与乳头状癌相混淆,而超声上的典型低回声、纵横比失调、边缘不规则[8,13]以及在CT上典型的咬饼症[3-5]将有助于乳头状癌的诊断,故超声、CT的联合应用有助于FC与乳头状癌的鉴别诊断。
细钙化是甲状腺乳头状癌的特征性表现,其病理基础为砂粒体,而粗钙化及环状钙化的组织学基础则是营养不良性钙化[14]。本组资料中,超声与CT在FAN与FC中观察钙化的有无及钙化的形态上一致,其中FAN中细钙化、粗钙化、环状钙化分别是4枚、8枚、4枚,FC中的环状钙化是4枚,FAN与FC在环状钙化上具有统计学差异,与文献报道一致[8],提示环状钙化有助于FC的诊断。本组4枚环状钙化的FAN和4枚环状钙化的FC中,由于钙化后方声衰显著而影响病变内部及周边结构观察的病变分别为1枚和2枚,而CT对环状钙化的FAN与FC均能清晰显示,提示在环状钙化的观察上,CT优于超声检查。
CT增强后病变边界清晰与否,取决于增强后病变-甲状腺交界区的密度差异[3-5],差异越大,病变越清晰,而差异越小,病变越模糊。与结节性甲状腺肿相比,虽然FAN具有更厚及更完整的包膜,但FAN血供丰富而与周围富血供的甲状腺组织之间的密度差异变小,故病变增强后较平扫模糊而与结节性甲状腺肿的表现不同[3]。FAN增强后病变边界变清晰,则主要与FAN的腺瘤样增生较轻而保留更多的结节性甲状腺肿的组织学特征,或病变是由较大及较多滤泡构成而细胞成分相对较少有关。本组资料中,增强后较平扫模糊的病变占74.6%(91/122)。FC周围较厚包膜的存在与否对病变增强后边界是否清晰具有重要作用,病变包膜微小浸润而大部分包膜存在,表现为增强后病变边界较平扫清晰,而病变内血供丰富或病变周围包膜的广泛浸润,病变的边界较平扫模糊。本组FC中,增强后较平扫清晰的病变占76.9%(10/13)。FC与FAN在增强后病变边界方面具有统计学差异,即增强后病变边界较平扫清晰,提示FC的诊断。对照本院同期结节性甲状腺肿的CT表现[3],增强后病变边界较平扫清晰的FC与结节性甲状腺肿相似,但单发、边界不规则的病变,尤其是边缘呈小分叶状,对FC的诊断有重要意义。
本组13例FC中,1例(7.7%)发生淋巴结转移及两肺转移,另1例(7.7%)发生股骨转移,淋巴结转移发生率明显低于本院同期甲状腺乳头状癌的发生率[3-5],提示血行转移是滤泡细胞癌的主要形式。
本组典型超声征象在FAN中的敏感性为72.7%(88/121),特异性为 54.5%(6/11);典型 CT 征象在FAN中的敏感性为68.9%(84/122),特异性为84.6%(11/13),即二者敏感性相仿,而CT的特异性明显高于超声;二者联合应用,其敏感性为91.0%(111/122),特异性为 61.5%(8/13),提示典型的超声征象与CT征象相结合,可以明显提高FAN诊断的敏感性。
本组资料不足:FC样本量少,可能在一定程度上导致环状钙化等征象在FC中的发病率偏高,笔者将与多家医院联合,从而扩充样本量来解决这一不足;受到回顾性分析的限制,本组资料未对超声血流图进行分析,笔者将进一步搜集资料,确保在相同的超声医生、相同的机型、相同的测量方法的基础上对滤泡性病变的血流图进行研究。
展望:目前超声造影在国内外应用越来越成熟,成为甲状腺结节定性诊断的一个重要检查方式。超声血流图、CT增强检查、超声造影三者相结合对病变微循环做出综合评估,将有助于甲状腺病变的定性诊断。
总之,在FAN的诊断中,CT较超声具有更高的特异性,二者联合应用可以明显提高诊断FAN的敏感性,而环状钙化及CT强化程度低于周围甲状腺组织有助于FC的诊断。
]
[1]Fukunari N,Nagahama M,Sugino K,et al.Clinical evaluation of color Doppler imaging for the differential diagnosis of thyroid follicular lesions[J].World J Surg,2004,28(12):1261-1265.
[2]Schreiner AM,Yang GC.Adenomatoid nodules are themain cause for discrepant histology in 234 thyroid fine-needle aspirates reported asfollicular neoplasm[J].Diagn Cytopathol,2012,40(5):375-379.
[3]韩志江,陈文辉,舒艳艳,等.乳头状甲状腺微小癌和微小结节性甲状腺肿的CT鉴别诊断 [J].中国临床医学影像杂志,2013,24(2):88-92.
[4]韩志江,陈文辉,周健,等.CT在微小甲状腺癌诊断中的价值[J].中华放射学杂志,2012,46(2):135-138.
[5]Han ZJ,Shu YY,Lai XF,et al.Value of computed tomography in determining the nature of papillary thyroid microcarcinomas:evaluation of the computed tomographic characteristics[J].Clin Imaging,2013,137(4):664-668.
[6]Choi JS,Kim J,Kwak JY,et al.Preoperative staging of papillary thyroid carcinoma:comparison of ultrasound imaging and CT[J].Am J Roentgenol,2009,193(3):871-878.
[7]Wu CW,Dionigi G,Lee KW,et al.Calcifications in thyroid nodules identified on preoperative computed tomography:patterns and clinical significance[J].Surgery,2012,151(3):464-470.
[8]Seo HS,Lee DH,Park SH,et al.Thyroid follicular neoplasms:can sonography distinguish between adenomas and carcinomas?[J].Clin Ultrasound,2009,37(9):493-500.
[9]Sugino K,Kameyama K,Ito K,et al.Outcomes and prognostic factors of 251 patients with minimally invasive follicular thyroid carcinoma[J].Thyroid,2012,22(8):798-804.
[10]DeMay RM.Follicular lesions of the thyroid.Follicular lesions of the thyroid.W(h)ither follicular carcinoma?[J].Am J Clin Pathol,2000,114(5):681-683.
[11]SolbiatiL,OstiV,Cova L,etal.Ultrasound ofthyroid,parathyroid glands and neck lymph nodes[J].Eur Radiol,2001,11(12):2411-2424.
[12]Yang GCH,Liebeskind DL,Messina AV.Should cytopathologists stop reporting follicular neoplasms on fine-needle aspiration of the thyroid?Diagnosis and histologic follow-up of 147 cases[J].Cancer(Cancer Cytopathology),2003,99(4):69-74.
[13]谷莹,韩志江,许亮,等.甲状腺微小乳头状癌与微小结节性甲状腺肿的超声鉴别[J]. 中国超声医学杂志,2013,29(3):211-214.
[14]Park M,Shin JH,Han BK,et al.Sonography of thyroid nodules with peripheral calcifications[J].Clin Ultrasound,2009,37(6):324-328.
