阴阳离子型表面活性剂与牛血清白蛋白结合反应的比较研究
2013-09-27梁彦秋张立华臧树良
孙 鹏,梁彦秋,张立华,邓 斌,臧树良
(1.辽宁科技大学 化工学院,辽宁 鞍山 114051;2.沈阳化工学院 环境与生物系,辽宁 沈阳 110142;3.辽宁大学 化学系,辽宁 沈阳 110036)
在生物体内,各类小分子(含中性分子和离子)物质的生物活性功能都是通过它们与生物大分子相互作用体现的,小分子物质与生物大分子之间的相互作用是探索各类小分子生物学效应和功能的基本途径之一[1]。在生产实践和科学研究中,常常存在作为两性小分子物质的表面活性剂和蛋白质相互作用问题,相关研究己引起广泛关注[2-3];蛋白质与表面活性剂的复配体系还被用于模拟生物酶催化体系,对加快生物技术向化工、医药等传统领域的渗透和应用具有重要意义。
试验选用牛血清白蛋白(BSA)与阳离子表面活性剂溴化十六烷基三甲基铵(CTAB)、阴离子表面活性剂十二烷基苯磺酸钠(SDBS)之间的相互作用,借助光谱法和热力学方法,研究了它们之间的作用机制,确定了2种表面活性剂与牛血清白蛋白之间的结合常数和结合过程的基本热力学参数。
1 试验部分
1.1 仪器与试剂
RF-5301荧光分光光度计(日本岛津公司);UV-8453紫外分光光度计(日本日立公司);Spectrum GX1型傅立叶变换红外光谱仪(英国Perkin Elmer公司);AY-122电子分析天平(上海菁华);pHs-3G型酸度计(上海雷磁仪器厂)。
BSA(上海伯奥生物科技有限公司)生化试剂,CTAB(上海试剂公司),SDBS(上海试剂公司),三(羟甲基)氨基甲烷(北京化学试剂公司);氯化钠(重庆国药试剂公司)。除BSA外,所用试剂均为分析纯,水为二次去离子水,无荧光杂质。
1.2 试验方法
将1.0×10-6mol/L的BSA溶液3.0mL加入石英比色皿中,然后逐次加入CTAB溶液,控温298K和310K,分别测定不同温度下的发射光谱。室温下测定CTAB、BSA与CTAB浓度比分别为1∶0、1∶1、1∶3、1∶5的紫外吸收光谱。在一定激发和发射波长范围内,间隔4nm,测定BSA及BSA与CTAB作用产物的三维荧光光谱。用ATR附件测定BSA溶液的红外光谱和缓冲溶液的红外光谱,再用差减软件差减去缓冲溶液的红外光谱,得到BSA溶液的红外光谱。同样方法得到加入CTAB作用后的蛋白质的红外光谱。用相同方法测定SDBS与牛血清白蛋白的相互作用。
2 结果与讨论
2.1CTAB、SDBS与BSA相互作用后的荧光光谱
由图1看到,分别滴加CTAB和SDBS后,BSA的荧光猝灭光谱强度随CTAB和SDBS浓度增大而被强烈猝灭。表明它们都可以与BSA相互作用,但SDBS的猝灭强度更大一些。

图1 CTAB(a)和SDBS(b)对BSA的荧光猝灭光谱
2.2 猝灭类型和猝灭常数
荧光猝灭作用因猝灭机制不同可分为动态猝灭和静态猝灭[4]。动态猝灭过程中,当猝灭体分子和荧光物质分子之间形成新的复合物而发生静态猝灭时,服从 Lineweaver-Burk方程[4-5],KA为结合常数。不同温度下,表面活性剂对BSA的猝灭作用数据见表1。可以看出,不同温度下的Kq远大于最大动态猝灭速率常数2.0×1010L/(mol·S)[6],且表面活性剂对BSA的猝灭常数Ksv随温度升高而降低,表明猝灭过程为静态猝灭。SDBS的KA大于CTAB的KA,表明SDBS与BSA的结合能力要强于CTAB与BSA的结合能力。

表1 方程的相关系数、猝灭常数和结合常数
2.3 作用力的类型
有机小分子和生物大分子之间的结合力主要有氢键、Van der Waals力、疏水作用力和静电引力等,根据文献[6]计算出的反应的ΔG、ΔH 和ΔS见表2。
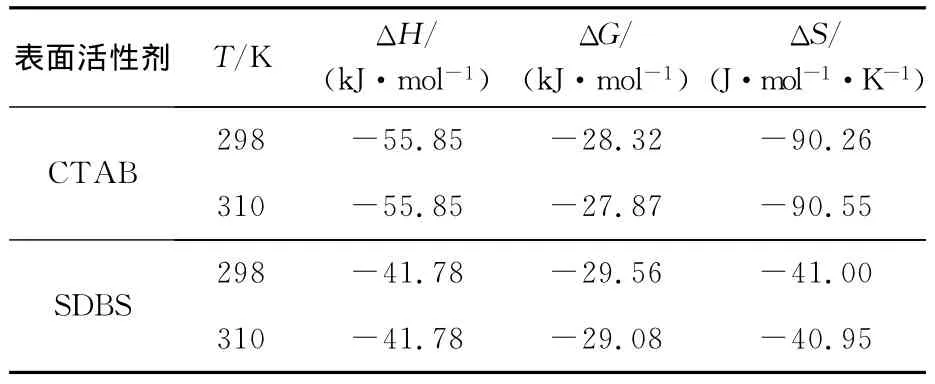
表2 CTAB、SDBS与BSA作用的相关热力学参数
依据Ross等[7]总结的判断生物大分子与小分子结合性质的热力学规律,由表2数据判断,在生理条件下,这2种表面活性剂与BSA之间的作用力可能主要是氢键和范德华力,二者之间没有太大差别。
2.4 紫外吸收光谱比较
图2为2种表面活性剂对BSA紫外吸收光谱的影响。BSA在210nm和278nm显示有2个特征的蛋白质吸收峰。BSA在加入不同浓度的CTAB后,在210nm处的吸收光谱呈减色效应,说明CTAB与BSA发生了较强的作用,使蛋白质分子的构象改变,α-螺旋含量减少[8]。SDBS也发生了相同的现象。

图2 CTAB(a)和SDBS(b)对BSA吸收光谱的影响
2.5 三维荧光
图3是CTAB、SDBS作用于BSA的三维荧光光谱图。

图3 BSA(a)和BSA-CTAB体系(b)的三维荧光光谱
图3的峰有“山脊”形峰,为瑞利散射峰和“驼峰”形峰,为荧光峰(峰1和峰2)。加入CTAB后,瑞利散射峰的强度稍有变化,归因于溶液中溶质和溶剂所处的环境发生了变化。BSA的峰1和峰2的荧光强度降低,发射波长蓝移。SDBS也发生了相同的现象。峰1和峰2强度降低的程度不一样,很显然,表面活性剂对峰2的猝灭作用更为明显。BSA的几乎所有的疏水性氨基酸残基都包埋在圆筒内部,构成疏水腔[9],表面活性剂分子的结合部位可能都处于这种疏水腔中,表面活性剂分子的引入导致这种疏水微环境极性发生改变,进而导致BSA构象发生变化[10]。

表3 CTAB、SDBS作用BSA前后三维荧光光谱的变化
2.6 红外光谱
从图4看出,当CTAB浓度与牛血清白蛋白的浓度比为1∶1时,蛋白质在1 647cm-1和1 546 cm-1处有负峰出现,表明BSA与CTAB之间发生了作用;随CTAB浓度增大,2个吸收峰的强度增大。说明CTAB的加入引起了蛋白质二级结构的变化,1 650cm-1附近的负峰显示α-螺旋结构降低[11]。SDBS的加入也有相同的现象。
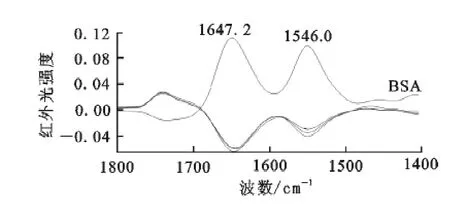
图4 BSA及BSA与CTAB作用产物的红外光谱
3 结论
BSA中加入表面活性剂后,其荧光光谱和紫外光谱都发生了变化,表明这2种表面活性剂均与BSA发生了反应。CTAB与BSA的结合常数小于SDBS与BSA的结合常数,这是由于头基在活性剂与大分子结合过程中占有重要地位:当BSA分子上的特性结合位完全被CTAB饱和后,CTAB所具有的体积较大的极性头基阻碍了CTAB的非极性基与BSA的特异性结合,使得CTAB在BSA上的结合量较SDBS在BSA上的结合量要小。BSA与这2种表面活性剂之间的作用力主要为氢键和范德华力。三维荧光光谱表明,CTAB和SDBS的加入改变了BSA的有序结构;而红外光谱表明,CTAB和SDBS加入后,蛋白质的二级结构发生变化,导致BSA中α-螺旋含量降低。
[1]王夔.20世纪化学的回顾与未来化学学科发展趋势[M].北京:科学出版社,2001.
[2]Guo X Z.Principles of Surfactant Action[M].Beijing:Chinese Light Industry Press,1984:287.
[3]Pezron I,Galet L,Clausse D.Surface Interaction between A Protein Monolayer and Surfactants and Its Correlation With Skin Irritation by Surfactants[J].Journal of Colloid and Interface Science,1996,180(1):285-289.
[4]梁彦秋,孙小寒,臧树良,等.间苯二酚与牛血清白蛋白的作用机理[J].分析试验室,2010,29(6):81-84
[5]闻晓东,李萍,钱正明,等.三种抗氧化物质与牛血清白蛋白的相互作用[J].化学学报,2007,65(5):421-429.
[6]陈国珍,黄贤智,郑朱梓.荧光分析法[M].北京:科学出版社,1990:502.
[7]Ross P D,Subramanian S.Thermodynamic of Protein Association Reactions:forces Contributing to Stability[J].Biochemistry,1981,20:3096-3102.
[8]李晓晶,王志强,陈继,等.稀土离子(Ⅲ)与牛血清白蛋白作用的紫外光谱[J].应用化学,1998,15(1):5-8.
[9]颜承农,张华新,刘义,等.百草枯与牛血清白蛋白结合作用的荧光光谱[J].化学学报,2005,63(18):1727-1732.
[10]唐波,杜鸣,陈蓁蓁,等.交联聚合β-环糊精-邻香草醛苯甲酰腙的合成及其应用[J].化学学报,2004,62(4):399-404.
[11]刘媛,谢孟峡,康娟.三七总皂苷对牛血清白蛋白溶液构象的影响[J].化学学报,2003,61(8):1305-1310.
