电极表面超电势Tafel公式的推广*
2013-09-23雷越黄春华冯振华荆延陈飞武王桂华
雷越 黄春华 冯振华 荆延 陈飞武 王桂华
(北京科技大学化学与生物工程学院 北京 100083)
1 问题的提出
在物理化学教学中,培养学生发现问题、分析问题和解决问题的能力是教学的主要目的之一。我们发现,和分析问题、解决问题的能力相比,大学生往往不善于发现问题。从我们多年的教学经验来看,要培养学生发现问题的能力,关键是要多用具体的例子去启发和引导[1]。下面我们要谈的电极表面超电势就是这样的一个例子。
1905年,Tafel提出了一个经验公式来表示氢超电势与电流密度的定量关系,称为Tafel公式[2-3]。它的具体形式如下:
η=a+blnj
(1)
式中η是超电势,j是电流密度,a和b分别为常数。Tafel公式适用于电流密度较大的情况。当电流密度较小,即j→0时,式(1)中η将趋于负无穷大。这显然是不合理的。因为当电流密度j→0,η应该是0。
Tafel公式非常简洁,能否对其进行适当的修改,使之在j=0时还适用呢?目前已有很多修改方案,其中一个最简单的方案如下:
η=a+bln(c+j)
(2)
式(2)中c是不为0的常数。如果j=0时,η=0,则:
a=-blnc
将a的表达式代入式(2),整理后,得:
(3)
从式(3)可看出,当电流密度j→0,η为0。式(3)和Tafel公式(式(1))一样,也是一个2参数的公式。但它是否有实际的意义呢?答案是肯定的。下面我们将从理论和实验两方面来分析和讨论。
2 公式推导
1924年,Butler和Volmer提出Butler-Volmer公式[4-6]来处理超电势。Butler-Volmer公式的形式如下:
i=i0(e-fαη-ef(1-α)η)
(4)
式中α是常数,通常取0.5;f=F/(RT),F为法拉第常数,其值为96484.5C/mol,R是摩尔气体常数,其值为8.3145J/(mol·K),T为热力学温度;i和i0分别表示电极上的电流和交换电流。平衡时,电极上的静电流i为0,但电极上的氧化和还原过程还在进行,且处于动态平衡。交换电流i0在数值上分别与这时的氧化电流和还原电流相等。这就是交换电流i0的物理意义[6-7]。
值得注意的是,式(4)中的超电势是根据下式定义的:
η=φ1-φ0
(5)
其中φ1和φ0分别为电极的电势和电极平衡时的电势。由式(5)知,阳极的超电势为正,阴极的超电势为负。
将式(4)两边同时除以电极的面积,则得到电流密度的表达式:
j=j0(e-fαη-ef(1-α)η)
(6)
从式(6)容易看出,当电流密度j→0时,η→0。
对阴极来说,式(6)括号中的第一项对应阴极上的还原电流密度,第二项对应阴极上的氧化电流密度。当阴极电流密度较大时,超电势也相应较大。因为阴极的超电势为负,从式(6)可看出,阴极上的还原电流密度较大,氧化电流密度较小。如果忽略氧化电流密度,对式(6)两边取自然对数,就得到:
(7)
注意式(7)中的超电势η为负。式(7)可以看作是Tafel经验公式(式(1))的理论来源[3,6-7]。
由于阴极上主要进行的是还原过程,因此,即使阴极电流密度不大,还原电流密度还是相对较大些,氧化电流密度相对较小些。平衡时,阴极电流密度j为0,还原电流密度和氧化电流密度均变小,且数值上趋于交换电流密度j0。因此,如果仍保留式(6)中的氧化电流密度,可以近似地认为它等于j0。这样,式(6)变为:
j=j0e-fαη-j0
(8)
对式(7)移项,整理后,就得到:
(9)
注意式(9)中的超电势η为负。式(9)就是式(3)的理论基础。
3 实验验证
3.1 实验装置及试剂
电解池一套: 包括铂电极一支,铁电极一支(粗铁丝),鲁金毛细管和盐桥,0.5mol/L H2SO4溶液,滤纸,游标卡尺。
测电极电势装置:电子电位差计一台,饱和甘汞电极一支,饱和KCl溶液,洗耳球一支,导线若干。
极化电极装置:直流稳压电源一台,电阻箱一台,万用表一台。
3.2 实验步骤
3.2.1 电解池准备工作
先用蒸馏水洗净电解池,再用少许0.5mol/L H2SO4溶液荡洗两次,然后插入铂电极和毛细管。要使毛细管尽量靠近铁电极,但不能碰到铁电极。往电解池中加入0.5mol/L H2SO4溶液直至漫过毛细管口。在电解池和甘汞电极之间的“中间试管”也倒入此H2SO4溶液。转动盐桥上活塞于开通状,用洗耳球将毛细管和盐桥内部装上H2SO4,注意要加满,不能留有气泡。转动此活塞于关闭状。
3.2.2 电极处理
用水砂纸打磨铁电极的一端。打亮后先用自来水洗净电极,再用去离子水冲洗几遍,然后用滤纸擦干电极表面。用游标卡尺量取电极直径。再用乙醇棉球擦拭电极,放干净滤纸上备用。
3.2.3 测阴极极化曲线
将打磨后的铁电极装入电解池中,电极插入溶液的长度约0.8cm。连接好电路,用电子电位差计测量没有外加电流时的铁-饱和甘汞电池电动势,直至数据稳定为止。此电动势就是相对于饱和甘汞电极时铁的自腐蚀电势。
将电阻箱的阻值调至最大处,并且将万用表置μA最大档。铁电极与稳压电源的负极相连,铂与正极相连,电源旋钮置6V档。调节电阻箱阻值,使电流各为0.05、0.1、0.3、0.5、1.0、2.0、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10、15、20、25、30、35、40、45、50mA,分别测定不同电流下的铁-饱和甘汞电极电动势。
上述测量完毕后,取出铁电极,用自来水冲去其表面的硫酸溶液,再用去离子水洗净,用滤纸吸干电极表面水分后测量电极浸在H2SO4中的长度,并计算实际工作面积,以便进一步计算电流密度。
3.3 实验结果与讨论
电流密度计算公式如下:
j=i/S
(10)
其中i和S分别表示电流和发生反应的阴极表面积,它们都是通过实验直接测量。在本实验中,阴极为铁电极,它的自腐蚀电势的测量值为539.26mV,作为φ0的近似值。发生反应的阴极面积S为1.449cm2。
表1中的第1列和第2列为实验测量出来的电流i和电压φ1,第3列为按照式(5)计算出来的超电势η。根据式(10),由电流i和阴极表面积S可以算出电流密度j。有了电流密度j和超电势η的数据,就可以利用式(3)和式(4)来拟合。本实验的温度为298.15K。拟合的结果列于表2。
从表2可以看出,采用式(3)拟合得到的相关系数比采用式(4)拟合得到的相关系数好。有了拟合出来的参数,就可以利用式(3)和式(4)计算相应电流密度对应的超电势值。
采用修正的Tafel公式(式(3))和Butler Volmer公式(式(4))计算出来的超电势分别记为η1和η2,具体数据分别列于表1。从表1可以看出,采用式(3)计算出来的数据中,误差大于6mV的只有一个,对应的电流为1mA,其余数据的误差均在5.0mV以下。采用式(4)计算出来的数据中,当电流介于2mA和10mA之间,以及当电流为23mA和25mA时,计算误差均为10mV以上;在全部28个数据中,计算误差小于6mV的数据只有9个,而大于6mV的数据有19个。从这些结果可以看出,修正的Tafel公式(式(3))的计算结果要优于Butler-Volmer公式(式(4))的结果。
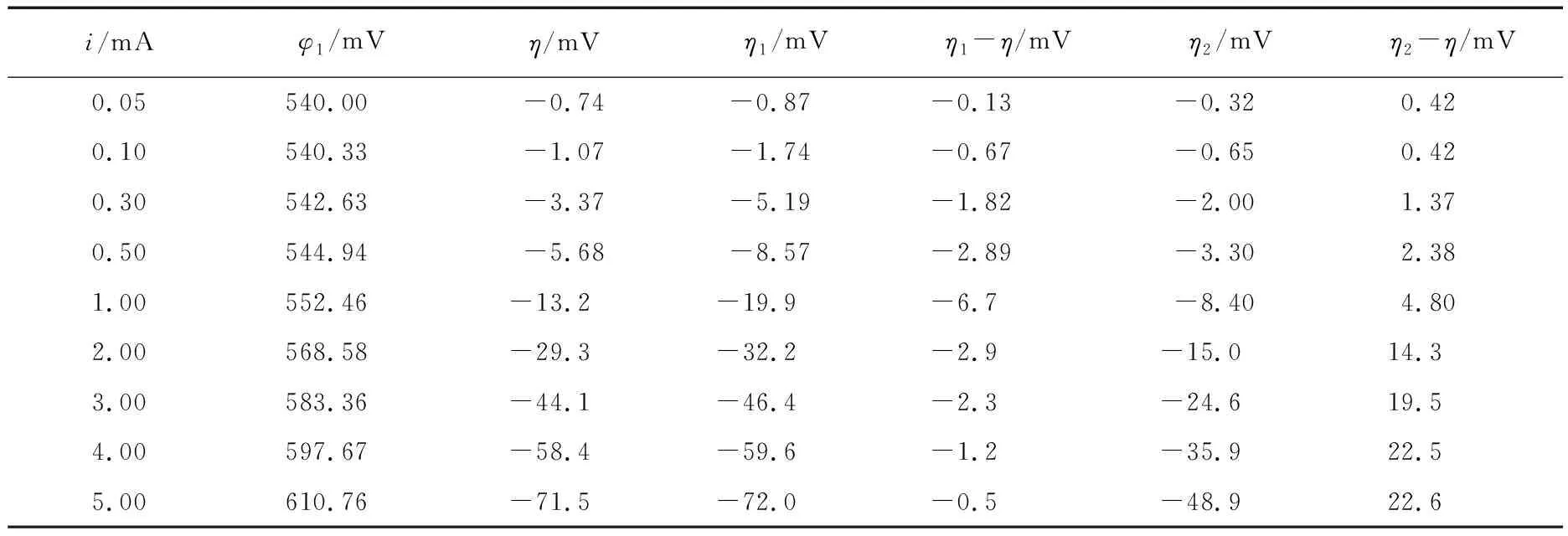
表1 阴极的电流、电压、超电势以及根据式(3)和式(4)拟合的结果

续表1
注:i为实验所测电流,φ1是实验所测电压,η是实验所得超电势,η1是由式(3)计算得到,η2是由式(4)计算得到。

表2 采用式(3)和式(4)对表1中数据拟合的结果
3 结论
本文对Tafel公式进行推广,得到了一个修正的公式(式(3))。式(3)在整个电流范围内都适用。从理论的角度分析了式(3)的合理性,并从实验的角度对其进行了验证。与实验数据比较,我们发现采用式(3)拟合的结果要明显优于采用式(4)拟合的结果。这是令人鼓舞的。当然,这里得出的初步结论还需要通过更多的实验进一步验证。
参 考 文 献
[1] 高新秀,陈飞武,王桂华,等.物理化学教学中研究式教学方法//张欣欣.实践与创新——北京科技大学本科教育教学改革论文集.北京:高等教育出版社,2007:149-153
[2] 傅献彩,沈文霞,姚天扬,等.物理化学.第5版.北京:高等教育出版社,2009
[3] 韩德刚,高执棣,高盘良.物理化学.第2版.北京:高等教育出版社,2009
[4] Butler J A V.TransFaradaySoc,1924,19:729
[5] Erdey-Grúz T,Volmer M.ZPhysikChem,1930,150A:203
[6] Bard A J,Faulkner L R.电化学方法原理和应用.邵元华,朱果逸,董献堆,等译.北京:化学工业出版社,2005
[7] 查全性.电极过程动力学导论.第3版.北京:科学出版社,2002
