血清中miR-155与乳腺癌的相关性
2013-09-23韩学东张学营甄林林
韩学东, 张学营, 甄林林, 张 建, 任 毅
肿瘤与正常组织在基因表达模式上存在明显差 异,可以通过检测肿瘤患者血液中肿瘤特异性信使RNA来进行肿瘤诊断,因此血浆中某种特定的RNA分子作为肿瘤标志物用于临床诊断显示了良好的应用前景[1]。miR-155是最早被发现的具有促癌活性的微小RNA(miRNA),不仅在乳腺癌内表达增高,而且可以促进体内外乳腺癌细胞的增殖和生长。血浆和血清中也存在miR-155,其能够对抗核糖核酸酶的降解而保持稳定性,这表明血液循环中的miR-155有可能成为新一代的乳腺癌肿瘤标志物,也有可能为乳腺癌发病机制及治疗和预后判断等研究提供一个新的方向[2]。但目前关于乳腺癌患者血液循环中miR-155的相关研究较少,本研究采用实时荧光定量PCR方法,检测血清中miR-155的表达水平,分析其与乳腺癌临床病理特征之间是否存在可靠的相关性。
1 资料与方法
1.1 研究对象
收集2010年12月至2011年4月入院的67例女性患者为研究对象,其中乳腺癌患者45例,年龄29~68岁,中位年龄45岁;良性乳腺疾病患者22例,年龄27~63岁,中位年龄42岁(与乳腺癌组患者相比,具可比性)。所有乳腺癌患者均按WHO乳腺肿瘤分类标准进行病理学分型,其中浸润性导管癌41例,浸润性小叶癌4例;肿瘤≤2 cm(T1)18例,>2 cm 27例(其中T2 20例,T3 7例);腋窝淋巴结转移阳性24例,阴性21例;TNM分期Ⅰ、Ⅱ期28例,Ⅲ期17例;ER(+)20例,ER(-)25例;PR(+)24例,PR(-)21例。所有患者在采集血液标本前均未经手术,未经放、化疗,且无炎症等合并症。
1.2 研究方法
1.2.1 主要试剂 miRcute_miRNA提取分离试剂盒、miRcute_miRNA第一链合成试剂盒和miRcute_miRNA荧光定量检测试剂盒购自北京TIANGEN公司,miR-155、miR-16、U6上游引物购自上海生工生物工程有限公司。
1.2.2 分离血清以及miRNA富集部分的提取 采集血液标本后在15℃ ~20℃环境下静置30 min,血液凝固后析出血清,吸取上清液离心10 min(5 000转/min),去除残存血细胞,所得淡黄色血清即可用于实验。在采集血液标本后2 h内吸取200 μL离心后的血清,用miRcute_miRNA提取分离试剂盒进行miRNA富集部分的提取,将提取出的miRNA保存于-70℃冰箱备用。
1.2.3 miRNA 的 cDNA 合成 应用 miRcute_miRNA第一链合成试剂盒,严格按照说明进行操作,吸取11 μL提取后的 miRNA液体,分两步进行cDNA合成。合成后的cDNA保存于-20℃冰箱备用。
1.2.4 miRNA的实时荧光定量检测 采用 miR-cute_miRNA荧光定量检测试剂盒,以miR-16和U6为内参基因,用实时荧光定量PCR方法检测miR-155在血清中的表达情况。miR-155、miR-16和U6的上游引物基因序列以及引物序列见表1。实时荧光定量PCR采用20 μL的反应体系,每孔加入1.5 μL 的 cDNA,1.6 μL 2.5nM 的上游引物,0.4 μL 10 nM 的 Reserve Primer,10 μL miRcute_miRNA premix(含 SYBR,含 ROX),6.5 μL 的 dd 水,每孔重复 3次。阴性对照中不加模板cDNA而以水代替,用于检验是否存在 PCR污染。miR-155、miR-16和 U6的荧光定量标准曲线见图1。
1.3 统计学方法
进行实时定量PCR法检测miRNA的相对表达量时,以miR-16和U6为内参基因对目标基因进行归一化处理,确保在相等数量的样品中比较目标基因的量。血清中miRNA的表达水平计算公式如下:RQ=2-△CT,其中 RQ代表相对表达量(relative quantitation),△CT=Ctargett- Crefence,CTtarget、CTrefence表示某同一标本中目的基因以及内参基因的CT值;A组与B组间miRNA的表达水平变化使用RQ=2-△△CT计算,其中△△CT=(CTtarget- CTrefence)A组-(CTtarget-CTrefence)B组。在进行统计分析前,对计算所得miRNA的相对表达水平进行对数转换,转换后的数据符合正态分布。不同病理特征各组间的比较采用成组t检验方法,使用SPSS13.0软件进行统计学处理,以P<0.05为有统计学意义。
2 结果
miR-155在乳腺癌与非乳腺癌患者血清中的表达有明显差异,乳腺癌患者血清中miR-155表达水平比非乳腺癌患者上调18.155倍(P<0.05)。在乳腺癌患者中,肿瘤大小为T1的血清miR-155表达水平相对于 T2和 T3患者下调 9.332倍(P<0.05);腋窝淋巴结转移阳性患者血清中miR-155表达水平比阴性者上调6.457倍(P<0.05);Ⅰ、Ⅱ期患者血清miR-155的表达水平比Ⅲ期患者下调8.511倍(P<0.05);与ER阴性患者相比,ER阳性患者血清中miR-155表达水平下调16.595倍(P<0.05);与PR阴性患者相比,PR阳性患者血清中miR-155表达水平下调15.848倍(P<0.05)。具体结果见表2、图2~4。
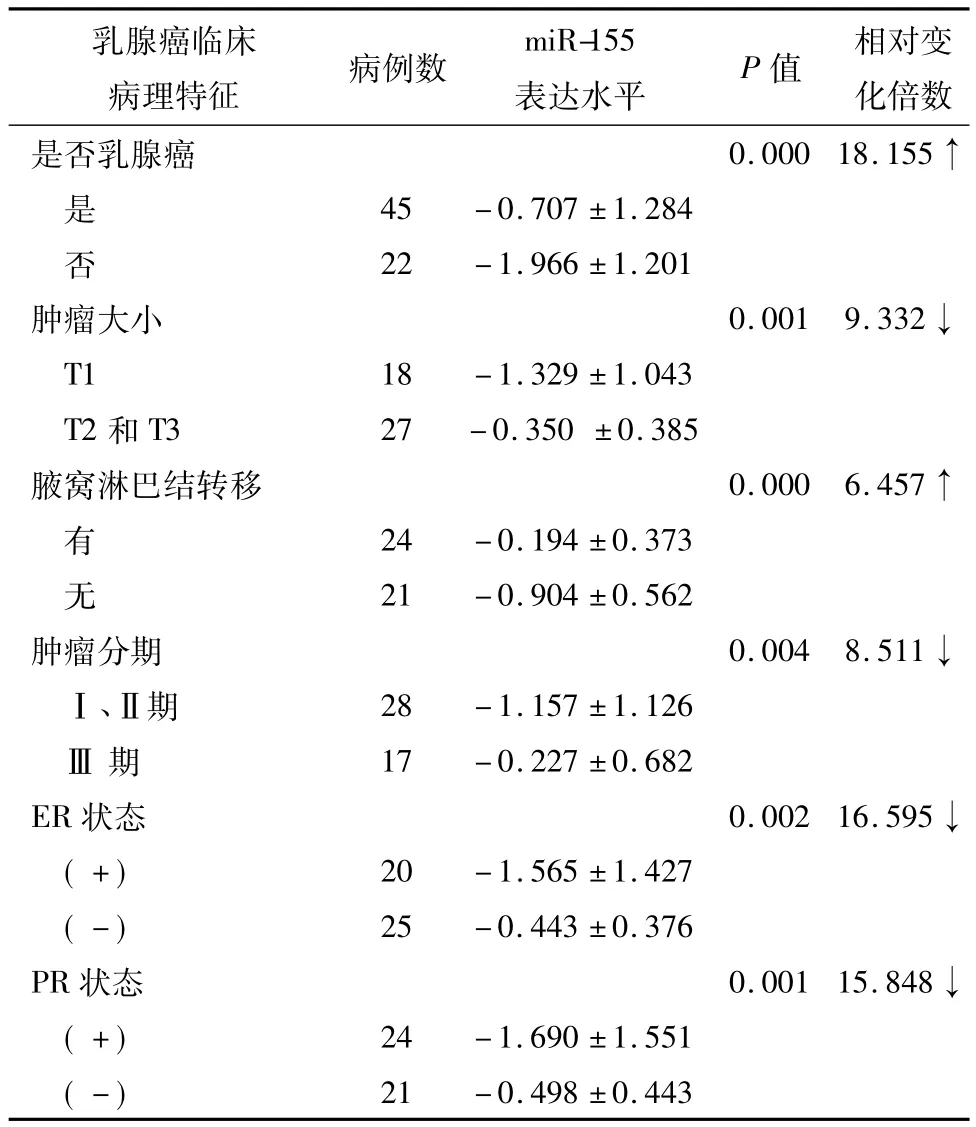
表2 血清中miR-155表达水平与乳腺癌临床病理特征之间的关系

图2 乳腺癌与非乳腺癌患者、腋窝淋巴结转移阳性与阴性者血清中miR-155表达水平的比较

图3 乳腺癌Ⅰ、Ⅱ期与Ⅲ期,T1与T2、T3乳腺癌患者血清中miR-155表达水平的比较
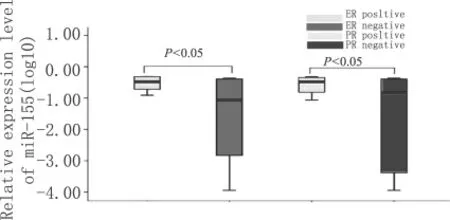
图4 ER、PR阳性与阴性患者血清中miR-155表达水平的比较
3 讨论
微小RNA(miRNA)是一类长度为20~24个核苷酸的短序列、非编码、单链小分子RNA,在胃肠癌、胰腺癌、前列腺癌等多种恶性肿瘤中都有表达,而且表达水平与组织病理学特征以及疾病的不同阶段之间存在着密切关系[3-4]。一般认为血液循环中的miRNA主要来源于凋亡或坏死的细胞、细胞的主动释放以及循环细胞的裂解等。近来研究认为血液循环中的miRNA是由肿瘤细胞选择性分泌的[5],这就说明循环中的miRNA可以用来作为肿瘤标志物。miRNA和肿瘤的关系已成为肿瘤领域中新的研究热点。
Iorio等[6]应用微阵列芯片首次发现有29条miRNA在乳腺癌中表达失调,其中17条表达上调,miR-155是明显上调的miRNA之一,提示其在乳腺癌的发生、发展过程中可能发挥了重要作用。Kong等[7]研究表明miR-155在NMuMG细胞中参与了上皮细胞的间质化和浸润,并且表明miR-155在乳腺癌的转移中发挥了重要作用。本研究发现,miR-155在乳腺癌患者血清中的表达水平明显上调,而且与肿瘤大小、淋巴结转移状况以及肿瘤分期等密切相关,显示了其作为促癌基因的功能,这与既往关于miR-155的研究结论是一致的,ER、PR阳性的乳腺癌患者预后往往好于阴性患者,我们推测,乳腺癌患者血清中miR-155表达水平上调也可能与乳腺癌的不良预后相关,还需要大样本研究和长期随访才能证实。
本研究发现,miR-155在乳腺癌患者血清中表达水平上调,且与乳腺癌的临床病理特征密切相关,主要与肿瘤大小、肿瘤分期及淋巴结转移等因素有关。血清中的miRNA有可能成为新一代的乳腺癌肿瘤标志物,并可用于乳腺癌的临床诊断和预后判断,具有较好的临床应用前景。
[1] Chan KC,Lo YM.Circulating tumour-derived nucleic acids in cancer patients:potential applications as tumour markers[J].Br J Cancer,2007,96(5):681-685.
[2] Zhao H,Shen J,Medico L,et al.A pilot study of circulating miRNAs as potential biomarkers of early stage breast cancer[J].PLoS One,2010,5(10):e13735.
[3] Brase JC,Johannes M,Schlomm T,et al.Circulating miRNAs are correlated with tumor progression in prostate cancer[J].Int J Cancer,2011,128(3):608-616.
[4] Guo HQ,Huang GL,Guo CC,et al.Diagnostic and prognostic value of circulating miR-221 for extranodal natural killer/T-cell lymphoma[J].Dis Markers,2010,29(5):251-258.
[5] Pigati L,Yaddanapudi SC,Iyengar R,et al.Selective release of microRNA species from normal and malignant mammary epithelial cells[J].PLoS One,2010,5(10):e13515.
[6] Iorio MV,Ferracin M,Liu CG,et al.MicroRNA gene expression deregulation in human breast cancer[J].Cancer Res,2005,65(16):7065-7070.
[7] Kong W,Yang H,He L,et al.MicroRNA-155 is regulated by the transforming growth factor beta/Smad pathway and contributes to epithelial cell plasticity by targeting RhoA[J].Mol Cell Biol,2008,28(22):6773-6784.
