崇明东滩黑腹滨鹬(Calidris alpina)食物来源和组成的稳定同位素分析
2013-09-22汤臣栋薛文杰马志军
张 璇,华 宁,汤臣栋,马 强,薛文杰,吴 巍,马志军
(1.复旦大学 生物多样性科学研究所,生物多样性与生态工程教育部重点实验室,长江河口湿地生态系统野外科学观测研究站,上海200433;2.崇明东滩鸟类国家级自然保护区,上海202183)
大多数鸻鹬类在非繁殖季节栖息于滨海湿地.近年来,受全球变化的多重影响,滨海湿地大面积丧失和退化,这使得鸻鹬类的栖息地减少并影响到鸻鹬类的食物资源.滨海湿地丧失也成为鸻鹬类数量在全球范围内快速下降的首要原因[1].研究鸻鹬类的食物,对有效评估栖息地质量以及制定鸻鹬类的保护策略具有重要意义.
以往研究鸻鹬类食物所采用的多为传统的胃内容物分析或粪便分析方法,这些方法可直接确定食物种类,但只能反映动物短期内摄取的食物,且分析结果往往高估难以消化的食物.另外,胃内容物分析法在采样过程中可能对动物造成伤害[2].自20世纪80年代以来,稳定同位素分析技术在动物的食物分析中得到了越来越多的应用.该方法所需样品只是动物身体组织的一小部分,可以做到无损伤取样;得到的结果反映动物在较长一段时间的代谢特征,能够真实反映动物所利用的食物[3].根据稳定同位素分析的结果还可以构建生态系统的食物网,了解食物网的结构以及研究对象所处的营养级[4-5].
崇明东滩位于长江口,是东亚-澳大利西亚鸻鹬类迁徙路线上重要的迁徙停歇地和越冬地,每年在此迁徙停歇或越冬的鸻鹬类多达25万只[6].黑腹滨鹬(Calidrisalpina)在春秋迁徙途中均在崇明东滩过境,还有部分种群在此越冬,是当地数量较多的鸻鹬类之一[7-8].大量研究表明,鸻鹬类在非繁殖期的食物主要包括双壳类、甲壳类、多毛类和腹足类等大型底栖动物[9-10].但Elner等[11]的研究发现,黑腹滨鹬能够摄取滩涂表面的生物膜(biofilm)并利用其中的沉积物、微藻和微生物所分泌的物质快速获取能量.最近稳定同位素分析的研究表明,生物膜是大部分滨鹬类的重要食物来源,特别对小型滨鹬类的食物贡献很大[12-13].这些研究结果对传统的鸻鹬类食物组成研究结果提出了挑战.然而,上述采用稳定同位素分析方法研究鸻鹬类食物所采用的样品均为鸻鹬类的胃内容物或粪便样品[11-13].由于胃内容物或粪便样品中会混有鸻鹬类无法消化的物质,其研究结果可能无法反映其同化的食物特征.
动物体不同组织的合成和周转速率不同.其中血浆的周转速率最快,稳定同位素的半周转期仅为3天[14],当代谢速率提高时(如需要快速积累能量的迁徙停歇期),半周转期会更短[15-16].因此,尽管鸻鹬类在迁徙停歇地的停留时间相对短暂,但血浆的稳定同位素水平仍然能够反映鸻鹬类在迁徙停歇地的食物情况.本文对崇明东滩春秋迁徙期和越冬期黑腹滨鹬的血浆样品进行稳定同位素分析,探讨黑腹滨鹬在不同季节的食物来源和食物组成,并为了解生物膜对黑腹滨鹬食物的贡献提供直接证据.
1 方 法
1.1 采样地点
崇明东滩位于崇明岛的最东端(31°29′N,121°58′E).随着滩涂高程变化,崇明东滩的滩涂植物呈现明显的演替规律:低潮滩为裸露的光滩,无高等植物生长;中潮滩的植物主要为海三棱藨草(Scirpus mariqueter)、藨草(S.triqueter)和互花米草(Spartinaalterniflora);高潮滩植物主要为芦苇(Phragmites australis)和互花米草[8].广袤的滩涂湿地为鸻鹬类的觅食和能量补充提供了重要场所.潮间带和光滩丰富的底栖动物是鸻鹬类的主要食物[17].
1.2 样品采集
样品采集于2010年崇明东滩黑腹滨鹬的春秋迁徙期(4月下旬;10月中旬)和越冬期(11月底),在黑腹滨鹬到达崇明东滩的之后至少3周才采样.在黑腹滨鹬的觅食地即海三棱藨草外带与光滩交界处[18],用翻网法捕鸟,选择体重较重的个体(45g以上)采血.具体操作为:使用28G一次性采血针刺破翅下肱骨静脉,以120μL毛细管吸取血液100μL,转移至500μL肝素钠抗凝管并放入冰盒.所有血液样品于采集后4h内完成离心(8 500×g,15min),分离出血浆,于-20℃冷冻保存.
在采集血样的同时,在黑腹滨鹬的觅食地采集黑腹滨鹬潜在的食物[17],包括双壳类河蚬(Corbicula fluminea)、缢蛏(Sinonovaculaconstricta);腹足类堇拟沼螺(Assimineaviolacea);多毛类背蚓虫(Notomastuslatericeus)、疣吻沙蚕(Dentinephtysglabra);甲壳类谭氏泥蟹(Ilyoplaxdeschampsi)、旋卷蜾蠃蜚(Corophiumsinensis).每种底栖动物采集20~30个个体,分别放入样品瓶中.回实验室后用清水洗净底栖动物上附着的泥沙,于-20℃冷冻保存.另外,用牙刷刷取滩涂表面的沉积物(厚度约1mm,面积10cm×10cm),以采集觅食地的生物膜[13],样点间距约100m.
1.3 样品处理和分析
黑腹滨鹬的血浆样品在冷冻干燥机中过夜处理,打匀成干燥均匀的粉末待测.底栖动物样品在4℃解冻,各取肌肉组织(多毛类进一步洗净泥沙,取整个个体;双壳类取闭壳肌;腹足类取除去内脏和生殖腺的软组织),每种底栖动物的5~10个体的肌肉组织混合为一个样品.所有样品在60℃烘干,逐滴加入0.25mol/L盐酸,直至再无气泡产生,以除去样品中的碳酸盐[19].酸化后的样品重新在60℃烘干,并研磨成细粉,过筛(孔径200μm)待测.
所有样品检测碳和氮两种稳定同位素比值.检测在中国林科院稳定同位素实验室进行,所用仪器为DELTA V Advantage同位素比率质谱仪和Flash EA1112HT元素分析仪(Thermo Fisher Scientific,Inc.,USA).稳定C、N同位素的自然丰度表示为:

式中,X为13C或15N,R为13C/12C或15N/14N 的相对比率.δ13C值是相对于国际标准物质 PDB的丰度,δ15N值是相对于标准大气氮的丰度.实验分析结果的相对误差为δ13C<±0.1‰,δ15N<±0.2‰.
1.4 稳定同位素数据分析
通过比较黑腹滨鹬和底栖动物的δ15N值,参考黑腹滨鹬血浆δ15N的富集因子(3.3‰)[20],初步确定黑腹滨鹬可能的食物组成.由于生物膜并不是被黑腹滨鹬直接利用的食物资源(见研究结果),因此并未将生物膜用于拟合黑腹滨鹬的食物组成.
将四类食物(双壳类:河蚬、缢蛏;腹足类:堇拟沼螺;多毛类:沙蚕、背蚓虫;甲壳类:谭氏泥蟹、旋卷蜾蠃蜚)的平均δ13C值和δ15N值、黑腹滨鹬春秋季血浆样品的δ13C值和δ15N值输入R语言的SIAR程序包,并经过营养富集因子校正和食物碳氮百分含量校正,拟合出各种食物对黑腹滨鹬的相对贡献[21].本研究将四类底栖动物肌肉δ13C值相比初级生产者δ13C和δ15N的富集因子分别定为0.5‰和2.2‰[22];黑腹滨鹬血浆δ13C和δ15N 的富集因子分别定为0.5‰和3.3‰[20].
用同样的方法分析三类初级生产者,即C3维管植物(芦苇和海三棱藨草)、C4维管植物(互花米草)和底栖微藻,对黑腹滨鹬食物来源的相对贡献.湿地生态系统食物链中,初级生产者通过底栖动物被鸻鹬类所利用,因此从初级生产者到黑腹滨鹬血浆的δ13C和δ15N的富集因子分别为1.0‰和5.5‰.初级生产者的稳定同位素数据参考全为民在崇明东滩的研究结果[23].
由于碳氮百分含量校正主要是去除不同食物资源碳氮组成的差异对拟合结果造成的误差,而初级生产者并不直接被黑腹滨鹬取食;加之受采样方法的限制[23],用于稳定同位素分析的底栖微藻样品中的碳氮百分含量并不准确,所以食物来源贡献的拟合中没有使用含量校正.
尽管生物膜也是湿地生态系统的初级生产者之一,但生物膜的组成较复杂,虽然包括少量微生物及其分泌的多糖类物质,但其成分来源仍然是当地的维管植物和微藻.因此在拟合初级生产者对黑腹滨鹬食物来源的相对贡献时,并未将生物膜包括在内.
1.5 统计检验
采用卡方检验分别检测黑腹滨鹬的食物组成,以及三类初级生产者对黑腹滨鹬的食物来源贡献有无季节差异.采用单因素方差分析(ANOVA)分别比较黑腹滨鹬春季、秋季和冬季的稳定同位素水平(δ13C值和δ15N值)的差异.统计分析采用SPSS 19.0软件包(SPSS INC.,2010)完成,研究结果表示为平均值±标准差.
2 研究结果
2.1 初级生产者和底栖动物的碳氮稳定同位素特征
崇明东滩的外来C4植物互花米草比本地C3植物芦苇和海三棱藨草有显著富集的δ13C值,两种本地维管植物芦苇和海三棱藨草的δ13C值最低,而底栖微藻的δ13C值介于C3植物和C4植物之间[23].生物膜有相对富集的δ13C值.四类底栖动物的δ13C值介于于-22‰~-16‰之间,δ15N值以双壳类最高,多毛类、甲壳类、腹足类依次降低(图1).
2.2 黑腹滨鹬的碳氮稳定同位素特征
黑腹滨鹬在崇明东滩的稳定同位素δ13C值和δ15N 值都存在显著的季节差异(δ13C 值F=23.58,P<0.01;δ15N值F=7.52,P<0.01).与春季迁徙停歇期((-21.69±1.38)‰)和越冬期((-19.51±1.43)‰)相比,黑腹滨鹬在秋季迁徙停歇期有相对富集的δ13C值((-17.16±0.80)‰).从春季到冬季,在崇明东滩的黑腹滨鹬的δ15N值有所降低.
2.3 黑腹滨鹬各季节的食物组成和食物来源
崇明东滩生物膜的δ15N值为3.77‰,而黑腹滨鹬春、秋、冬的δ15N 比值分别是13.06‰,12.30‰,10.63‰(图1).由于黑腹滨鹬血浆δ15N 的富集因子为3.3‰,所以生物膜不是黑腹滨鹬在崇明东滩的主要直接食物来源.
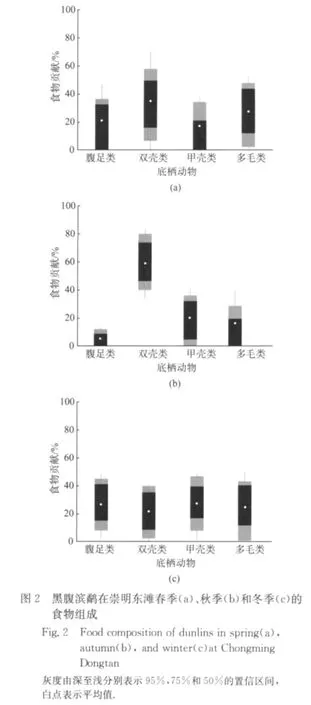
黑腹滨鹬在崇明东滩的食物组成有显著的季节差异(χ2=37.91,P<0.01).在春秋迁徙停歇期,双壳类是其主要食物.甲壳类在秋季的食物贡献明显增加,而腹足类和多毛类的食物贡献有所下降.在越冬期,各类底栖动物对黑腹滨鹬的食物贡献相似(图2).
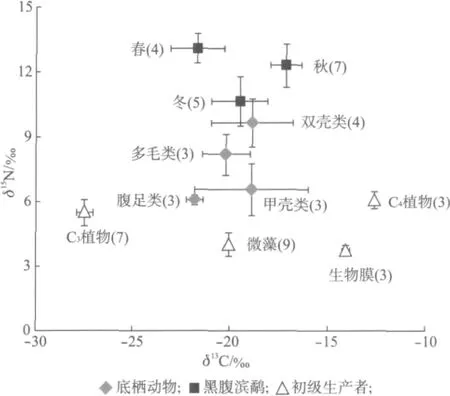
图1 崇明东滩不同季节的黑腹滨鹬及其食物来源的碳、氮稳定同位素比值.括号中的数值为样本量Fig.1 Carbon and nitrogen stable isotopic ratios of dunlins,invertebrates and primary producers at Chongming Dongtan.The numbers in the parenthesis indicate the sample size
三类初级生产者对黑腹滨鹬食物来源的贡献也有显著的季节差异(χ2=29.76,P<0.01).在崇明东滩的春季迁徙停歇期,黑腹滨鹬的食物来源以C3植物即芦苇和海三棱藨草为主;秋季迁徙停歇期则以C4植物互花米草为主.三类初级生产者对越冬期的黑腹滨鹬食物来源的贡献比较接近,互花米草的贡献略低(图3).

3 讨 论
3.1 生物膜对崇明东滩黑腹滨鹬的食物贡献
近年来,生物膜对滨鹬类的贡献引发了许多学者的关注[12-13].对黑腹滨鹬和西滨鹬(Calidrismauri)的胃内容物分析表明,生物膜(沉积物)所占比例分别超过了40%和75%[24];在其他小型鸻鹬类的胃内容物中,沉积物也占有相当的比例[25-27].相对底栖动物而言,生物膜是极易获得的食物资源,觅食生物膜反映了小型滨鹬在觅食收益和支出之间的权衡.然而,胃内容物只是被黑腹滨鹬摄取的所有物质,并不能够反映被其同化的物质,而且鸻鹬类的粪便中也含有大量沉积物[28].本研究的结果表明,生物膜可能是在鸻鹬类觅食底栖动物的同时被顺带吞下,并未被黑腹滨鹬同化,因此在血浆中没有表现出生物膜的稳定同位素特征.
生物膜对鸻鹬类的食物贡献还受到觅食地滩涂基质中有机碳含量的影响.由于泥质滩涂的有机碳含量较高,所能提供的能量也更多,所以在泥质滩涂的觅食地,生物膜的贡献高于砂质滩涂[13].黑腹滨鹬在崇明东滩的觅食地主要分布于藨草外带和光滩,滩涂表层基质中的有机碳含量较低,仅为0.1%~0.5%[29],这或许是造成本研究中生物膜对黑腹滨鹬的食物贡献很低的原因.由于鸻鹬类的栖息地分布广泛,且滨海湿地的环境异质性较高,有关生物膜对鸻鹬类的食物贡献,还有待在其他区域开展进一步的研究.
3.2 黑腹滨鹬食物组成的季节差异
崇明东滩各类底栖动物生物量的变化可能是导致黑腹滨鹬食物组成存在季节差异的主要原因.在黑腹滨鹬的觅食地(稀疏的藨草外带和光滩),双壳类的密度最高[29].由于鸻鹬类多采取机会主义的觅食策略[30],它们往往会倾向于取食密度更高的食物,因此双壳类在春秋迁徙停歇期的食物组成中都占据较大比例.而双壳类在秋季的生物量高于春季,这可能是双壳类在秋季食物组成中贡献较大的原因.而在冬季,由于天气寒冷,大多数底栖动物多分布于较深的土层,黑腹滨鹬能够利用的各类底栖动物数量都相对较少,所以食物组成中不同种类的底栖动物比例相似.
另外,食物组成的季节差异可能是导致黑腹滨鹬的稳定同位素水平存在显著差异的主要原因.如秋季甲壳类对黑腹滨鹬的食物贡献明显上升,腹足类和多毛类的食物贡献有所下降,且甲壳类的δ13C值相对富集程度更大,因此黑腹滨鹬秋季的δ13C值比春季和冬季高.又如双壳类的δ15N值最高,冬季双壳类的食物组成显著降低,使得黑腹滨鹬越冬期的δ15N值低于春季.
3.3 初级生产者对黑腹滨鹬食源贡献的季节变化
底栖动物是湿地生态系统食物链中的初级消费者.由于底栖动物的觅食方式各异,导致其食性不同,而能够被黑腹滨鹬取食的底栖动物种类存在季节差异,这可能是造成三类初级生产者对黑腹滨鹬的食源贡献发生季节变化的主要原因.如腹足类主要取食微藻(图1),又是黑腹滨鹬在春季迁徙停歇期重要的食物,因此,微藻在黑腹滨鹬春季的食物来源中占了一定比例;而秋季,腹足类对黑腹滨鹬的食物贡献很低,导致微藻对黑腹滨鹬食物来源的贡献亦相对较小.
在美国旧金山海湾的研究发现,米草属入侵种会通过上行过程引起底栖微藻的减少以及沉积物的增加,并导致底栖动物群落构成发生改变,其中双壳类的数量会显著下降,导致鸻鹬类迁徙停歇期的主要食物来源减少,因此米草属植物的入侵威胁着鸻鹬类种群[32].本研究结果表明,作为崇明东滩种群数量最多的初级生产者[33],互花米草对黑腹滨鹬的食物来源贡献总体上最为突出,特别是在秋季迁徙停歇期,互花米草的食源贡献超过60%.这说明经过生态系统的分解作用和潮汐的搬运作用,互花米草所提供的有机碳源可以被鸻鹬类所利用.尽管如此,由于互花米草入侵所形成的单优势群落植株密度高,鸻鹬类无法在互花米草群落中活动,导致互花米草无法为鸻鹬类提供栖息地[34].而且互花米草的快速扩散会使得鸻鹬类的主要栖息地—海三棱藨草群落和光滩的面积减少,因此互花米草的治理仍然是鸻鹬类保护工作所亟待解决的问题.
4 结 论
本研究结果表明,生物膜并未被黑腹滨鹬直接利用.黑腹滨鹬在崇明东滩的食物组成存在显著的季节差异,这可能与崇明东滩各类底栖动物生物量的季节变化有关.食物组成的季节性差异可能是导致三类初级生产者对黑腹滨鹬的食源贡献具有季节差异的主要原因.外来植物互花米草对黑腹滨鹬的食物来源具有重要贡献.
致谢:感谢崇明东滩鸟类自然保护区对野外工作的支持.感谢复旦大学秦海明等人在野外采样工作中给予的指导与帮助.
[1]Wetlands International. Waterbird Population Estimates(Fourth edition)[R].The Netherlands:Wageningen,2006.
[2]Barrett R T,Camphuysen C J,Anker-Nilssen T,etal.Diet studies of seabirds:a review and recommendations[J].ICESJournalofMarineScience,2007,64(9):1675-1691.
[3]Peterson B J,Fry B.Stable isotopes in ecosystem studies[J].AnnualReviewofEcology,Evolutionand Systemastics,1987,18:293-320.
[4]Deniro M J,Epstein S.Influence of diet on the distribution of carbon isotopes in animals[J].Geochimica etCosmochimicaActa,1978,42(5):495-506.
[5]Deniro M J,Epstein S.Influence of diet on the distribution of nitrogen isotopes in animals[J].Geochimica etCosmochimicaActa,1981,45(3):341-351.
[6]Barter M.Shorebirds of the Yellow Sea:importance,threats and conservation status[M].Canberra,Australia:Wetlands International,2002.
[7]Ma Z J,Tang S M,Jing K,etal.Chongming Island:A less important shorebirds stopover site during southward migration[J].Stilt,2002,41:35-37.
[8]徐宏发,赵云龙.上海市崇明东滩鸟类自然保护区科学考察集[M].北京:中国林业出版社,2005.
[9]Worrall D H.Diet of the Dunlin Calidris alpina in the Severn Estuary[J].BirdStudy,1984,31(3):203-212.
[10]Perez-Hurtado A,Goss-Custard J D,Garcia F.The diet of wintering waders in Cádiz Bay,Southwest Spain[J].BirdStudy,1997,44(1):45-52.
[11]Elner R W,Beninger P G,Jackson D L,etal.Evidence of a new feeding mode in western sandpiper(Calidrismauri)and Dunlin(Calidrisalpina)based on bill and tongue morphology and ultrastructure[J].MarineBiology,2005,146(6):1223-1234.
[12]Kuwae T,Beninger P G,Decottignies P,etal.Biofilm grazing in a higher vertebrate:the western sandpiper,Calidrismauri[J].Ecology,2008,89(3):599-606.
[13]Kuwae T,Miyoshi E,Hosokawa S,etal.Variable and complex food web structures revealed by exploring missing trophic links between birds and biofilm [J].EcologyLetters,2012,15(4):347-356.
[14]Hobson K A,Clark R G.Turnover of13C in cellular and plasma fractions of blood:implications for nondestructive sampling in avian dietary studies[J].TheAuk,1993,110(3):638-641.
[15]Bearhop S,Waldron S,Votier S C,etal.Factors that influence assimilation rates and fractionation of nitrogen and carbon stable isotopes in avian blood and feathers [J].PhysiologicalandBiochemical Zoology,2002,75(5):451-458.
[16]Podlesak D W,McWilliams S R,Hatch K A.Stable isotopes in breath,blood,feces and feathers can indicate intra-individual changes in the diet of migratory songbirds[J].Oecologia,2005,142(4):501-510.
[17]王天厚,钱国桢.长江口杭州湾鸻形目鸟类[M].上海:华东师范大学出版社,1988..
[18]敬 凯.上海崇明东滩鸻鹬类中途停歇生态学研究[D].上海:复旦大学,2005.
[19]Jacob U,Mintenbeck K,Brey T,etal.Stable isotope food web studies:a case for standardized sample treatment[J].MarineEcologyProgressSeries,2005,287:251-253.
[20]Evans-Ogden L J,Hobson K A,Lank D B.Blood isotopic(δ13C andδ15N)turnover and diet-tissue fractionation factors in captive dunlin(Calidrisalpinapacifica)[J].TheAuk,2004,121(1):170-177.
[21]Parnell A C,Inger R,Bearhop S,etal.Source partitioning using stable isotopes:coping with too much variation[J].PLoSONE,2010,5(3):e9672.
[22]McCutchan J J H,Lewis J W M,Kendall C,etal.Variation in trophic shift for stable isotope ratios of carbon,nitrogen,and sulfur[J].Oikos,2003,102(2):378-390.
[23]全为民.长江口盐沼湿地食物网的初步研究:稳定同位素分析[D].上海:复旦大学生命科学学院,2007.
[24]Mathot K J,Lund D R,Elner R W.Sediment in stomach contents of Western sandpipers and dunlin provide evidence of biofilm feeding[J].Waterbirds,2010,33(3):300-306.
[25]Reeder W G.Stomach analysis of a group of shorebirds[J].TheCondor,1951,53(1):43-45.
[26]Beyer W N,Connor E E,Gerould S.Estimates of soil ingestion by wildlife[J].JournalofWildlife Management,1994,58(2):375-382.
[27]Hui C A,Beyer W N.Sediment ingestion of two sympatric shorebird species[J].ScienceoftheTotal Environment,1998,224(1-3):227-233.
[28]Tulp I,de Goeij P.Evaluating wader habitats in Roebuck Bay(north-western Australia)as a springboard for northbound migration in waders,with a focus on Great Knots[J].Emu,1994,94(2):78-95.
[29]Zhou J L,Wu Y,Kang Q S,etal.Spatial variations of carbon,nitrogen,phosphorous and sulfur in the salt marsh sediments of the Yangtze Estuary in China[J].Estuarine,CoastalandShelfScience,2007,71(1-2):47-59.
[30]朱 晶,敬 凯,干晓静,马志军.迁徙停歇期鸻鹬类在崇明东滩潮间带的食物分布[J].生态学报,2007,27(6):2149-2159.
[31]Davis C A,Smith L M.Foraging strategies and niche dynamics of coexisting shorebirds at stopover sites in the Southern Great Plains[J].TheAuk,2001,118(2):484-495.
[32]Levin L A,Neira C,Grosholz E D.Invasive cordgrass modifies wetland trophic function[J].Ecology,2006,87(2):419-432.
[33]Wang Q,An S Q,Ma Z J,etal.Invasive Spartina alterniflora:biology,ecology and management[J].Acta Phytotaxonomica Sinica,2006,44(5):559-588
[34]Gan X J,Cai Y T,Choi C Y,etal.Potential impacts of invasiveSpartinaalternifloraon spring bird communities at Chongming Dongtan,a Chinese wetland of international importance [J].Estuarine,Coastal,andShelfScience,2009,83(2):211-218.
