三维适形放射治疗联合GF方案同期化疗治疗局部晚期胰腺癌疗效分析
2013-09-21王锋蔡晶季斌
王锋,蔡晶,季斌
(1.江苏省南通市肿瘤医院肿瘤科,南通 226361;2.南通大学附属医院放疗科,南通 226001)
近年来胰腺癌的发病率和病死率呈上升趋势,胰腺癌发病率位列欧美恶性肿瘤第9位,死亡率居第5位[1]。目前,对胰腺癌常采用胰十二指肠切除术,包括淋巴结清除。由于胰腺周围组织较多,易被肿瘤侵犯,致手术切除率低,平均为15%左右[2,3]。三维适形放疗(3D-CRT)及调强放疗是在加速器上加铅块或MLC共面或非共面固定照射,是近年放射治疗胰腺癌的常用技术。研究[4]表明,3D-CRT及调强放疗联合化疗能明显提高胰腺癌患者1、2年生存率,明显高于常规放疗。本研究通过应用3DCRT联合GF方案同期化疗治疗局部晚期胰腺癌(LAPC)患者,取得了良好疗效,现报道如下。
1 资料与方法
1.1 临床资料
选择经病理组织学或细胞学检查确诊为LAPC的初治患者39例,其中男26例,女13例,年龄41~78岁,平均59.5岁。所有患者均经计算机断层扫描(CT)、核磁共振成像(MRI)、肿瘤标志物(CA-199、CEA等)临床诊断证实为有明确病灶。排除标准:1)此前接受过其他抗癌治疗或/及继发肺、骨、脑等远处转移;2)年龄<80岁,Karnofski评分≥60分,估计生存期≥3个月;3)血小板>1×1011/L,白细胞>4×109/L,血红蛋白>100g/L;4)肝功能Child-Pugh A级;5)凝血机制、肾功能及心电图基本正常。将患者分为同期组(3D-CRT联合GF同期化疗)19例和序贯组(GF化疗,而后行3DCRT)20例。其中同期组男14例,女5例;中位年龄63.8岁;腹痛16例;肿瘤部位:胰头8例,胰体尾11例。序贯组男12例,女8例;中位年龄67.3岁;腹痛17例;肿瘤部位:胰头14例,胰体尾6例。两组患者性别、年龄和病灶部位等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 化疗 化疗前给予患者少量镇静剂以及5-羟色胺受体拮抗剂,以减轻化疗后可能引起的消化道反应。将GEM 800mg/m2加入到0.9%氯化钠100mL中,静脉滴注,d1、d8、d15;5-FU 500mg/m2加入到0.9%氯化钠500mL中,静脉滴注,d1、d8、d15。应用5-FU前,分别常规予以两组患者亚叶酸钙(FA)200mg加至0.9%氯化钠250mL中,静脉滴注,28d为1周期,连续2周期。
1.2.2 3D-CRT方法 采用3D-CRT系统及 M3型小多叶光栅,Siemens Mevatron KD2型直线加速器,将患者固定在体部定位架固定的负压袋上,嘱患者双手抱头,标记体表定位点,贴上标记球,从膈顶至第4腰椎下缘范围内以螺旋CT平扫加增强扫描,每层厚3~5mm,并将扫描图像传输至3D-CRT工作站。按照ICRU50号文件规定定义靶区,临床靶区体积(CTV)范围包括由影像诊断科医师、放射治疗科医师及物理师共同确认的原发灶和区域淋巴结,边界为CT所显示的大体肿瘤体积(GTV)外放1cm,计划靶区(PTV)由CTV外放1.5cm。物理师和放射治疗科医师共同勾画体表轮廓及重要脏器,分5~6个野行适形治疗,通过剂量体积直方图(DVH)优化治疗计划。90%的等剂量曲线包围GTV,并以此计算剂量,常规分割,2Gy/次,5次/w,总剂量30~64Gy/3~6.5w,中位剂量46Gy。同期组放疗于化疗的当日或次日开始;序贯组待化疗结束后开始放疗。
1.3 疗效评定
根据治疗前后胰腺CT评价病灶退缩情况。近期疗效在放射治疗结束2个月后按实体瘤疗效评价标准(RECIST)评分,目标病灶评价:完全缓解(CR),所有目标病灶消失;部分缓解(PR),基线病灶长径总和缩小≥30%;疾病进展(PD),基线病灶长径总和增加≥20%或出现新病灶;疾病稳定(SD),基线病灶长径总和有缩小但未达PR或有增加但未达PD。以(CR+PR)计算总有效率。
遵循美国肿瘤放射治疗协作组(RTOG)急性放射损伤分级标准观察放化疗导致的胃肠道反应、肝肾功能损害及血液毒性等情况。
根据Karnofsky功能状态(KPS)评分标准评价全身状况:治疗后增加≥10分者为提高;减少≥10分者为降低;变化(增加或减少)<10分者为稳定。
1.4 统计学方法
所有数据分析采用SPSS 15.0统计学软件进行统计,计数资料采用χ2检验,两组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 生存曲线比较
两组患者随访均截至2010年2月,随访率为96%,随访时间4~42个月,中位随访期12个月。
两组患者的生存率均随时间的延长而呈下降趋势,但同期组的生存率明显优于序贯组(见图1)。
2.2 近期疗效比较
同期组CR率及总有效率显著高于序贯组,差异有统计学意义(P<0.05或P<0.01)(见表1)。两组中已知死亡原因的各13例,其中远处转移或局部复发合并远处转移的发生率同期组为46%,序贯组为69%,同期组远处转移发生率明显低于序贯组。
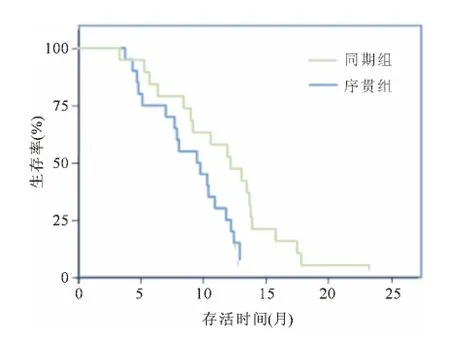
图1 同期组与序贯组生存曲线比较

表1 两组患者近期疗效比较[n(%)]
2.3 不同病灶部位疗效比较
两组胰体尾癌的总有效率均显著高于胰头癌的总有效率,差异均有统计学意义(P<0.01),说明同一种方法对胰体尾癌治疗效果优于胰头癌(见表2)。
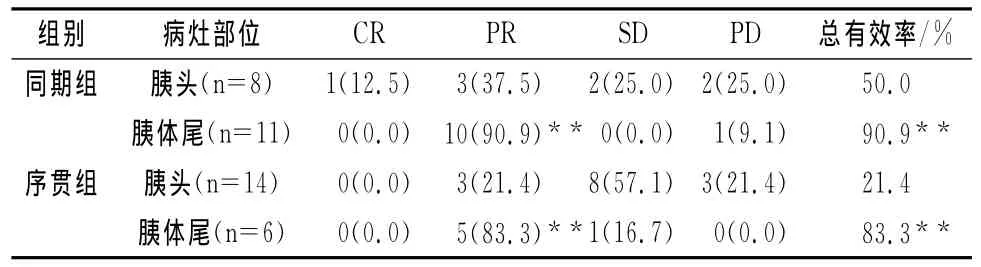
表2 两组患者不同部位病灶疗效比较[n(%)]
2.4 毒副反应发生情况
两组主要不良反应为骨髓抑制、恶心、呕吐、腹泻及皮疹。两组恶心、呕吐等消化道反应及皮疹发生率比较差异无统计学意义(P>0.05)。同期组骨髓抑制1~2级发生率明显低于序贯组,但3~4级发生率显著高于序贯组,差异有统计学意义(P<0.05)(见表3)。
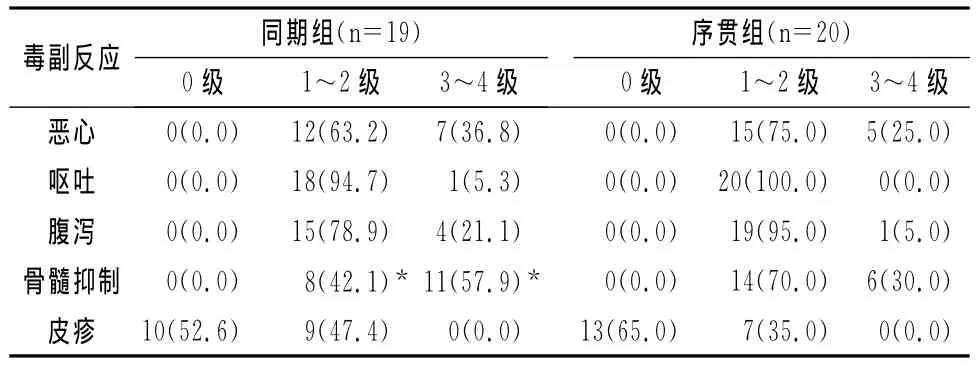
表3 两组毒副反应发生情况比较[n(%)]
2.5 全身情况比较
同期组患者治疗后KPS评分下降者明显少于序贯组,差异有统计学意义(P<0.05)(见表4)。
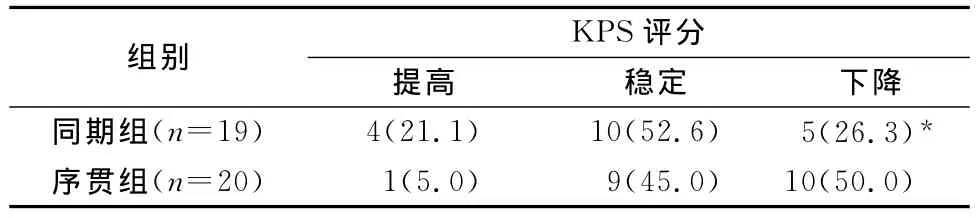
表4 两组患者全身情况比较[n(%)]
2.6 CA19-9与肿瘤生存的关系
所有患者治疗前均检测CA19-9,升高者32例(同步组15例,序贯组17例),正常者5例。32例CA19-9升高者治疗后20例降低,其中同期组14例,序贯组6例,组间比较差异有统计学意义(χ2=7.94,P=0.001)。治疗后CA19-9持续升高10例,其中同期组2例,序贯组8例,另有2例CA19-9水平保持稳定。CA19-9升高者1年生存率为56.2%,CA19-9正常者为80.0%。治疗过程中CA19-9水平持续升高者1年生存率为0%,而CA19-9水平降低或稳定者为36.3%。治疗前后CA19-9>1 000μg/L者均于1年内死亡(见图2)。
2.7 放疗剂量与肿瘤生存的关系
接受放射治疗的39例患者中,部分患者因出现较严重的毒副反应,导致治疗耐受性降低,还因其他原因使其未能接受根治性放疗。放疗总剂量为(30~64)Gy/(3~6.5)w,中位剂量为46Gy。在随访过程中,发现放疗剂量与肿瘤生存具有一定相关性(见图3)。
3 讨论
由于胰腺的解剖位置深,早期症状隐袭,且具有非特异性,导致80%~90%无法手术切除,50%~60%属局部晚期,因此胰腺癌预后很差。目前,临床医师一般主张根治性手术,除了切除病灶部位还包括清扫胰腺周围淋巴结,以提高患者生存率。由于胰腺周围组织较多,易被肿瘤侵犯,多数患者选择放弃手术而行放化疗及支持治疗,严重影响了治疗效果。

图2 CA19-9与肿瘤生存的关系
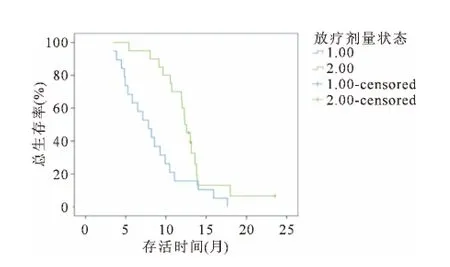
图3 不同放疗剂量的生存曲线比较
由于胃、十二指肠耐受剂量偏低,常规胰腺癌放射治疗的局控率偏低,若增加放疗剂量,则会增加并发症发生率。适行放疗能使肿瘤区域的剂量提高,且均匀分布,并能极大地减少正常组织所受的剂量,提高肿瘤局部控制率。有研究[5]显示,多数胰腺癌患者接受3D-CRT及调强放疗后疼痛缓解明显,治疗后1~3个月的肿瘤局部有效率为70%~90%。本研究结果表明,同期组的生存率明显优于序贯组,总有效率显著高于序贯组,且远处转移发生率明显低于序贯组,说明同期治疗能明显提高生存率,提高治疗有效率,且有利于减少远处转移。两组主要不良反应为骨髓抑制、恶心、呕吐、腹泻及皮疹,其中同期组骨髓抑制1~2级发生率明显低于序贯组,但3~4级发生率显著高于序贯组。此外,同期组患者治疗后KPS评分下降者明显少于序贯组,说明同期治疗有利于改善患者全身状况。
大量研究[6-9]表明,CA19-9是一种诊断胰腺癌非常重要的肿瘤标记物,其特异性及敏感性较高,同时对胰腺癌的预后、可切除性判断及术前分期具有一定参考价值。Moon等[10]研究发现,术前CA19-9<200U/mL的患者预后较好,是预后的有利因素。王洛伟等[11]发现,血清CA19-9检测值与患者生存期呈明显负相关,随着CA19-9检测值的增加,患者生存期明显缩短。本研究结果显示,CA19-9升高患者1年生存率为56.2%,而CA19-9水平正常者为80.0%,治疗过程中CA19-9持续升高者1年生存率为0%,而CA19-9水平稳定或降低者为36.3%,对于治疗前后CA19-9>1 000μg/L者生存期均<1年,提示CA19-9水平升高患者的生存率会下降,这为检测胰腺癌患者的肿瘤生长和生存率提供了参考依据。
综上所述,3D-CRT加同期GF化疗能明显延长LAPC患者的生存期,改善全身状况,且不良反应患者可耐受,是治疗LAPC的较好方法。
[1]Joensuu TK,Kiviluoto T,Kärkkäinen P,etal.Phase I-II trial of twice-weekly gemcitabine and concomitant irradiation in patients undergoing pancreaticoduodenectomy with extended lymphadenectomy for locally advanced pancreatic cancer[J].International Journal of Radiation Oncology Biology Physics,2004,60(2):444-452.
[2]Coley SC,Strickland NH,Walker JD,etal.Spiral CT and the pre-operative assessment of pancreatic adenocarcinoma[J].Clinical Radiology,1997,52(1):24-30.
[3]Tanaka N,Okada S,Ueno H,etal.The usefulness of serial changes in serum CA19-9levels in the diagnosis of pancreatic cancer[J].Pancreas,2000,20(4):378-381.
[4]Small Jr W,Mulcahy MF,Rademaker A,etal.Phase II trial of full-dose gemcitabine and bevacizumab in combination with attenuated three-dimensional conformal radiotherapy in patients with localized pancreatic cancer[J].International Journal of Radiation Oncology Biology Physics,2011,80(2):476-482.
[5]Huguet F,Goodman KA,Azria D,etal.Radiotherapy technical considerations in the management of locally advanced pancreatic cancer:American-French consensus recommendations[J].International Journal of Radiation Oncology Biology Physics,2012,83(5):1355-1364.
[6]Girgis MD,Federman N,Rochefort MM,etal.An engineered anti-CA19-9cys-diabody for positron emission tomography imaging of pancreatic cancer and targeting of polymerized liposomal nanoparticles[J].J Surg Res,2013,185(1):45-55.
[7]Wu E,Zhou S,Bhat K,etal.CA 19-9and Pancreatic Cancer[J].Clinical Advances In Hematology & Oncology,2013,11(1):53-55.
[8]Lee KJ,Yi SW,Chung MJ,etal.Serum CA 19-9and CEA Levels as a Prognostic Factor in Pancreatic Adenocarcinoma[J].Yonsei Medical Journal,2013,54(3):643-649.
[9]夏士安,王佳,车莉萍.探讨三维适行放射治疗在晚期胰腺癌中的临床意义[J].中国医药导报,2012,9(35):73-74,80.
[10]Moon HJ,Jang KT,Heo JS,etal.A result of surgical treatment for ductal adenocarcinoma of the head of the pancreas[J].Korean J Gastroenterol,2003,42(2):156-163.
[11]王洛伟,李兆申,余志良.血清CA19-9水平对胰腺癌的诊断价值[J].解放军医学杂志,2002,27(4):302-303.
