非酒精性脂肪性肝病与心血管疾病的相关性分析*
2013-09-20魏艳玲范丽玲颜綦先陈东风
王 军 魏艳玲 范丽玲 肖 潇 颜綦先 李 娅 陈东风
非酒精性脂肪性肝病(NAFLD)是指除过量饮酒和其他损肝因素所致的,以弥漫性肝细胞大泡性脂肪变和肝小叶炎症为特征的临床病理综合征,包括单纯性脂肪肝(nonalcoholic fatty liver,NAFL)、脂肪性肝炎(NASH)、肝脏纤维化和肝硬化4个病理学过程[1]。NAFLD发病率逐年升高,西方国家成人患病率为20%~33%[2],我国发达地区成人患病率达15%[3]。一些流行病学调查显示,心血管疾病(CVD)是NAFLD患者的主要死亡原因,其死亡率已超过肝脏疾病本身,且NAFLD病变程度越重,CVD死亡率越高[4]。血管内皮功能紊乱、颈动脉内膜中层厚度(IMT)增加及外周血管硬化等指标是早期动脉粥样硬化的直接标志,可被用于预测心血管事件的发生。本研究通过检测分析NAFLD患者上述早期动脉粥样硬化的指标变化,以评估NAFLD患者发生CVD的风险。
资料与方法
一、一般资料 2012年10月至2013年6月我院体检中心体检者或住院发现的NAFLD患者48例,男27例,女21例;平均年龄(47.3±8.5)岁。健康人43例,男23例,女 20例;平均年龄(46.8±7.9)岁。排除肝炎病毒感染、自身免疫性肝病、药物性肝损伤、肝硬化等其他肝病患者。测量人群身高、体质量、血压,并计算体质量指数(BMI)。
二、血液指标检测 采集患者空腹静脉血,使用Olympus 400全自动生化仪测定丙氨酸氨基转移酶(ALT)、胆固醇(TC)、甘油三脂(TG)和高密度脂蛋白胆固醇(HDL)。计算稳态模型胰岛素抵抗指数(HOMA-IR)=FINS×FPG/22.5。采用酶联免疫吸附法检测可溶性细胞间黏附分子-1(sICM-1)和血内皮素-1(ET-1,上海锐聪科技发展有限公司)。
三、CT检查 使用GE公司生产的LIGHT SPEED 64排CT诊断仪,扫描范围自膈顶往下至肝脏及脾脏,取肝脾同一层面,分别测量肝脾值。肝脾比值≤1为轻度NAFLD,肝脾比值≤0.7为中度,肝脾比值≤0.5为重度(图1A)。使用飞利浦256排极速CT检查冠脉CTA,经肘静脉注入非离子对比剂(碘帕醇370mgl/ml),扫描时间4~5秒,扫描范围自气管分叉处扫描至心底部。扫描所得原始数据行左冠状动脉和右冠状动脉的主要血管节段进行重建,并对冠脉管壁钙化做钙化积分评价,用circulation软件观察冠脉管壁内的斑块和钙化情况(图1B)。

图1 NAFLD患者肝脏CT和冠脉狭窄CTA影像
四、外周血管检测 参照Guangda方法检测肱动脉血流介导的内皮依赖性舒张功能(FMD)[5]。应用美国GE公司 LOGIQ-500彩色超声同步记录心电图,每次分别测3个心动周期,取其平均值。在测定基础值(D0)后进行反应性充血试验,实验完成后90s内测肱动脉内径(D1)。FMD=(D1-D0)×100%。采用PHILIPS IU22高频探头分别测量左、右颈总动脉远端分叉1cm处、颈内动脉起始端、颈动脉窦部IMT值3次,取其平均值。IMT≥1.0mm为增厚,IMT≥1.5mm为局部突起增厚,即粥样斑块。使用日本科林公司VP21000全自动动脉硬化测定仪测定踝臂血压比值(ABI)和臂踝脉搏波速度(baPWV)。
五、统计学分析 应用SPSS13.0软件包进行统计学分析。计量数据以(±s)表示,两组间比较采用独立样本t检验,率的比较采用x2检验,变量间的相关性检验采用Pearson相关分析,P<0.05为差异具有统计学意义。
结果
一、临床特征 NAFLD患者与健康人比,性别、TG、HDL无明显差异(P>0.05),但ALT、BMI和TC等均显著高于健康人(P<0.05),见表1。
表1 两组人群基本情况(±s)比较
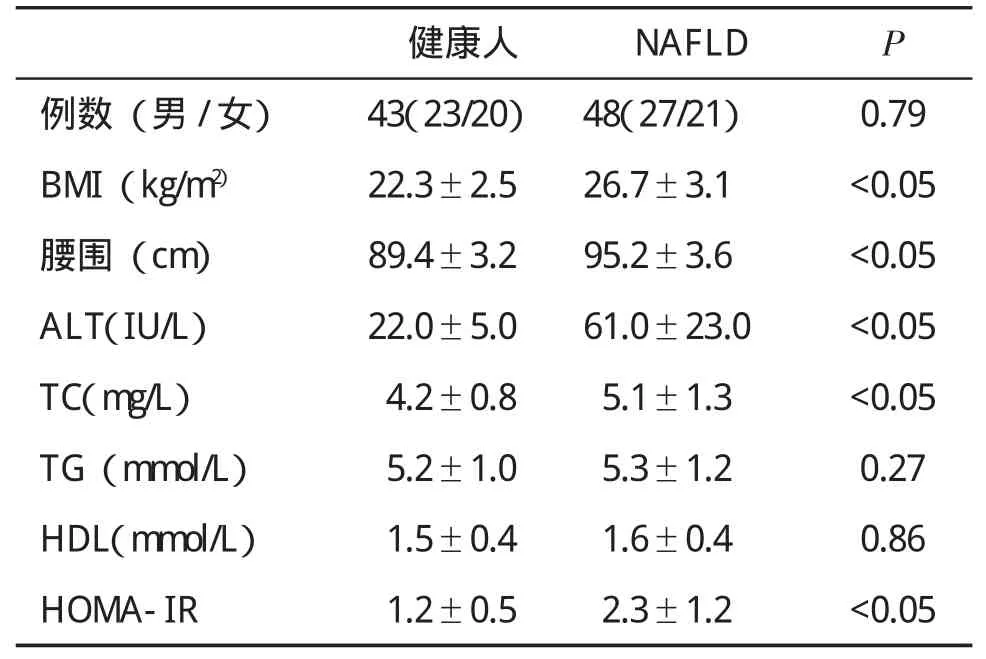
表1 两组人群基本情况(±s)比较
?
二、内皮功能和外周血管 NAFLD与健康人比,sICM-1和ET-1水平显著升高,而FMD明显降低,差异均有统计学意义(P<0.05)。同样,baPWV在NAFLD组明显升高,与健康人比,差异具有统计学意义(P<0.05,表2)。
表2 两组人群血管内皮功能、外周血管和粥样硬化指标(±s)的比较

表2 两组人群血管内皮功能、外周血管和粥样硬化指标(±s)的比较
健康人 NAFLD P sICM-1(ng/ml)85.4±17.3185.1±36.2 <0.05 ET-1(pg/ml)67.5±12.1104.8±19.3 <0.05 FMD(%)13.2±3.58.1±2.4 <0.05 ABI 1.1±0.81.2±0.70.92 baPWV(cm/s)13.6±2.415.5±2.3 <0.05 IMT(mm)0.76±0.181.31±0.35 <0.05颈动脉斑块(%)4(9.3)15(31.3)<0.05冠脉斑块(%)5(11.6)17(35.4)<0.05
sICM-1:可溶性细胞间黏附分子-1;ET-1:血内皮素-1;FMD:肱动脉血流介导的内皮依赖性舒张功能;ABI:踝臂血压比值;baPWV:臂踝脉搏波速度;IMT:颈动脉内膜中层厚度
三、变量间相关性分析 见表3。

表3 相关性(r)分析
讨论
动脉粥样硬化是渐进性的病理过程,内皮功能受损则是该过程的早期始动因素[6~8]。NAFLD是一种以低度全身炎症为特征的病理状态,血液中炎症因子升高增加了内皮细胞sICM-1和ET-1的分泌,同时降低了一氧化氮合酶的表达,进而导致血管内皮功能障碍[9]。肱动脉的FMD具有内皮依赖性,可间接反映血管的内皮功能。本研究显示NAFLD患者sICM-1和ET-1水平显著高于健康人,而FMD显著降低,均具有统计学意义,同时相关性分析发现sICM-1和ET-1与NAFLD呈正相关,提示NAFLD存在内皮功能损伤。
在目前无创动脉硬化检测中,动脉的脉搏波传导速度(PWV)和踝臂血压比值(ABI)已日益受到人们的关注。Kim等研究显示NAFLD人群中baPWV明显高于正常人群,且NAFLD患者肝功能受损程度与baPWV有着很强的关联性[10]。本研究表明NAFLD患者baPWV同样高于健康人,而两组ABI却无显著性差异,证实在NAFLD患者中baPWV能很好地反映全身动脉硬化程度。
颈动脉粥样硬化作为全身性动脉粥样硬化的一个表现,与心脑血管疾病冠状动脉硬化性心脏病和脑梗塞有密切的联系[11]。超声测量CIMT可以较好地反映AS程度。IMT≥1.2mm可以认为粥样斑块形成[12]。本研究中NAFLD患者IMT值及颈动脉粥样斑块检出率显著高于健康人,与国外报道一致[13,14]。此外,我们的研究还提示NAFLD患者冠状动脉粥样斑块检出率同样显著高于健康人,说明NAFLD是CVD的独立危险因素,NAFLD患者是临床上CVD的高危人群。
本研究显示NAFLD与CVD的发生密切相关,体现在内皮功能紊乱、外周血管硬化、IMT厚度增加及粥样斑块的检出率升高。因此,对于NAFLD患者,特别是脂肪性肝炎患者,应定期行内皮功能、外周动脉硬化及彩色多普勒超声检查,警惕可能存在的发生心血管事件的危险,并及时进行临床干预,以提高NAFLD患者的生活质量。
[1]Dowman JK,Tomlinson JW,Newsome PN.Systematic review:the diagnosis and staging of non-alcoholic fatty liver disease and non-alcoholic steatohepatitis.Aliment Pharmacol Ther,2011,33:525-540.
[2]Ratziu V,Bellentani S,Cortez H,et al.A position statement on NAFLD/NASH based on the EASL 2009 special conference.J Hepatol,2010,53:372-384.
[3]The Chinese National Workshop on Fatty liver and Alcohlic Liver Disease for the Chinese Liver Disease Association.Guidelines for management of nonalcoholic fatty liver disease:an updated and revised edition.Chin J Hepatol,2010,18:163-166.
[4]Ong JP,Pitts A,Younossi ZM. Ⅰncreased overall mortality and liver-related mortality in non-alcoholic fatty liver disease.J Hepatol,2008,49:608-612.
[5]Guangda X,Linshuang Z,Jie H,et al.Apo e4 allele is associated with endothelium-dependent arterial dilation in women with type 2 diabetes.Diabetes Res Clin Pract,2006,72:155-161.
[6]Ekstedt M,Franzen LE,Mathiesen UL,et al.Long-term followup of patients with NAFLD and elevated liver enzymes.Hepatology,2006,44:865-873.
[7]Targher G,Day CP,Bonora E.Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease.N Engl J Med,2010,363:1341-1350.
[8]Haukeland JW,Damas JK,Konopski Z,et al.Systemic inflammation in nonalcoholic fatty liver disease is characterized by elevated levels of CCL2.J Hepatol,2006,44:1167-1174.
[9]Abramowitz J,Dai C,Hirschi KK,et al.Ouabain-and marinobufagenin-induced proliferation of human umbilical vein smooth muscle cells and a rat vascular smooth muscle cell line,A7r5.Circulation,2003,108:3048-3053.
[10]Kim SG,Kim HY,Seo JA,et al.Relationship between serum adiponectin concentration,pulse wave velocity and nonalcoholic fatty liver disease.Eur J Endocrinol,2005,152:225-211.
[11]Nomura K,Hamamoto Y,Takahara S,et al.Relationship between carotid intima-media thickness and silent cerebral infarction in Japanese subjects with type 2 diabetes.Diabetes Care,2010,33:168-170.
[12]Dick TJ,Lesser ⅠA,Leipsic JA,et al.The effect of obesity on the association between liver fat and carotid atherosclerosis in a multi-ethnic cohort.Atherosclerosis,2013,226:208-213.
[13]Kucukazman M,Ata N,Yavuz B,et al.Evaluation of early atherosclerosis markers in patients with nonalcoholic fatty liver disease.Eur J Gastroenterol Hepatol,2013,25:147-151.
[14]Gokce S,Atbinici Z,Aycan Z,et al.The relationship between pediatric nonalcoholic fatty liver disease and cardiovascular risk factors and increased risk of atherosclerosis in obese children.Pediatr Cardiol,2013,34:308-315.
