原生动物Δ4-脂肪酸去饱和酶基因在卵巢细胞中的表达
2013-09-18汪坤福朱贵明江旭东王明富佳木斯大学黑龙江佳木斯154007
汪坤福 朱贵明 张 涛 孙 洁 江旭东 王明富 (佳木斯大学,黑龙江 佳木斯 154007)
多不饱和脂肪酸(PUFAs)在人体中具有重要的生理功能,特别是二十二碳六烯酸(DHA)、二十五碳五烯酸(EPA)等长链ω-3 PUFAs在促进大脑发育和功能维持以及在预防和治疗心血管疾病、炎症、癌症等多种疾病方面有着重要作用〔1,2〕。然而,人类及其他哺乳动物由于自身一些脂肪酸合成酶活性(例如Δ4-脂肪酸去饱和酶和Δ15-脂肪酸去饱和酶)的缺失导致其合成长链ω-3 PUFAs的能力很低,因此主要依靠从食物来源获取这类特殊的脂肪酸〔3〕。一种原生动物Euglena gracilis的Δ4-脂肪酸去饱和酶的编码基因在酵母中表达后能将EPA直接转变为DHA〔4〕。如果该酶活性能够在哺乳动物中实现表达,极有可能大大地提高哺乳动物DHA的水平。本研究拟构建Δ4-脂肪酸去饱和酶基因的哺乳动物表达载体,然后转染到哺乳动物中国仓鼠卵巢细胞(CHO)中,考察该基因在哺乳动物中RNA水平的表达情况。
1 材料与方法
1.1 材料 大肠杆菌(DH5ɑ)、质粒pcDNA3.1(-)为本实验室保存。CHO细胞购于中国协和医科大学。限制性内切酶、T4 DNA连接酶、RT-PCR试剂盒等购于宝生物工程(大连)有限公司。质粒提取试剂盒、PCR产物纯化试剂盒、胶回收试剂盒、基因组提取试剂盒等购于天根生化科技(北京)有限公司。转染试剂LipofectamineTM2000为Invitrogen公司产品。细胞培养所用培养基、血清、培养皿等为Hyclone产品。
1.2 Δ4-脂肪酸去饱和酶基因密码子的优化及合成 将原生动物Δ4-脂肪酸去饱和酶基因的密码子进行改造和优化设计,并按照优化设计后的基因序列进行人工合成全长基因(命名为D4,以下简称D4基因)。合成的基因连接到pMD18-T克隆载体,形成重组质粒pMD18T-D4。合成基因两端带有EcoRⅠ和HindⅢ双酶切位点。
1.3 D4基因克隆到真核表达载体pcDNA3.1(-) 将重组质粒pMD18T-D4与pcDNA3.1(-)一起用EcoRⅠ和HindⅢ进行双酶切,酶切产物利用胶回收试剂盒回收,再用DNA连接酶16℃过夜连接,次日取出连接产物转化感受态DH5ɑ,利用质粒电泳、酶切及测序等方法筛选和鉴定重组质粒的阳性克隆。
1.4 pcDNA3.1-D4稳定转染CHO细胞及其表达 将pcDNA3.1-D4重组质粒用SalⅠ和BglⅡ进行双酶切,酶切产物利用胶回收试剂盒回收,采用脂质体稳定转染的方法转染CHO细胞,用G418筛选1个月。收集细胞提取基因组DNA,用PCR方法鉴定基因整合情况。提取总RNA,RT-PCR检测D4基因表达情况。基因组和 RT-PCR的检测引物一致:上游引物D4d-s:5'TCATCATCAACCACATCAGCGAG 3',下游引物 D4-a:5'TTTAGCTCTTCTTGTCGCCGTTG 3'。PCR扩增时退火温度为60℃,延伸30 s,循环30次,产物长度为426 bp。并以β-actin作为内参照,上游引物5'CTGAGAGGGAAATCGTGCGTGAC3',下游引物5'TGCCACAGGATTCCATACCCAAG3',PCR扩增时退火温度为62℃,延伸10 s,循环30次,产物大小为210 bp。PCR后取5 μl反应液进行电泳并观察结果。
2 结果
2.1 成功构建表达载体pcDNA3.1-D4 将纯化的重组质粒pMD18T-D4利用EcoRⅠ和HindⅢ双酶切,酶切回收后,D4基因大小约为1 600 bp,连接到同样用EcoRⅠ和HindⅢ双酶切的pcDNA3.1(-)载体,经过筛选和酶切鉴定获得一个阳性克隆,双酶切小片段为1 600 bp,与连接前一致,经过测序鉴定目的基因没有发生突变。见图1。

图1 pcDNA3.1-D4表达载体的构建
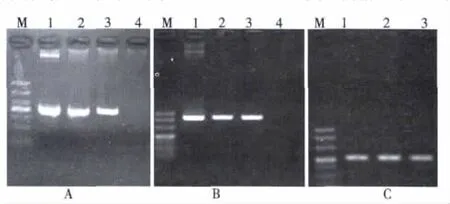
图2 D4基因稳定转染整合及RT-PCR结果
2.2 D4基因稳定转染CHO细胞后整合情况及其表达 图2可见,将线性化的约4 800 bp的基因片段用LipofectamineTM2000稳定转染CHO细胞,用900 μg/ml的G418筛选10~15 d后,用半量筛选浓度维持,筛选得到pcDNA3.1-D4-CHO细胞株,收集细胞提取基因组DNA鉴定D4基因整合情况,D4基因稳定整合到CHO细胞的基因组中,与pcDNA3.1-D4质粒阳性对照相比,整合进CHO细胞基因组的D4基因的量比较多。进一步收集细胞,提取总RNA做RT-PCR,结果表明D4基因整合到CHO细胞后,能够实现超表达,成功实现了原生动物基因在哺乳动物细胞中的过表达。β-actin内参的表达情况进一步证实了D4基因在CHO细胞中的高表达。
3 讨论
将经过密码子优化后的原生动物D4基因进行人工合成,并连接到哺乳动物表达载体pcDNA3.1(-)之后获得重组质粒pcDNA3.1-D4。本实验如预期实现了D4基因在RNA水平的表达。此外,通过瞬时转染CHO细胞,能够高效发挥△4去饱和酶活性,将DPA转化成DHA,表明该基因能够在哺乳动物细胞内实现蛋白水平的表达并发挥功能,补充了哺乳动物原来缺乏的△4去饱和酶活性。但是要从其他低碳链不饱和脂肪酸生成高含量的DHA,还需要其他延长酶类和去饱和酶类的协同作用。DHA的生物合成途径及其机制尚不完全清楚。目前有两种观点,一种认为在EPA(20∶5n-3)合成后进行2个碳的延长生成DPA(22∶5n-3),再经过△4去饱和酶作用产生DHA(22∶6n-3)。但哺乳动物中一直未发现△4去饱和酶活性,因此,该观点未获得广泛认可。另一种观点是认为EPA(20∶5n-3)延伸为DHA(22∶5n-3)继续延伸为24∶5n-3,然后迅速被△6去饱和酶作用生成24∶6n-3,之后进一步经β-氧化作用产生22∶6n-3,即所谓的Sprecher通路〔5,6〕。本研究将原生动物 D4基因转入哺乳动物细胞中,实现了该基因在转录水平的表达,为进一步研究其在哺乳动物中合成DHA的功能打下基础。在哺乳动物细胞构建EPA-DPA-DHA的合成路径,从而提高DHA在哺乳动物细胞中的合成量。
1 Lavie CJ,Milani RV,Mehra MR,et al.Omega-3 polyunsaturated fatty acids and cardiovascular diseases〔J〕.J Am Coll Cardiol,2009;54(7):585-94.
2 Duda MK,O'Shea KM,Stanley WC.Omega-3 polyunsaturated fatty acid supplementation for the treatment of heart failure:mechanisms and clinical potential〔J〕.Cardiovasc Res,2009;84(1):33-41.
3 Fetterman Jr JW,Zdanowicz MM.Therapeutic potential of n-3 polyunsaturated fatty acids in disease〔J〕.Am J Health Syst Pharm,2009;66(13):1169-79.
4 Meyer A,Cirpus P,Ott C,et al.Biosynthesis of docosahexaenoic acid in Euglena gracilis:biochemical and molecular evidence for the involvement of a Delta4-fatty acyl group desaturase〔J〕.Biochemistry,2003;42(32):9779-88.
5 Huang YS,Pereira SL,Leonard AE.Enzymes for transgenic biosynthesis of long-chain polyunsaturated fatty acids〔J〕.Biochimie,2004;86(11):793-8.
6 Zhang L,Ramtohul Y,Gagné S,et al.A multiplexed cell assay in hepG2 cells for the identification of Delta-5,Delta-6,and Delta-9 desaturase and Elongase inhibitors〔J〕.J Biomol Screen,2010;15(2):169-76.
