产铁载体抗镉微生物的筛选
2013-09-17朱生翠曾晓希汤建新魏本杰邹春城谢成林
朱生翠,曾晓希,汤建新,魏本杰,廖 毅,邹春城,谢成林
(湖南工业大学 绿色包装与生物纳米技术应用重点实验室,湖南 株洲 421007)
0 引言
随着工业的迅速发展,株洲市的工业“三废”对环境的污染也日趋严重,具有代表性的清水塘工业区污染达到高峰程度,成为全国环境污染严重的地区之一[1]。在各类污染物中,重金属镉的污染较为严重。镉是有毒的重金属,不仅影响植物和动物生长,并且通过食物链对人类身体健康造成危害。清水塘地区的镉污染不仅会影响附近居民的生活,而且成为下游湘潭、长沙2市饮用水源安全的重大隐患,因此,清水塘地区的镉污染治理已刻不容缓[2]。
目前植物-微生物联合修复是环境友好、经济有效的原位修复技术,是重金属污染治理的重要手段之一。但是用于污染土壤修复的植物通常生长缓慢、生长周期长且生物量低,对生物有效性低的重金属不易吸收,极大地影响了修复效率[3]。微生物不能直接降解重金属,并且会受到重金属的毒害作用,但是微生物能吸附和转化某些重金属,使重金属的生物有效性增加,促进植物对重金属的富集作用。R.A.Abou-Shanab等[4]报道根际细菌(microbacterium arabinogalactanolyticum)的促进土壤稳定态Ni的释放,显著增加了超富集植物Alyssummurale根际生物有效态Ni的浓度,Alyssummurale地上部Ni的浓度增加32%。产铁载体微生物对植物生长和重金属吸收有进一步的促进作用[5]。微生物分泌的铁载体富集的铁元素,提高了土壤难溶铁的溶解性,从而提高铁的有效性,植物可以直接吸收利用,大大增加对植物的有效性,促进植物的生物量增加,此外,铁载体也能活化Cd等重金属,所以植物-产铁载体微生物联合体的筛选与培育是目前联合修复技术研究的重点[6-8]。
本实验以清水塘地区的土壤为研究对象,首先进行土壤中耐镉微生物的筛选,再从抗镉微生物中筛选产铁载体菌,获得可用于污染土壤生物治理的高效耐受产铁载体菌种。对筛选出来的细菌和真菌分别通过染色、插片法和扫描电镜观察其形态特征,为植物微生物联合修复重金属污染土壤的研究及广泛应用提供菌种资源。
1 材料和方法
1.1 样品采集
土壤样品采自株洲市清水塘工业区株洲冶炼厂附近土壤(采样深度为0~20 cm),该地区属中亚热带季风湿润气候区,年均气温17.5 ℃,年均降雨量1 391.9 mm,年均风速为2.2 m/s,常年主导风向为西北偏北风,夏季为偏南风。
1.2 培养基及药品配制
牛肉膏蛋白胨培养基:蛋白胨的质量浓度为10 g/L,氯化钠的质量浓度为5 g/L,牛肉膏的质量浓度为5 g/L,琼脂的质量浓度为20 g/L,pH 7.2。
检测平板配方:染液含浓度为l mmol/L镉天青,0.1 mmol/L FeCl3,4 mmol/L十六烷基三甲基溴化胺(hexadecyl trimethyl ammonium bromide,CTAB),0.1 mol/L磷酸盐缓冲液(每100 mL含Na2HPO4·12H2O 2.427 g,NaH2PO4.2H2O 0.590 5 g,KH2PO40.075 g,NH4C1 0.250 g,NaCl 0.125 g,使用时10倍稀释),pH 6.8。
CAS检测平板:每100 mL含质量分数为20%蔗糖溶液1 mL,纯牛奶10 mL,浓度为1 mmol/L CaCl2100 uL,1 mmol/L MgSO42 mL,琼脂1.8 g,在约60 ℃时缓慢加入盐溶液和染液各5 mL,即得检测培养基。所有溶液均用去离子水配制[9-11]。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯(去皮)200 g,葡萄糖20 g,琼脂15~20 g,水1 000 mL,pH自然。
1.3 试验方法
1.3.1 抗镉菌株的分离及纯化
准确称取采集的土样10 g,加入90 mL加有玻璃珠的无菌水中,制成土壤悬液,于150 r/min转速下充分振荡10 min,待孢子分散后,静置5 min,取上清液,采用10倍连续稀释法将土壤悬液稀释至10-5,选择10-3, 10-4, 10-5这3个稀释度,分别将土壤悬液涂布在含有浓度为1.0,1.5,2.0 mmol/L CdSO4·8H2O的牛肉膏蛋白胨培养基上,每个稀释度做3个平行试验,且以不添加CdSO4·8H2O为空白试验,在30 ℃恒温培养箱中培养1~5 d。挑选具有生长优势的单个菌落重复划线2~3次,同时镜检其纯度,直至获得纯培养菌株,保存留用。
1.3.2 产铁载体菌株的筛选
将纯化后的抗镉菌种采用划线法转接到检测平板上,在30 ℃恒温培养箱中培养1~7 d,每12 h观察一次结果,挑选发生变粉色反应的菌种进行纯化,保存留用。
1.3.3 菌株的形态特征
根据濡化理论和文化身份理论,理想的外语学习者应该既对目的语文化有深入的了解,又对母语文化具有深刻的认同。
取对数期的目的细菌进行革兰氏染色,在显微镜下观察并作记录;将纯化的真菌采用划线法转接到PDA培养基上,在所划线的部分插入已灭菌的盖玻片,在28 ℃恒温培养箱中倒置培养3~7 d。SEM(scanning electron microscope)观察真菌的形态学特征并作记录,分别参照《常见细菌系统鉴定手册》和《真菌鉴定手册》进行初步鉴定[12]。
1.3.4 菌株Cd2+最低抑菌浓度的测定
菌悬液的配制:从保存3株菌的试管斜面挑出一环菌,分别接种到PDA培养基斜面上,待菌株长出后,添加无菌水,配成菌悬浊液,准备接种。
取1 mL菌悬液,加入49 mL不同质量浓度的重金属离子液体培养基中(重金属质量浓度分别为400,500, 600, 1 000, 1 200 mg/L),于28 ℃和150 r/min条件下振荡培养3 d后,涂平板计数[13-14],重复3次。
2 结果
2.1 产铁载体抗镉菌株的筛选
从含镉牛肉膏蛋白胨固体培养基上共选出生长良好、菌落特征不同的菌株19株,其中6株细菌分别标号为X3, X15, X16, X18, X19, X22,13株真菌分别标号为Z1,Z2,Z4,Z5,Z6, Z8, Z9, Z10, Z13, Z14, Z20, Z21,Z23。将以上筛选出的19株菌种通过CAS固体检测,其检测结果见图1。
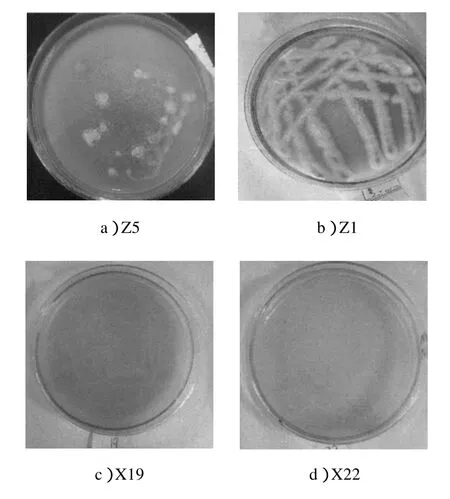
图1 菌株铁载体检测结果Fig.1 The detection results for siderophores strains
固体检测培养基上培养7 d后,待测菌株都长出了明显的单菌落,但是仅接种菌株X19, X22和Z1的固体检测平板发生了明显的颜色变化,X19, X22变为粉红色,Z1菌丝由白色转变为粉红色,本实验现象和蒙渊在铁载体阳性菌株筛选实验中的现象一致[15]。结果说明,菌株X19, X22和Z1可以分泌铁载体,而菌株Z5(如图1a所示)作为对照,在CAS固体检测平板上没有发生变色反应,说明Z5不能分泌铁载体。
2.2 X19, X22和Z1的初步鉴定
细菌X19, X22经革兰氏染色后,在显微镜下观察,结果如图2~3所示。
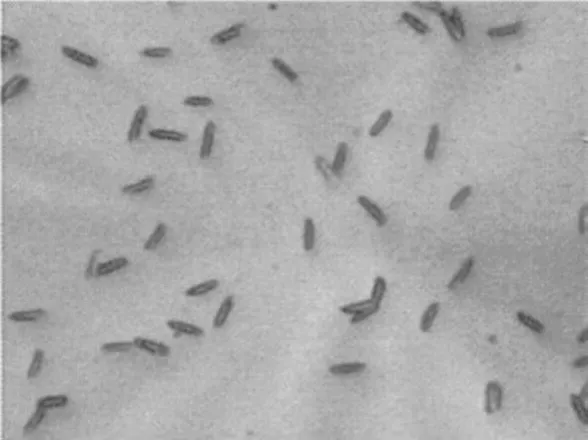
图2 细菌X19(10×100)Fig.2 Bacterium X19(10×100)

图3 细菌X22(10×100)Fig.3 Bacterium X22(10×100)
由图2和3可看出,X19, X22都为革兰氏阴性菌,菌体呈直杆状,1.1~1.5m×2.0~6.0m,根据《常见细菌系统鉴定手册》,初步鉴定X19, X22都为肠杆菌科埃希氏菌属。
将纯化的真菌插片培养在PDA培养基上,在28℃恒温培养箱中倒置培养3~7 d后Z1菌丝呈白色,SEM观察真菌的形态特征,Z1的扫描电镜结果如图4~5所示。

图4 Z1菌丝体Fig.4 The mycelium of Z1
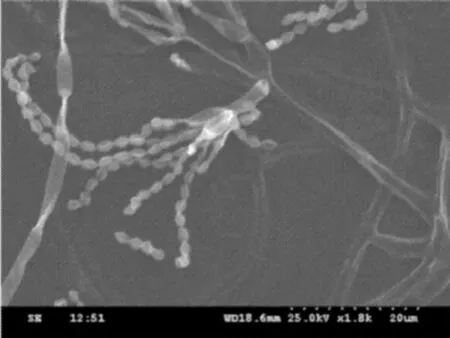
图5 Z1孢子丝Fig.5 The spore hypha of Z1
由图4可看出,Z1具有发达的菌丝体,整个菌丝体是由基内菌丝、气生菌丝和繁殖菌丝组成的。由图5可看出,子囊壳有发达程度不同的包被,无孔口,子囊排列不规则,短而宽阔,子囊孢子光滑,子囊果有大型柄,气生菌丝上产生简单的长而直立的分生孢子梗,分生孢子梗长4.7~8.0m,顶端以特殊的对称或不对称扫帚状分支,称为帚状枝,分支为多极的分生孢子梗产生的瓶梗,在瓶梗上有串生分生孢子,分生孢子为球形至卵形,0.6~2.5m×0.4~2.3m,根据以上形态特征,参照《真菌鉴定手册》,初步鉴定Z1为真菌界子囊菌门散囊菌纲散囊菌目曲霉属。
2.3 镉离子最低抑菌浓度
最低抑菌浓度(minimal inhibitory concentration,MIC)是指在体外实验中,各种重金属能抑制菌体生长的最低浓度,MIC值越大,重金属对菌体的毒性越小;MIC值越大,菌体对重金属的抗性就越大[13]。随着镉离子浓度的增大,培养基中菌落数呈下降趋势。Cd2+浓度对菌落数的影响曲线如图6所示。

图6 镉离子浓度对X19, X22, Z1菌落数的影响Fig.6 Effect of Cd2+ concentrations on thegrowth of X19, X22 and Z1
图6表明:随着Cd2+浓度的增大,3株菌存活的菌落数呈下降趋势。重金属质量浓度在100~260 mg/L范围时,对微生物的生长繁殖影响不大;质量浓度继续升高,当达到一个临界值时,重金属离子对菌体产生较为严重的毒害作用,菌体的生长繁殖明显受到抑制,菌落数急剧下降。不同菌株MIC有所不同:X19的MIC约为450 mg/L,X22约为220 mg/L,Z1的MIC最大,约为800 mg/L。
3 讨论
微生物通过吸附和转化某些重金属,使重金属的生物有效性增加,微生物吸附重金属离子的机理十分复杂,按是否消耗能量分为活细胞吸附及死细胞吸附两种。革兰氏阳性细菌的细胞壁中含有较多的磷壁酸,带有较强的负电荷,能吸附阳离子[16]。微生物通过氧化-还原作用或烷基取代作用等转化重金属,使重金属从一种形态转化为另一种形态,如嗜酸铁氧化细菌能够氧化Fe2+、还原态的S和金属硫化物来获得能源,影响重金属的活动性。不同的微生物活细胞内积累重金属离子的能力存在很大差异,过量的重金属离子对微生物的生长也会产生毒害作用[17]。因此,经抗镉试验中筛选出了19种积累重金属优势菌株。
铁载体是由生活在开放环境中的好氧和兼性好氧微生物为适应地球地壳高氧低铁环境下生长代谢的需要而产生的一种高铁离子鳌合剂。它能够与四价的锕系元素形成稳定的化合物,铁载体还能影响其它金属如铜、锌、钙和铅在土壤中的运动性[18]。微生物分泌的铁载体能富集铁元素,提高土壤难溶铁的溶解性,从而提高铁的有效性,增加植物的有效性,促进植物生物量的增加[19]。
CAS平板检测法可以用于大多数细菌和真菌分泌的铁载体检测,适合于初步筛选产铁载体的菌株,该检测方法比较简单、方便。本研究从19种抗镉微生物中筛选到2株产铁载体菌株,依据变色程度初步断定产铁载体能力为X19>X22>Z1。对抗镉和产铁载体筛选试验获得的X19, X22和Z1进行初步鉴定,X19,X22都为肠杆菌科埃希氏菌属,Z1为真菌界子囊菌门散囊菌纲散囊菌目曲霉属。
本研究分离到的菌株X19, X22和Z1对镉有较强的耐抗性,在MIC实验中,Z1对镉的耐抗性高达1 000 mg/L,表明其在以镉污染为主的土壤微生物修复中具有巨大的潜在价值,但对其作用机理和绝对抗镉能力和目的菌种的鉴定还有待进一步研究,以期为植物-微生物联合修复提供可能的高效菌种资源。
[1] 刘扬林,蒋新元. 株洲市白马乡土壤和农作物重金属污染评价[J]. 土壤,2004,36(5):551-556.Liu Yanglin,Jiang Xinyuan. Evaluation of Heavy Metal Pollution of Soil and Crops in Baima Village Zhuzhou City[J]. Soil,2004,36(5):551-556.
[2] 窦佩琼,候方东,包晓风,等. 株洲市清水塘工业区地表水底泥重金属污染评价[J]. 四川环境,2008,27(4):74-78.Dou Peiqiong,Hou Fangdong,Bao Xiaofeng,et al.Evaluation of Heavy Metals Pollution in Bottom Sediment of Surface Water in Qingshuitang District of Zhuzhou City[J]. Sichuan Environment,2008,27(4):74-78.
[3] 陈 苏,孙铁珩,孙丽娜,等. Cd2+、Pb2+在根际和非根际士壤中的吸附-解吸行为[J]. 环境科学,2007,28(4):843-851.Chen Su,Sun Tieheng,Sun Li’na,et al. Sorption-Desorption Behavior of Cd2+and Pb2+in Rhizosphere and Bulk Soil[J]. Environmental Science,2007,28(4):843-851.
[4] Abou-Shanab R A,Aangle J S,Delorme T A,et al.Rhizosbacterial Effects on Nickel ExtractionfromSoil and Uptake by Alyssummurale[J].NewPhytologist,2003,158(1):219-224.
[5] Guerinot M L. Microbial Iron Transport[J]. Annual Review Microbiology,1994(48):743-772.
[6] 崔艳华,董爱军,曲晓军. 微生物铁载体运输系统[J]. 生命的化学,2008,28(6):786-790.Cui Yanhua,Dong Aijun,Qu Xiaojun. Siderophores-Mediated Iron Uptake System of Microorganisms[J].Chemistry of Life,2008,28(6):786-790.
[7] Gonihen F,Gloter A,Guyot F,et al. Cr(Ⅵ) Detoxification by Desulfovibrio Vulgaris Strain Hildenborough:Microbemetal Interactions Studies[J]. Applied Microbiology and Biotechnology,2006,71:892-897.
[8] Hofte M.Classes of Microbial Siderophore[M]//Iron Chelation in Plants and Microorganisms.SanDiego:Academic Press ,1993:3-26.
[9] 赵 翔,谢志雄,陈绍兴,等. 适合高产铁载体细菌筛选、检测体系的改进与探析[J].微生物学通报,2006,33(6):95-98.Zhao Xiang, Xie Zhixiong,Chen Shaoxing,et al.Improvement and Analysis in Over-Siderophores Production Bacteria Filtrating and Detecting[J]. Microbiology China,2006,33(6):95-98.
[10]陈绍兴,赵 翔,沈 萍,等. 高灵敏假单胞菌铁载体的平板检测方法[J].微生物学通报,2006,33(3):122-127.Chen Shaoxing,Zhao Xiang,Shen Ping,et al. High-Sensitive Detection Method for Siderophores from Pseudomonas[J]. Microbiology China,2006,33(3):122-127.
[11]Perez-Miranda S,Cabirol N,George-Telez R,et al.OCAS,A Fast and Universal Method for Siderophore Detection[J]. Journal of Microbiologieal Methods,2007,70(1):127-131.
[12]周德庆. 微生物学教程[M]. 北京:高等教育出版社,2008:11-15.Zhou Deqing. Microbiology Course[M]. Beijing:Higher Education Press,2008:11-15.
[13]Vali X M,Loon L O. Adaptive to Lerance Behaviour of Fungi in Heavy Metals[J]. Minerals Engineering,2003,16(3):193-198.
[14]Yilmaz E I. Metal Tolerance and Biosorptioncapacity of Bacillus Circulans Strain EB1[J]. Research in Microbiology,2003,154(6):409-415.
[15]蒙 渊. 产铁载体和ACC脱氨酶的氢氧化细菌筛选及促生作用研究[D]. 陕西:西北大学,2011.Meng Yuan. Research on Screening of the Hydrogen-Oxidizing Bacteria Secreting the Siderophore and the ACC Deaminase and Its Growth-Promoting Mechanism[D].Shanxi:Northwest University,2011.
[16]陈佩林. 微生物吸附重金属离子研究进展[J]. 生物学教学,2003,28(12):1-3.Chen Peilin. Research Progress of Microbial Adsorption of Heavy Metal[J]. Biology Teaching,2003,28(12):1-3.
[17]Ledin Maria. Accumulation of Metals by Microorganisms Processes and Importance for Soil System[J]. Earth-Science Reviews,2000,51(1):1-31.
[18]NeubauerU, Nowak B, Furrer G, et al. Heavy Metal Sorption on Clay Minerals Affected by the Siderophore Desferrioxamine B[J]. Environmental Science &Technology,2000,34(13):2749-2755.
[19]孙红启. 黑曲霉An76铁载体研究[D]. 济南:山东大学,2005.Sun Hongqi. The Researching of Aspergillus Niger An76 Siderophores[D]. Jinan:Shan Dong University,2005.
