金黄色葡萄球菌焦磷酸测序检测及耐药研究
2013-09-17袁慕云卓锦雪许龙岩陈碧玲
袁慕云 卓锦雪 许龙岩 陈碧玲 张 旺
(广东出入境检验检疫局 广东广州 510623)
1 前言
金黄色葡萄球菌在食品污染病例中占据十分重要的位置,同时也是医院临床感染导致肺炎及伤口感染的主要病原菌。随着抗生素的广泛应用,金黄色葡萄球菌对目前使用的各种抗生素呈现出越来越普遍的耐药性,并表现为多重耐药,给临床治疗带来了很大困难[1-4]。本研究根据金黄色葡萄球菌的nor A基因序列分别设计扩增引物和测序引物,用PCR-焦磷酸测序从DNA碱基序列水平上检测金黄色葡萄球菌,用Vitek2进行药敏试验,分析金黄色葡萄球菌耐药情况。
2 材料和方法
2.1 材料
2.1.1 菌株信息
金黄色葡萄球菌共28株:MRSA(耐甲氧西林金黄色葡萄球菌)临床分离株9株,菌株编号为JPA-JPI;不同食品中分离株MSSA(甲氧西林敏感金黄色葡萄球菌) 19株,菌株编号为JP1-JP19,菌株信息按文献5。
阴性对照菌株8株:分别为单增李斯特菌ATCC19115、阪崎肠杆菌ATCC29544、藤黄微球菌CMCC28001、痢疾志贺氏菌NICPBP51252、小肠结肠炎耶尔森氏菌CMCC52221、肺炎克雷伯氏菌CMCC46102、粪链球菌ATCC2921、大肠杆菌ATCC25922。
上述菌株来自中国药品生物制品鉴定所、华南理工大学食品学院和广东出入境检验检疫局技术中心,且均经过VITEK 2和API试剂条确证。
2.1.2 主要仪器
焦磷酸测序PyroMark lD系统:瑞典Biotage公司;PCR扩增仪:PE 9700型;核酸提取仪:日本PSS公司。
2.1.3 试剂
PCR用Buffer、d NTP、琼脂糖、PCR分子量标记(50-500 bp)、Taq酶:大连宝生物工程有限公司;焦磷酸测序用试剂:QIAGEN上海办事处;7.5 %氯化钠肉汤:北京陆桥有限公司。
2.2 方法
2.2.1 引物设计
根据G e n B a n k公布的金黄色葡萄球菌n o r A基因( Gen B an k:D 9 0 11 9.1 )中保守区域,用Py r o M ar k A ssay D esig n 2.0软件设计引物和测序引物,上游引物5’-CGAGAGTGATTGGTGGTATGAGTG-3’,下游引物5’-CGCTGACATGTAGCCAAAGTTTT-3’,测序引物5’-TGGTGTGACAGGTTTAATAG-3’,下游引物5’端标记生物素,扩增片段大小113bp,委托宝生物工程(大连)有限公司合成。
2.2.2 模板制备、PCR扩增体系、电泳参数、单链模板制备及焦磷酸测序
模板制备、PCR扩增体系、电泳参数 、单链模板制备及焦磷酸测序,按文献6进行。
2.2.3 焦磷酸测序结果判断
从NCBI网站的BLAST功能反复比对分析发现,利用nor A基因测序引物后的30个连续DNA碱基序列5’-CTGACATTTC ACCAAGCCAT CAAAAAGCA-3’,可达到鉴定金黄色葡萄球菌的目的,因此本研究判断结果的依据为:测序的30个DNA碱基序列与上述序列100%匹配,则判断为金黄色葡萄球菌。
2.2.4 药敏试验
参照文献5和文献7,用AST-GP67药敏卡,在Vitek 2上对28株金黄色葡萄球菌进行药敏试验。质控菌株为为MRSA ATCC29213、MRSS ATCC25923。
3 结果与分析
3.1 PCR扩增结果
28株金黄色葡萄球菌均扩增出113bp大小的nor A基因DNA片段(图1,本研究只列出20株金黄色葡萄球菌电泳图),而单增李斯特氏菌等对照菌株未见扩增条带(图略)。

图1 金黄色葡萄球菌nor A基因PCR扩增电泳图
3.2 焦磷酸测序结果
根据模板浓度等条件的不同,28株金黄色葡萄球菌分别测出37bp-42bp长短不等的DNA碱基序列(表1),图2、图3为JPA、JP5焦磷酸测序结果图,而单增李斯特菌等8株对照株未测出DNA碱基序列。测序结果分别与测序引物后的DNA序列比对,发现100%匹配的DNA碱基数为34bp-40bp,所有有效测序结果均超过30个碱基(表1),表明测序引物的特异性较好,扩增体系优化较佳,并且可用CTGACATTTC ACCAAGCCAT CAAAAAGCA 碱基序列特异性地检测金黄色葡萄球菌。

表1 金黄色葡萄球菌焦磷酸测序检测结果
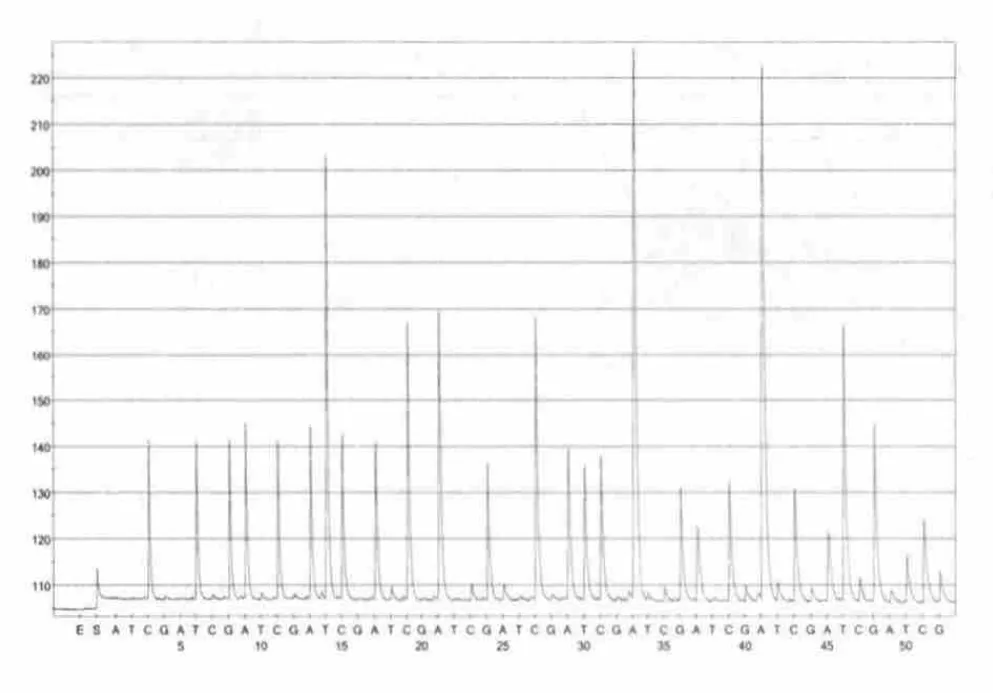
图2 JPA焦磷酸测序结果图
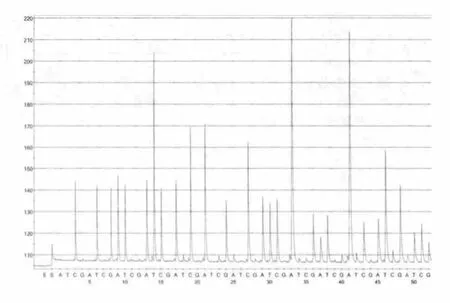
图3 JP5焦磷酸测序结果图
表1显示,JPA、JP3、JP5、JP6、JP7、JP1 7等6株菌株第5个碱基均为T,在N CB I网站查找金黄色葡萄球菌n o r A基因序列(GenBank:D90119.1), 发现该位点的碱基为C,表明试验菌株在该位点发生了C-T突变。查找nor A基因编码的蛋白氨基酸序列,共389个氨基酸,突变位点是nor A基因第354个碱基、118个氨基酸-天冬氨酸位点,该位点发生C-T的突变后,密码子GAC变成GAU,而两个密码子都是天冬氨酸的密码子,表明该基因表达的nor A蛋白氨基酸序列无变化;JP3、JP5、JP17等3株菌的第28个碱基均为T,同样在NCBI网站查找nor A基因序列, 该位点的碱基为C,表明试验菌株在该位点发生了C-T突变,突变位点是nor A基因的第377个碱基、126个氨基酸-丙氨酸位点,该位点发生C-T的突变后,密码子GCA变成 GUA,查密码子表,GCA是丙氨酸氨的密码子,GUA是缬氨酸密码子,表明nor A基因编码的蛋白氨基酸序列发生了改变。
3.3 耐药试验结果
28株金黄色葡萄球菌有14种耐药谱,其中NA 1:4株;NA 2:6株;NA 11、NA 13:各3株;NA9 、NA14:各2株;NA3、NA4、NA5、NA 6、NA7、NA8、NA 10、NA 12:各1株。具体见表2。
28株菌株对亚胺培南、万古霉素、替考拉宁、利福平等8种抗生素均敏感;对青霉素的耐药率最高,共有20株,占71.4%;其次为红霉素、苯唑西林和四环素,分别占35.7%、32.1%和28.6%。对青霉素耐药的20株菌株中,MRSA 9株,MSSA 11株;对苯唑西林耐药的9株菌株均为MRSA。具体见表2、表3。
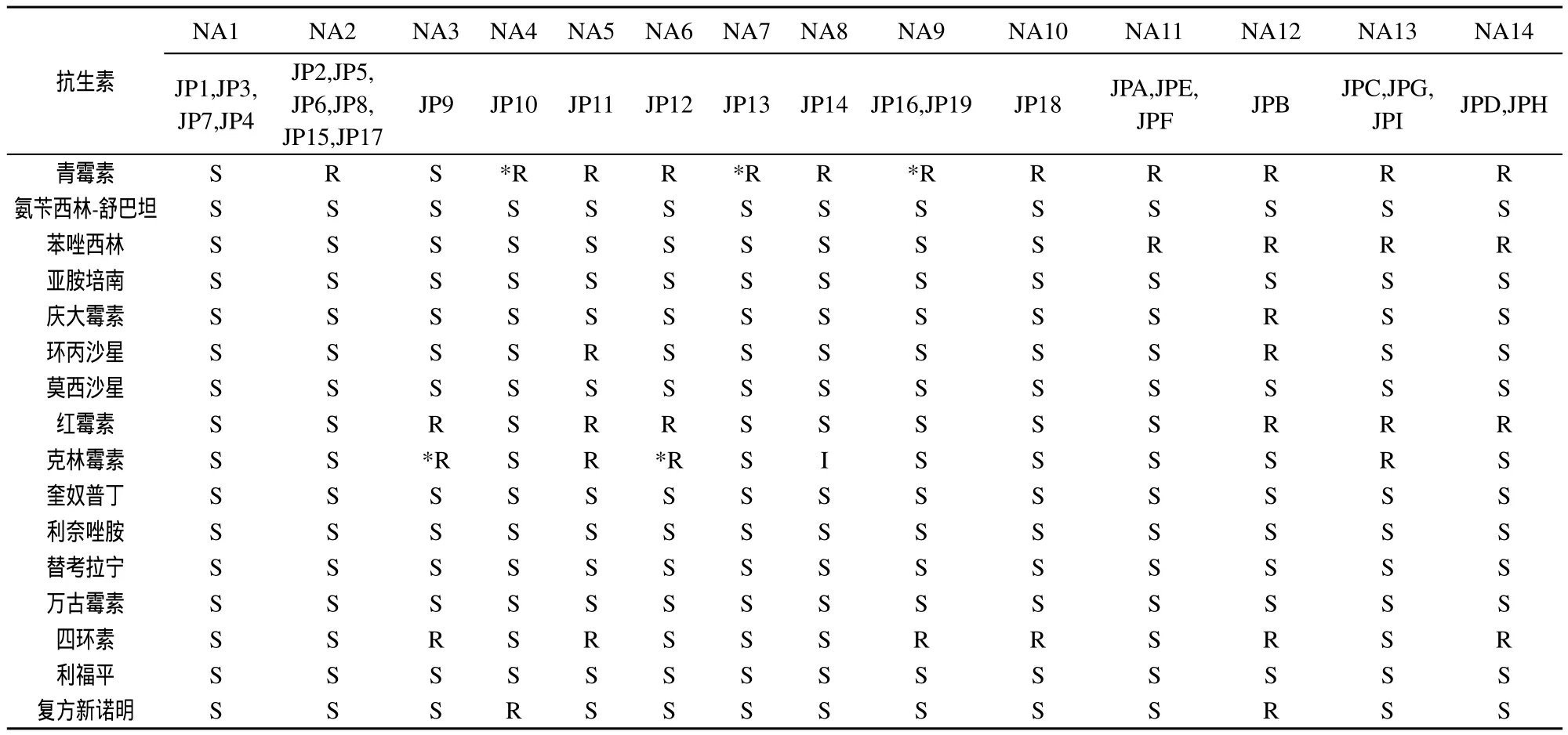
表2 8株金黄色葡萄球菌药敏试验结果
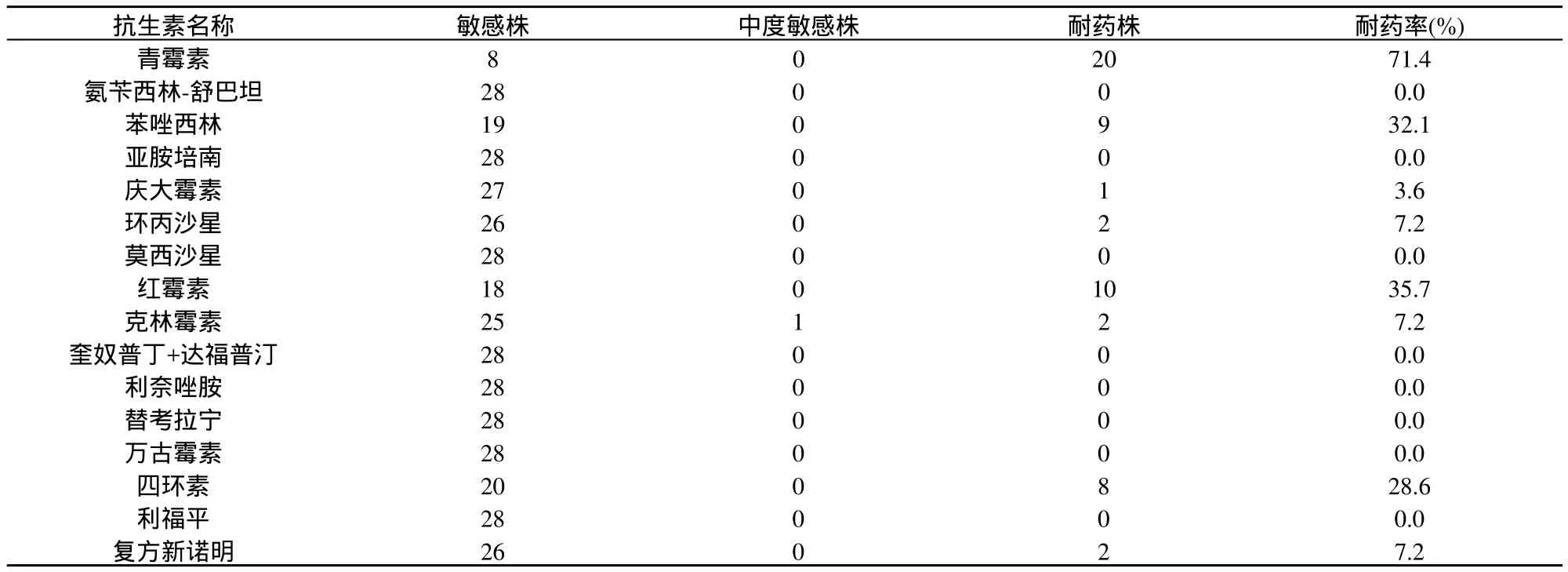
表3 28株金黄色葡萄球菌耐药率
4 讨论
目前金黄色葡萄球菌的耐药性日益恶化,特别是其对氟喹诺酮类和β-内酰胺类药物呈现超强耐药。随着细菌耐药性研究的深入,外输泵nor A基因介导的氟喹诺酮耐药性逐渐引起人们的重视,不同菌株中该主动外排介导的耐药性表现程度成为人们考查的重点[8-11]。大量研究表明,nor A基因介导的金黄色葡萄球菌对FQNS耐药相当普遍[12-13],因为nor A基因是金黄色葡萄球菌的结构基因,其编码的nor A蛋白能将亲水性氟喹诺酮类药物自菌体内主动泵出,使药物在菌体内蓄积减少。
本研究根据nor A基因序列分别设计扩增引物和测序引物,用PCR-焦磷酸测序从DNA碱基序列水平上检测金黄色葡萄球菌,用Vitek2进行药敏试验,分析金黄色葡萄球菌耐药情况。28株金黄色葡萄球菌均扩增出大小113bp大小的DNA片段,焦磷酸测序结果与nor A基因测序引物后的碱基序列比对,100%匹配的碱基数均超过30个DNA碱基序列,而其他如单增李斯特氏菌等对照菌株PCR扩增结果和焦磷酸测序结果均阴性,表明用nor A为目的基因,可特异性检测金黄色葡萄球菌。
耐药试验结果显示,28株金黄色葡萄球菌有14种耐药谱,其中9株MRSA有4种耐药谱,19株MSSA有10种耐药谱。MRSA耐药谱中,NA11耐药谱的3株菌株对两种抗生素耐药,其他3种耐药谱的6株菌株均是多重耐药菌。MSSA耐药谱中,NA5 耐药谱的JP11对5种抗生素耐药,JP11是鳗鱼中分离的菌株,表明在鳗鱼养殖过程中使用了较多的抗生素,出现多重耐药菌。分析nor A基因突变对喹诺同类抗生素的耐药情况,发现对喹诺酮类抗生素环丙沙星耐药的菌株为NA 5耐药谱中的JP11和NA12耐药谱中的JPB,而发生突变的6株菌株JPA、JP3、JP5、JP6、JP7、JP17分布在NA1、NA2和NA11 等3种不同的耐药谱中,均对喹诺酮类抗生素敏感。表明,nor A基因第354和377碱基位点的突变与喹诺酮类抗生素耐药性无关。
5 结论
n or A基因可作为金黄色葡萄球菌分子鉴别的的参考基因,并且可用CTGA CATTTC ACCAAGCCAT CAAAAAGCA 碱基序列特异性地检测金黄色葡萄球菌;nor A基因第354和377碱基位点的突变与喹诺酮类抗生素耐药性无关。
[1] 杨自华,刘秋芹,吴劲松,等.某院2012年金黄色葡萄球菌感染分布及其耐药性分析[J].国际检验医学杂志,2013,34(13):1698-1702.
[2] 王登峰,李建军,段新华,等.我国牛源金黄色葡萄球菌耐药现状及药敏检测方法探讨[J].中国动物传染病学报,2011,19(1):31-38.
[3] 姜延龙,张宇,田波,等.PCR技术检测金黄色葡萄球菌进展[J].食品科学,2006,27(5): 265-269.
[4] 王登峰,李建军,段新华,等.我国牛源金黄色葡萄球菌耐药现状及药敏检测方法探讨[J].中国动物传染病学报,2011,19(1):31-38.
[5] 许龙岩,袁慕云,唐勤,等.PCR-焦磷酸测序检测金黄色葡萄球菌研究[J].检验检疫学刊,2013,23(1):29-33.
[6] 许龙岩,袁慕云,唐勤,等.PCR-焦磷酸测序检测单核细胞增生李斯特氏菌研究[J].中国食品卫生杂志,2013,25(3):201-205.
[7] 张晓恒,夏云,曹何,等.Vitek-2 药敏卡片检测MRSA的准确性评价[J].重庆医科大学学报,2010,35(9):1384-1385.
[8] 钟利,黄永茂,唐凌.氟喹诺酮类药物对金黄色葡萄球菌nor A基因表达的影响研究[J].中华医院感染学杂志,2008,18(6):751-753.
[9] 王卫华,陈洁,汪丽,等.医院与社区获得性感染金黄色葡萄球菌耐消毒剂基因初步研究[J].中华医院感染学杂志,2006,16(8):865-867.
[10] 周丽娟.171 株金黄色葡萄球菌的分布与耐药性分析[J].抗感染药学,2013,10(2):128-131.
[11] 朱以军.耐甲氧西林金黄色葡萄球菌的耐药机制及检测[J].国外医学临床生物化学与检验学分册,2005,26(1):26-28.
[12] 宋战昀,冯新,韩文瑜,等.金黄色葡萄球菌nor A 外输泵中药耐药抑制剂的筛选[J].吉林农业大学学报,2007,29(3):329-333.
[13] 陈寒冬,钟利,闫宏,等.钧介导对氟喹诺酮类药物耐药的金黄色葡萄球菌nor A基因的研究[J].中国抗生素杂志,2012,37(11): 851-855.
