艾灸对克罗恩病大鼠结肠NF-κB p65及TNF-α、IL-1β调节作用的研究
2013-09-15窦传字马晓芃吴焕淦张翠红刘吴凌翔
魏 凯 张 丹 窦传字 马晓芃 杨 玲 吴焕淦 洪 珏 朱 毅 张翠红刘 婕 吴凌翔 黄 燕
(1上海中医药大学,上海,201203;2上海市针灸经络研究所,上海,200030)
克罗恩病(Crohn's Disease,CD)为炎症性肠病(Inflammatory Bowel Disease,IBD)的一种,是一种病因不明的慢性非特异性肉芽肿性炎症性肠病[1-2]。该病多为慢性起病,反复发作,迁延不愈。在欧美等发达国家发病率较高,在我国的发病率近年来有升高趋势[3-4],预计今后可能会持续增高,应当予以高度重视。现代医学多采用氨基水杨酸制剂、糖皮质激素、免疫抑制剂、抗菌药物及手术治疗,但药物不良反应和手术复发率高是当今难点[5]。针灸治疗CD具有一定的优势,临床研究显示针灸疗法治疗轻中型CD具有确切疗效[6-7],能显著改善CD患者的全身症状,减少腹泻次数,降低CD活动指数[8],且安全无不良反应,值得进一步应用和深入研究。
免疫功能异常是CD的主要发病原因之一。研究发现,NF-κB的高表达在CD的发病中发挥重要作用,在CD患者结肠组织中NF-κB的表达显著增高[9-10]。细胞内激活的NF-κB发生核移位后可与核内的靶基因结合,引起多种促炎基因的转录,从而促进炎症因子(TNF - α、IL -1β)等的表达[11]。因此,本研究建立CD大鼠模型,观察隔药灸对CD大鼠结肠NF-κB p65及炎症因子TNF-α、IL-1β表达的影响,为艾灸治疗CD疗效机制的阐明提供科学实验资料。
1 材料与方法
1.1 实验动物 健康雄性清洁级SD大鼠60只,体重(150±10)g,由复旦大学上海医学院实验动物中心提供(合格证号:SCXK(沪)2009-0019)。饲养条件:清洁级,室内温度18~22℃,相对湿度50% ~70%,自由摄取饮水、食物。适应性饲养3 d,观察大鼠饮食、活动正常后开始实验。SD大鼠按照随机数字表法分为正常组、模型组、西药组和隔药灸组,每组15只。
1.2 主要仪器与试剂 组织脱水机(德国莱卡公司)、包埋机(德国莱卡公司)、切片机(德国莱卡公司);5%(w/v)2,4,6 - 三硝基苯磺酸(TNBS)(Sigma公司);兔抗大鼠TNF-α一抗(武汉博士德公司),IL-1β一抗(Santa Cruz、Envison/HRP),NF - κB p65(A)一抗(Santa Cruz、Envison/HRP);美沙拉秦肠溶片(德国Losan Pharma GmbH)。
1.3 模型制备 模型制备参照国际公认的Morris法[12],应用TNBS合乙醇溶液造模。造模开始前禁食、不禁水24 h,称重后以生理盐水配制的1%戊巴比妥钠(30 mg/kg)行腹腔注射麻醉。将无水乙醇加双蒸水配成50%乙醇,然后将5%(W/V)的TNBS与50%乙醇按照体积比2∶1混合成TNBS灌肠液,造模大鼠以TNBS灌肠液3 mL/kg(TNBS用量为100 mg/kg)灌肠。灌肠针连接注射器,并抽取适当灌肠液,大鼠体位为头下尾上,灌肠时将灌肠针缓缓插入大鼠肛门6~8 cm,注入灌肠液,拔出灌肠针以后再将大鼠倒立1 min,以防药液溢出。每7 d重复灌肠1次,共4次。造模结束后,每组随机抽取1只大鼠,取其结肠做HE染色以确定模型制备是否成功。
1.4 分组与治疗 隔药灸组:取穴为天枢(双)、气海。采用隔药饼灸,药饼配方为附子、肉桂、丹参等药研末,灸前用黄酒调和并用自制动物专用模具制成药饼。艾炷选精制艾绒约90 mg,制成小椎体状,每次每穴各灸2壮,每日隔药饼灸1次,共灸7次。
西药组:采用美沙拉秦灌胃治疗。将美沙拉秦肠溶片研末,用双蒸水配制成灌胃液,每日投药量按成人(70 kg体重,4 g/d)与大鼠(200 g体重)56∶1的比例[13],每日1 次,共灌胃7 次。
模型组与正常组不进行任何治疗,只作与隔药灸组相同的抓取与固定。
1.5 指标检测
1.5.1 结肠组织病理学观察 HE染色,光学显微镜下观察各组大鼠结肠组织病理学变化。
1.5.2 结肠组织 NF-κB p65及TNF-α、IL-1β表达的测定 采用免疫组织化学Envision法检测,并进行图像分析。主要包括以下步骤。1)结肠组织石蜡块4 μm常规切片,于推片机水面上展片、捞片之后置烤片机上60℃烤片2~3 h。2)常规脱蜡水化:将石蜡切片浸于二甲苯中5 min×3次,无水乙醇3 min×2次,90%乙醇、80%乙醇、70%乙醇各3 min,之后PBS冲洗3 min×3次。3)抗原修复:切片置于柠檬酸盐缓冲液中,微波炉内以中高火加热至沸腾,室温下放置5 min后再加热至沸腾1次,然后室温下自然冷却,之后切片用PBS冲洗3 min×3次。4)消除内源性过氧化物酶:滴加以PBS稀释的3%过氧化氢(H2O2)于组织上,避光孵育20 min。用PBS冲洗3 min×3次。5)滴加一抗:滴加50 μL适当浓度的一抗于组织上,4℃冰箱过夜。之后于37℃电热恒温培养箱内复温45 min,PBS冲洗5 min×3次。6)滴加二抗:滴加1滴二抗工作液于组织上,37℃孵育30 min,PBS冲洗5 min×3次。7)DAB显色:滴加50μLDAB工作液于组织上,室温孵育,光镜下控制显色时间。显色完全后,用双蒸水冲洗终止显色。8)复染:切片置苏木素内染色2.5 min,流水冲洗10 min,1%盐酸酒精分化5 s,之后再流水冲洗10 min返蓝。9)脱水、透明、封片:切片置70%乙醇、80%乙醇、90%乙醇、无水乙醇中各3 min,二甲苯5 min×2次,中性树胶封片,并于光学显微镜下观察。10)数据采集:在固定光亮度下,每张切片随机选取5个视野拍摄照片,通过Image-Plus Pro 6.0软件分析并获取每张照片的阳性目标积分光密度,取平均值即为该切片的阳性目标积分光密度。
1.6 统计分析方法 实验数据通过SPSS15.0进行统计分析,对各组数据进行正态分布和方差齐性检验,符合正态分布或近似正态分布的资料采用(s)的形式表示;不符合正态分布的资料采用Median(min~max)的形式表示。若各组方差齐等,直接采用单因素方差分析(One-Way ANOVA)进行检验,检验结果有统计学意义则进一步采用LSD检验做两两比较;若各组方差不齐,采用非参数检验的Kruskal-Wallis H检验分析,检验结果有统计学意义则进一步采用Nemenyi法进行两两比较。统计检验水准均为α=0.05。
2 结果
2.1 各组大鼠结肠组织病理学变化 光镜下观察,正常组大鼠结肠组织结构完整,黏膜上皮连续覆盖,表面可见纹状缘,黏膜固有层单层杯状细胞、腺腔排列整齐,黏膜下层为疏松结缔组织,可见成纤维细胞、胶原纤维、血管、脂肪细胞及少量淋巴细胞,未见水肿或增生,肠壁肌层、浆膜层分布清晰。模型组肠道炎症明显,黏膜表面溃疡形成,局部黏膜上皮层缺失,裂隙状溃疡形成,固有层间质、黏膜下层结缔组织明显水肿伴大量淋巴细胞、嗜酸性粒细胞浸润,黏膜下层可见成团单核巨噬细胞聚集,偶见结节病样肉芽肿形成,伴有大量纤维组织增生,局部黏膜固有层杯状细胞增生明显,腺腔排列紊乱,肠壁肌层、浆膜层分布尚清晰,提示克罗恩病模型制备成功。西药组可见愈合性溃疡形成,结肠黏膜腺体排列较整齐,黏膜层可见炎性细胞、嗜酸性粒细胞浸润,黏膜下层有水肿、增厚及炎性细胞浸润,肠壁黏膜下层、肌层及浆膜层分布清晰。隔药灸组可见愈合性溃疡,轻度充血水肿,黏膜上皮覆盖完整,黏膜固有层明显增厚,可见炎性细胞浸润,大量杯状细胞增生,单层杯状细胞、腺腔排列尚整齐,黏膜下层结缔组织轻度水肿,可见脂肪细胞、成纤维细胞、少量胶原纤维及淋巴细胞浸润,肠壁肌层、浆膜层分布清晰。提示,隔药灸组和西药组对CD大鼠肠道炎症、组织形态结构具有一定的改善作用。
2.2 结肠组织NF-κB p65免疫组化染色结果 由图1可见,NF-κB p65在正常组仅少量表达于结肠黏膜间质内的淋巴细胞、单核/巨噬细胞胞质内;在模型组的表达显著高于正常组,多表达于黏膜间质内的淋巴细胞、单核/巨噬细胞胞质和胞核内;西药组和隔药灸组表达均接近正常组,少量表达于黏膜间质内的淋巴细胞、单核/巨噬细胞胞质和胞核内。图像分析的结果显示,模型组NF-κB p65的表达较正常组显著增高(P<0.01),隔药灸与西药治疗后,均能显著降低CD模型大鼠结肠组织NF-κB p65的表达(P<0.01)。
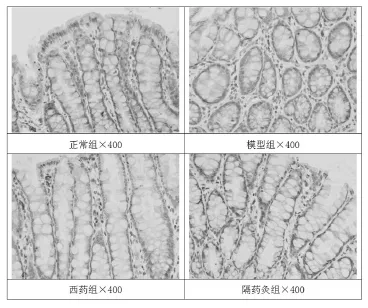
图1 各组大鼠结肠NF-κB p65免疫组化染色结果
表1 各组大鼠结肠NF-κB p65免疫组化染色积分光密度(s)
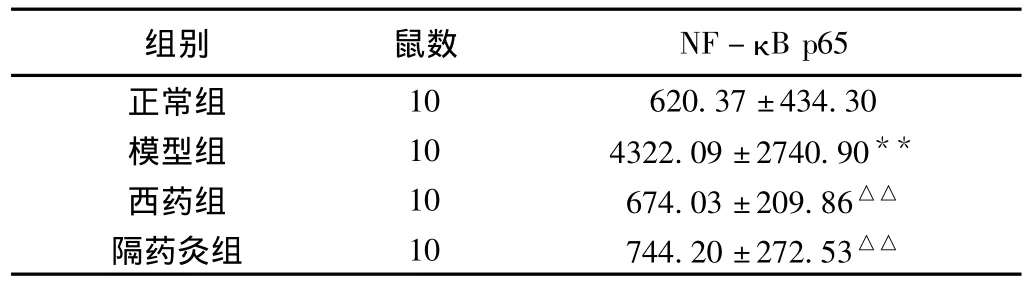
表1 各组大鼠结肠NF-κB p65免疫组化染色积分光密度(s)
注:与正常组比较,**P<0.01;与模型组比较,△△P<0.01。
10 620.37±434.30模型组 10 4322.09±2740.90**西药组 10 674.03±209.86△△隔药灸组 10 744.20±272.53 B p65正常组组别 鼠数 NF-κ△△

图2 各组大鼠结肠TNF-α免疫组化染色结果
2.3 结肠组织TNF-α、IL-1β免疫组化染色结果由图2可见,TNF-α在正常组仅微弱表达于肠黏膜上皮细胞胞质;在模型组强表达于肠黏膜上皮细胞和黏膜间质内的淋巴细胞、单核/巨噬细胞胞质内;西药组TNF-α表达较弱,接近正常组;隔药灸组TNF-α表达较模型组明显减弱,表达于肠黏膜上皮细胞和黏膜间质淋巴细胞、单核/巨噬细胞胞质内。由图3可见:正常组IL-1β仅微弱表达于肠黏膜上皮细胞胞质,少量表达于黏膜间质内淋巴细胞、单核/巨噬细胞胞质;模型组IL-1β表达较正常组显著增强,主要表达于肠黏膜上皮细胞、腺上皮细胞和黏膜间质内的淋巴细胞、单核/巨噬细胞胞质;西药组和隔药灸组IL-1β较模型组显著降低,仅少量表达于肠黏膜上皮细胞、腺上皮细胞和间质内淋巴、单核/巨噬细胞胞质。图像分析结果显示:模型组TNF-α、IL-1β的表达较正常组均显著增高(P<0.01),西药与隔药灸治疗均能降低CD模型大鼠结肠组织 TNF-α(P<0.01)、IL-1β(P<0.05,P <0.01)的表达。

图3 各组大鼠结肠IL-1β免疫组化染色结果

表2 各组大鼠结肠TNF-α、IL-1β免疫组化染色积分光密度
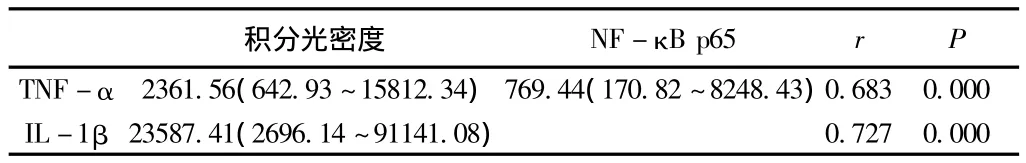
表3 TNF-α、IL-1β与NF-κB p65表达的相关性Median(min~max)
2.4 结肠TNF-α、IL-1β与NF-κB p65表达的相关性分析 由表3、图4-5可知:大鼠结肠组织炎症因子TNF-α、IL-1β的表达与NF-κB p65的表达均呈正相关性。
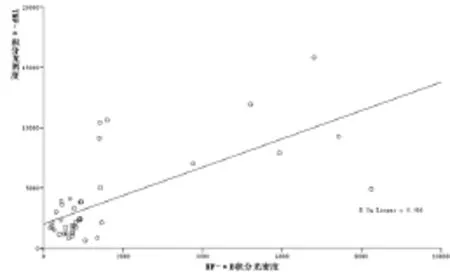
图4 TNF-α与NF-κB p65表达的相关性
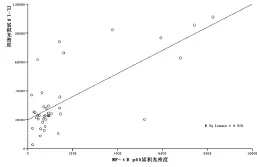
图5 IL-1β与NF-κB p65表达的相关性
3 讨论
中医学中并无克罗恩病的专属名词,根据其病因病机及其临床症状可将其归属为中医学的肠癖、久痢、便血、滞下、腹痛等范畴。本课题组自2000年开始,从临床与实验两个方面较为深入地开展了针灸治疗克罗恩病的专项研究。采用天枢、气海为主穴隔药灸治疗轻、中型CD,近期有效率达72.7%[14];在临床有效的基础上,开展了一系列的基础实验研究,采用三硝基苯磺酸(TNBS)制备实验性CD大鼠模型[15],探讨针灸治疗CD的作用机制。研究结果显示针灸能显著改善CD模型大鼠肠组织病理损伤,降低血清TNF-α,降低肠黏膜异常增高的TNF-α、TNFR1、TNFR2,下调结肠TGF - β、FGF、CTGF、IGF -I、IGF -IR、IGFBP -5 的异常表达,从而减轻CD肠道炎症,改善组织损伤和肠纤维化,发挥治疗作用[6,16-20]。上述研究显示针灸对 CD具有良好的干预作用,值得进一步深入研究和应用。
NF-κB/Rel家族共有5个成员,分别是 RelA/p65,c- Rel,RelB,NF - κB1(p105/p50)和 NF - κB2(p100/p52)[11,21]。NF - κB/Rel多以 5 个亚单位组成的同质或异质二聚体的形式存在,其中p50/p65异质二聚体(即NF-κB)最为常见。p50亚单位介导NF-κB与DNA上的κB序列的结合,p65亚单位可以利用其C端反式激活域增强靶基因的转录激活,并介导IκB的激活。在未受刺激的细胞内,NF-κB的异质二聚体与抑制蛋白IκB结合形成三聚体,以失活状态存在于胞质内。外界刺激信号可通过一系列反应磷酸化并降解IκB,从而暴露NF-κB的核定位序列(NLS),并使其激活。激活的NF-κB发生核移位,通过p50亚单位的NLS与核内靶基因启动子区域的κB序列结合,诱导促炎基因的转录,在免疫反应、炎症、细胞凋亡和细胞增殖中发挥重要作用[22]。近年来,研究发现NF-κB在IBD(CD和UC)的发病和进展中起着尤为重要的作用[23]。在IBD患者肠道黏膜巨噬细胞及上皮细胞中有大量被激活的 NF-κB[24],可以调节与IBD发生发展相关的促炎性细胞因子(TNF-α、IL-1β、IL-6等)的产生和释放,加重肠道的炎性反应。NF-κB p65亚单位在CD和UC患者肠黏膜组织中的表达明显上调,且在 CD 患者中尤为明显[25-26],免疫组织化学染色表明CD中活化的NF-KB主要定位于黏膜固有层单核细胞及巨噬细胞内,但黏膜下表皮细胞和内皮细胞中亦可见阳性染色。NF-κB mRNA在脾虚型CD大鼠的表达也显著升高[27]。NF-κB p65 siRNA对DSS诱导的小鼠结肠炎模型有保护效应,利用NF-κB p65 siRNA靶向阻断NF-κB途径可能成为IBD基因治疗的新方法[28]。以上研究结果均提示,NF-κB与CD的发生发展密切相关,有效抑制NF-κB的表达,能够降低炎性因子的分泌,改善组织损伤。
TNF-α、IL-1β均为重要的促炎因子。TNF-α主要由活化的单核细胞、T细胞、巨噬细胞产生,在CD的发生、发展中发挥重要作用,不但可以引起炎症细胞在肠道的聚集,增加结肠上皮细胞的渗透性,引发炎症、水肿和肉芽肿形成,还可诱导结肠上皮细胞的凋亡[29-30]。IL-1β 主要由单核巨噬细胞产生,在炎症和免疫反应中发挥介质作用,具有多种生物学功能,它不仅能促使中性粒细胞活化、巨噬细胞脱颗粒以及炎症因子的释放,还能增加上皮细胞及内皮细胞的通透性,引起一系列肠道炎症反应和组织破坏[31-32]。在IBD的发病中,NF-κB靶基因的表达失调,会引起TNF-α、IL-1β 等炎症因子的高表达[4]。高表达的炎症因子又可作为NF-κB信号通路的启动因子,进一步促进该通路的信号转导并诱导更多NF-κB的激活,对该通路起正向放大作用,加重炎症反应。以上研究提示,NF-κB与TNF-α、IL-1β均为CD发病中的关键因子,因此本文观察艾灸对NF-κB p65与TNF-α、IL-1β的调节作用以进一步阐释艾灸治疗克罗恩病的免疫机制。
本研究结果显示,CD模型大鼠结肠组织NF-κB p65的表达显著增高,且多表达于黏膜间质内的淋巴细胞、单核/巨噬细胞胞质和胞核内,隔药灸治疗后,CD大鼠结肠病理形态学显著改善,肠道炎症减轻,NF-κB p65的表达亦显著降低,提示NF-κB p65与CD发病密切相关,降低NF-κB p65的表达是隔药灸治疗CD的重要机制。研究还发现,隔药灸能显著降低CD模型大鼠结肠组织中显著增高的炎症因子TNF-α、IL-1β的表达;TNF-α、IL-1β均为 NF-κB p65的下游炎症因子,进行相关性分析发现TNF-α、IL-1β的表达与NF-κB p65的表达呈正相关,提示抑制CD大鼠结肠NF-κB p65的表达,进而减少其下游炎症因子TNF-α、IL-1β的表达,从而减轻肠道炎症,改善结肠组织形态结构,可能是艾灸(隔药灸)治疗CD的重要效应机制。NF-κB的激活涉及IκB的磷酸化,而后者有赖于 IKK(IκB 激酶)的调控,IKK/IκB/NF - κB 是一个有机联系的系统,继续深入研究CD IKK/IκB/NF-κB信号传导途径和艾灸对其调节作用,有助于进一步阐明艾灸治疗CD的效应机制。
[1]Fiocchi C.Inflamatory bowel disease:Etiology and pathogenesis[J].Gastroenterology,1998,115:182 -205.
[2]Hong Jue,Zhang Cui- hong,Ma Xiao - peng.Pathogenesis of Inflammatory Bowel Disease and the Action Mechanism of Moxibustion[J].J.Acupunct.Tuina.Sci.2012,10(3):174 - 180.
[3]中华医学会消化病学分会炎症性肠病协作组.对我国炎症性肠病诊断治疗规范的共识意见[J].胃肠病学,2007,12(8):490 -494.
[4]Zheng JJ,Zhu XS,Huang FZ,et al.Crohn's disease in mainland China:a systematic analysis of 50 years of research[J].Chin J Dig Dis,2005,6(4):175-181.
[5]陈洪林,闫伟,查勤芳.克罗恩病中医治疗特色与优势[J].辽宁中医药大学学报,2013,15(2):16 -17.
[6]施茵,包春辉,吴焕淦,等.隔药灸结合针刺对克罗恩病患者肠黏膜TNF-α、TNFR1、TNFR2表达及肠上皮细胞凋亡的影响[J].上海中医药杂志,2011,45(1):46 -50.
[7]包春辉,施茵,马晓芃,等.克罗恩病的发病机制及针灸治疗进展与思考[J].上海针灸杂志,2010,29(11):681 -686.
[8]杰弗里.“靳三针”疗法合饮食澄清计划治疗Crohn's病的临床研究[D].广州:广州中医药大学,2002.
[9]Rogler G,Brand K,Vogl D,et al.Nuclear factor κB is activated in macrophages and epithelial cells of inflamed intestinal mucosa[J].Gastroenterology,1998,115:357 -369.
[10]Ellis RD,Goodlad JR,Limb GA,et al.Activation of nuclear factor kappa B in Crohn's disease[J].Inflamm Res,1998,47:440 - 445.
[11]Bantel H,Berg C,Vieth M,et al.Mesalazine inhibits activation of transcription factor NF-kappaB in inflamed mucosa of patients with ulcerative colitis[J].Am J Gastroenterol,2000,95(12):3452 -3457.
[12]Morris GP,Beck PL,Herridege MS,et al.Hapten - induced model of chronic inflammation and ulceration in the rat colon[J].Gastroenterology,1989,96:795 -803.
[13]徐淑云,卞如濓,陈修.药理学实验方法学[M].北京:人民卫生出版社,1991.
[14]吴焕淦,张琳珊.隔药饼灸治疗克隆氏病研究[J].现代康复,2000,4(3):397.
[15]吴焕淦,刘慧荣,庞惠芳,等.克隆氏病模型的制备及其形态学研究[J].现代康复,2000,4(12):28 -29.
[16]Shi Z,Ma XP,Wu HG,et al.Effect of Acupuncture - moxibustion on TNF-α,sTNFR-Ⅰ and sTNFR-Ⅱ of Rats with Crohn's Disease[J].J Acupunct Tuina Sci,2009,7(1):29 -32.
[17]马晓芃,安彩萍,吴焕淦,等.隔药灸与电针对克罗恩病大鼠结肠转化生长因子β1和结缔组织生长因子及Ⅰ型胶原和纤维连接蛋白表达的影响[J].中国组织工程研究与临床康复,2008,12(20):3853-3858.
[18]马晓芃,安彩萍,吴焕淦,等.隔药灸与电针对克罗恩病大鼠结肠IGF-I、IGF-IR、IGF-BP5表达的影响[J].上海针灸杂志,2008,27(5):37-40.
[19]Zhao C,Ding JY,Ma JD,et al.Acupuncture on the Basic Fibroblast Growth Factor and TypeⅠCollagen in Colons of rats with Crohn's Diseas[J].J Acupunct Tuina Sci,2011,9(1):1 - 6.
[20]Wu HG,Zhao C,Wu LY,et al.Effect of Moxibustion on Expressions of TGF-β and Smad4 in Colonic Mucosa of Rats with Intestinal Fibrosis in Crohn Disease[J].J Acupunct Tuina Sci,2012,10(6):331 - 335.
[21]Vallabhapurapu S,Karin M.Regulation and function of NF - kappaB transcription factors in the immune system[J].Annu.Rev.Immunol.,2009,27:693 -733.
[22]Hayden Ghosh,Hayden M.S.,Ghosh S.Shared principles in NF - kappaB signaling[J].Cell,2008,132:344 - 362.
[23]马俊方,陈平南,孔超美,等.靶向NF-κB治疗炎症性肠病的研究进展[J].国际消化病杂志,2012,32(4):222 -225.
[24]Atreya I,Atreya R,Neurath MF.NF - κB in inflammatory bowel disease[J].J Intern Med,2008,263(6):591 -596.
[25]Schreiber S,Nikolaus S,Hampe J.Activation of nuclear factor kappa B in inflammatory bowel disease[J].Gut,1998,42:477 -484.
[26]Thiele K.Bierhaus A.Autschbach F.Hofmann M,Stremmel W,Thiele H,Ziegler R,Nawroth PP Cell specific effects of glucocorticoid treatment on the NF-kappaBp65/IkappaBalpha system in patients with Crohn's disease[J].Gut,1999,45:693 -704.
[27]李晓红,岳美颖,钟强,等.白术茯苓汤不同配比对脾虚型克罗恩病大鼠核因子-κB mRNA的表达以及细胞因子的影响[J].中华中医药杂志,2013,28(5):1462 -1465.
[28]程黎娜,黄晓丽,甘华田.核因子κB小干扰RNA对葡聚糖硫酸钠诱导小鼠结肠炎的影响[J].中华医学杂志,2009,89(34):2416-2419.
[29]叶江英.TNF-α及IL-10在克罗恩病患者肠黏膜的表达及意义[D].长沙:中南大学,2011.
[30]Zeissig S,Bojarski C,Buergel N,et al.Down regulation of epithelial apoptosis and barrier repair in active Crohn's disease by tumour necrosis factor alpha antibody treatment[J].Gut,2004,53(9):1295 - 1302.
[31]薛惠平,倪培华,吴洁敏,等.炎症性肠病IL-1β基因多态性及连锁不平衡研究[J].上海交通大学学报:医学版,2006,26(8):912-915.
[32]Street ME,de'Angelis G,Camacho - Hübner C,et al.Relationships between serum IGF-1,IGFBP-2,interleukin-1beta and interleukin-6 in inflammatory bowel disease[J].Horm Res,2004,61(4):159 -164.
