慢性心衰大鼠延髓头端腹外侧区GABAB 受体介导的心血管效应
2013-09-15王仁俊温美玲寇正涌郝锡联周晓馥
王仁俊,温美玲,寇正涌,李 华,郝锡联,赵 卓,周 革,周晓馥
(吉林师范大学生命科学学院,吉林 四平 136000)
多种心血管疾病(冠心病、高血压等)的终末阶段都表现为慢性心力衰竭,是严重危害人类健康的心脏疾病.虽然临床上采用β受体阻断剂、肾素-血管紧张素醛固酮系统阻滞剂等对此有一定的治疗作用,但其确诊后四年病死率仍高达50%,目前仍缺乏有效的治疗手段.
有研究显示,慢性心衰的重要病理特征是交感传出神经兴奋性增强[1].导致心衰状态下交感神经兴奋性增强的主要原因可能与中枢作用机制改变有关[2-5].但是,在心衰状态下延髓头端腹外侧区(RVLM)内突触递质与交感神经活动增强的确切机制目前还不清楚.众所周知,延髓头端腹外侧区是调节交感紧张性的重要神经核团,许多神经递质参与该部位的调节作用.目前认为抑制性反应主要是由γ-氨基丁酸(GABA)参与完成,并由GABAA和GABAB两种受体介导,其中GABAB受体激活后通过G蛋白及第二信使系统,如cAMP或IP3介导K+通道开放或Ca2+通道关闭.在突触后膜,K+通道开放可诱导缓慢抑制性突触后电位,而大多数分布在突触前膜的GABAB受体主要通过关闭Ca2+通道调节神经递质的释放.因此,无论在突触前膜或突触后膜的GABAB受体均参与介导抑制性效应.有研究表明RVLM的GABA紧张性抑制作用可通过GABAB受体产生[6],而慢性心衰大鼠RVLM由GABAB受体介导的紧张性抑制作用是否发生改变,其内在机制如何尚未见报道,本文对此进行了研究,以探寻防治慢性心力衰竭的新策略和新方法.
1 材料和方法
1.1 实验动物
Wistar大鼠,雄性,体重180~200g,购自长春市亿斯实验动物技术有限责任公司.
1.2 药品试剂与实验设备
试剂:阻断剂CGP-35348、巴氯芬、α-氯醛糖、滂胺天蓝购于Sigma-Aldrich公司;肝钠素购于北京鼎国生物技术公司.设备:多道生理记录仪、大鼠脑立体定位仪、微操纵器.
1.3 心衰动物模型的建立
采用冠脉结扎方法诱导建立大鼠慢性心衰模型.在乙醚麻醉下将大鼠仰位固定于手术台,自左侧3~4肋间开胸,暴露心脏,于肺动脉圆锥及左心房间找出冠脉左前降支,以0号线立即结扎冠脉;将心脏送回胸腔,并挤出胸腔内血液和气体,迅速关闭胸腔,开胸时间不超过30s.假手术组仅置缝线而不结扎冠脉.术后前3d,肌注青霉素.术后6~8周对假手术对照大鼠与心衰模型大鼠进行数据检测.
1.4 实验分组
动物随机分为两大组:(1)延髓头端腹外侧区微量注射GABAB受体阻断剂CGP-35348组,其中分假手术组(n=7)和心衰组(n=8).(2)延髓头端腹外侧区微量注射GABAB受体激动剂巴氯芬组,其中分假手术组(n=6)和心衰组(n=8).
1.5 左心室舒张末期压(LVEDP)、左心室最大收缩舒张速率(±dp/dt)、血压(BP)和心率(HR)的记录
腹腔注射乌拉坦(0.75g/kg)和α-氯醛糖(70mg/kg)麻醉,如需要可静脉补充α-氯醛糖(0.3g/kg)麻醉,右颈总动脉插管,通过压力换能器连接到多道生理记录仪,同步采集LVSP(左心室收缩压)、LVEDP和±dp/dt等各项指标,记录完左心室舒张末期压后,将聚乙烯导管退出心室,可进一步记录动脉血压,记录大鼠标Ⅱ导联心电图,并同步得到心率.
1.6 延髓头端腹外侧区微量注射及核团定位
将动物俯卧位固定于大鼠脑立体定位仪上,参照Paxions&Waston大鼠脑图谱[7],在延髓头端腹外侧区(前囟后11.9~12.7mm,L和R 2.0~2.2mm,H 8.4~8.8mm)微量注射200nL相同体积的溶剂(vehicle)人工脑脊液(pH=7.4),并先后分别微量注射200nL GABAB受体阻断剂或激动剂,从每次注射完成后开始计时,连续观察BP和HR对微量注射药物或人工脑脊液的反应,每次给药时间间隔30min.微注射实验完毕,用过量麻醉剂将动物处死.将2%滂胺天蓝溶液(50nL)缓慢注入延髓头端腹外侧区.剪取头颅,去除颅骨,将脑组织固定于10%甲醛溶液中,3d后作冰冻切片(厚度为30μm),染色,使用体视显微镜观察药物是否进入延髓头端腹外侧区,定位偏离RVLM者不列入统计.
1.7 心肌梗死面积测定
上述实验完成后取出心脏,-20℃保存.心肌梗死面积详细测定步骤参见文献[8].
1.8 大鼠RVLM组织取材
用过量麻醉剂将假手术组和心衰组大鼠处死,取脑并迅速转移至干冰上冰冻.用冰冻切片机在RVLM核团所在位置连续切6张100μm厚的脑片,用12号针头在脑片上RVLM核团所在位置双侧总共打12个孔.针头内的组织即为RVLM核团组织.
1.9 Western bolt检测
取假手术组和心衰组大鼠RVLM内脑组织分别加入蛋白提取缓冲液(10mmol/L Tris,1mmol/L EDTA,1%SDS,0.1%Triton X-100和1mmol/L PMSF),超声粉碎,37℃孵育30min;4℃10000r/min离心2min;上清液即为全细胞蛋白,Bradford法测定蛋白浓度;各组等量蛋白样品经SDS-PAGE分离后,三明治法电转移至硝酸纤维素膜;用封闭液(含5%脱脂奶粉TBST)室温封闭;分别用一抗GABAB受体1a和1b亚型抗体(1∶500,rabbit polyclonal),GAPDH(1∶1000),室温和4℃孵育过夜后,膜用TBST洗涤干净.然后用1∶4000稀释的红外荧光标记二抗(Alexa Fluor 800或Alexa Fluor 700)分别对膜避光孵育1h,利用Odyssey红外荧光扫描成像系统对膜上蛋白进行检测.
1.10 统计分析
所有数据都用平均数±标准误表示,注射前和注射后比较的数据分析使用配对t检验做统计学处理.为比较BP和HR对微注射不同剂量激动剂或阻断剂的组内差异,重复检验ANOVA Dunnett's post hoc test.假手术组和心衰组之间原始数据和参数的相对改变采用二元ANOVA Bonferroni's post hoc test检验.
2 结果
2.1 心衰与假手术大鼠整体生理学指标
大鼠心脏标本病理分析发现,心衰组大鼠心脏重量、体重和肺湿重与假手术组相比明显增加(P<0.05),结果提示心衰大鼠出现水潴留.与肺淤血假手术组相比,心衰组大鼠左心室心肌梗死面积明显增加(P<0.05),心梗面积在30%~40%之间;假手术组大鼠左心室心肌未见明显损伤.心衰组大鼠左心室最大收缩舒张速率(±dp/dt)明显低于假手术组;而心衰组大鼠左室舒张末期压却明显高于假手术组(P<0.05)(见表1).以上结果提示心衰组大鼠的心脏收缩和舒张功能减退,这些表现与临床慢性心衰症状相近.

表1 心衰与假手术大鼠整体生理学指标检测结果
2.2 注射GABAB受体阻断剂CGP-35348
与溶剂对照组相比,假手术组和心衰组大鼠RVLM内微量注射GABAB受体阻断剂CGP-35348导致心率和血压呈剂量依赖性升高(P<0.05)(见图1),但与假手术组相比,心衰组心率和血压升高幅度显著减小(P<0.05)(见图1).心率和血压对CGP-35348开始反应的时间是2.5~3.5min,峰值出现在微量注射后的5~6min内,而恢复至给药前水平的时间是在20~25min内,并且心衰组大鼠BP和HR的恢复时间为(22.1±1.9)min,与假手术组恢复时间(23.2±1.7)min无显著差异(P>0.05).
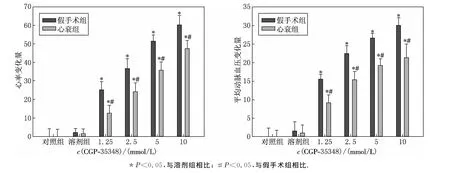
图1 假手术组与心衰组大鼠延髓头端腹外侧区微量注射CGP-35348对血压和心率的影响
2.3 注射GABAB受体激动剂巴氯芬
与溶剂对照组相比,假手术组和心衰组大鼠延髓头端腹外侧区微量注射GABAB受体激动剂巴氯芬导致心率、血压呈剂量依赖性下降(P<0.05)(见图2);但与假手术组比,心衰组心率和血压下降幅度显著减小(P<0.05)(见图2).心率和血压对巴氯芬产生反应的谷值出现在微量注射后的4~5min内,而心率和血压下降的效应在微量注射后的25~35min内恢复至给药前的基线水平,并且心衰组大鼠BP和HR对延髓头端腹外侧区微量注射GABAB受体激动剂巴氯芬产生反应的潜伏期(3.9±0.8)min,与假手术组潜伏期(4.1±0.7)min无明显差异(P>0.05).
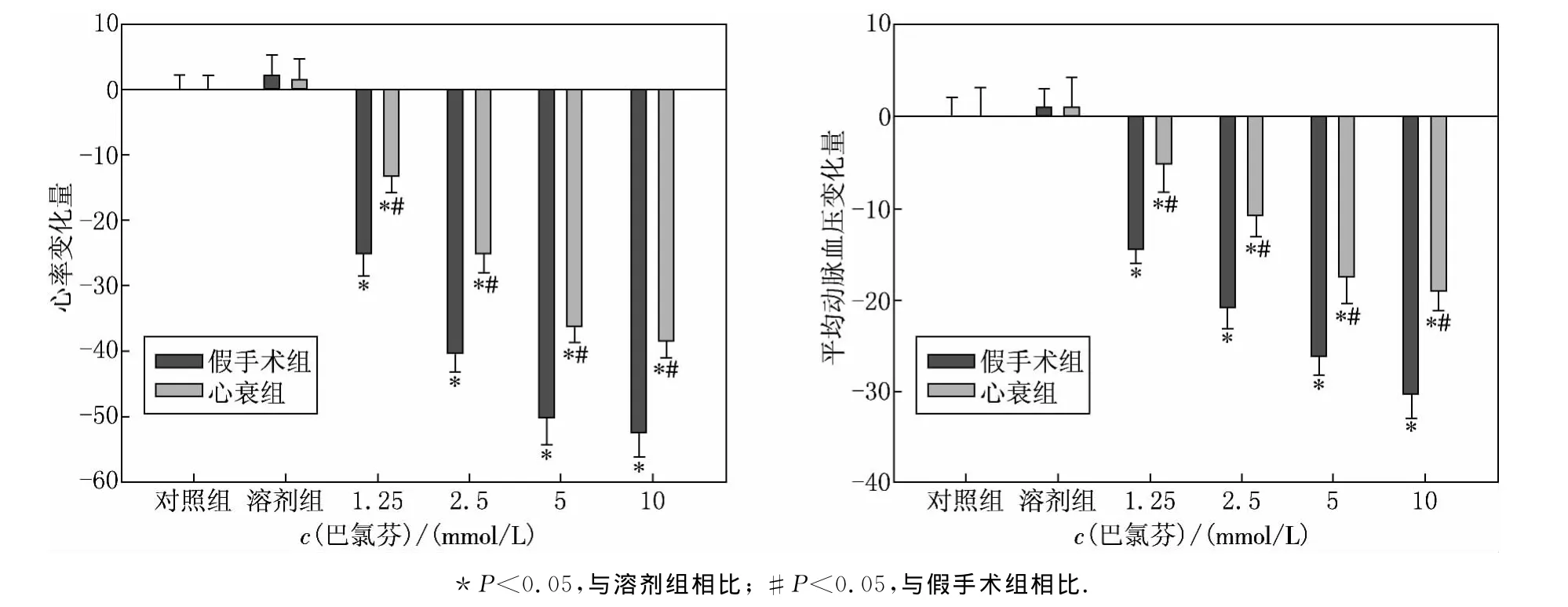
图2 假手术组与心衰组大鼠延髓头端腹外侧区微量注射巴氯芬对血压和心率的影响
2.4 检测大鼠RVLM内GABAB受体1a和1b亚型蛋白表达量
因为1a和1b两种亚型是GABAB受体的主导优势亚型[9-10],故分别在6只假手术组和6只心衰组大鼠中,使用Western bolt技术检测假手术组、心衰组大鼠RVLM内GABAB受体1a和1b亚型蛋白表达量.研究结果显示心衰组大鼠RVLM内GABAB受体1a和1b亚型蛋白表达量与假手术组相比发生下调(P<0.05)(见图3).
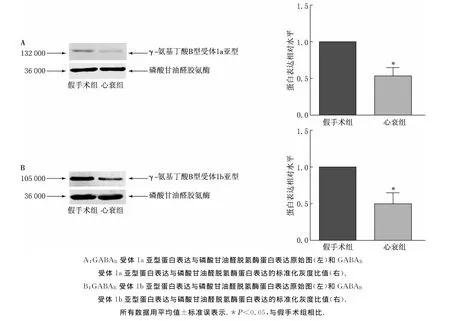
图3 假手术组与心衰组大鼠延髓头端腹外侧区GABAB受体1a和1b亚型蛋白表达量
3 讨论
本项研究工作证实心衰大鼠RVLM内GABAB受体介导的交感紧张性调节作用减弱.在大鼠单侧RVLM微量注射GABAB受体激动剂巴氯芬导致BP下降和HR减慢,这可能是微量注射GABAB受体激动剂巴氯芬后,交感神经的传出活动受到抑制而引发的,该结果与Amano等人的报道相一致[11].相比较而言,于大鼠RVLM微量注射GABAB受体阻断剂CGP-35348,却引起HR加快、BP升高,这可能是与微量注射GABAB受体阻断剂后,交感神经的传出活动去抑制有关,该结果与周苏娅等人的报道相一致[6].值得注意的是与假手术组相比,心衰组RVLM微量注射GABAB受体阻断剂后心率、血压升高幅度显著降低,而微量注射GABAB受体激动剂巴氯芬使心率、血压下降幅度显著减少,结果提示心衰大鼠RVLM的GABAB受体介导的紧张抑制作用发生钝化.这种RVLM的GABAB受体介导的交感缩血管紧张抑制作用的功能减弱可能是使交感神经兴奋性增强的作用机制之一.
为进一步解释心衰大鼠RVLM内GABAB受体功能减弱的确切机制,本文进行了Wertern blot检测实验,Western blot结果显示心衰大鼠RVLM的GABAB受体介导的紧张性抑制作用发生钝化,与GABAB受体的表达量下调有关.此外,心衰大鼠RVLM GABAB受体功能减弱存在以下几种可能机制:(1)在慢性心衰状态下,某些激素或神经递质水平升高,可降低RVLM内GABAB受体的功能.(2)受体的亲和力、磷酸化状态以及亚基的组成可能与心衰大鼠RVLM内GABAB受体功能减弱有关.(3)几种突触递质效应如:突触前GABA合成或释放的减少、GABA降解的增加以及GABA与其受体的异常作用都可能导致GABAB受体功能的改变,进而引起交感兴奋性增强.(4)心衰状态下一氧化氮(NO)-GABA机制也可影响交感神经的紧张性作用.
根据组织学鉴定,我们认为在RVLM内微量注射GABAB受体激动剂或阻断剂所引起的BP和HR的改变,都是RVLM内特异性的,即这些效应并不是注射时的机械刺激或酸碱化学刺激所致,因为微量注射相同体积的人工脑脊液(pH=7.4),对BP和HR均无明显影响.同时该效应与药物扩散达到RVLM邻近部位也无关,因为向RVLM邻近部位注入相同体积和pH值的GABAB受体激动剂或阻断剂,对BP和HR并无明显影响;并且该效应也非药物进入血液循环作用于其他外周器官组织所引发,因为我们直接向静脉内注射了2.5倍于RVLM内微量注射最高剂量浓度的GABAB激动剂或阻断剂,发现BP和HR均未发生显著变化.
总之,本研究显示慢性心衰状态下RVLM内GABAB受体介导的交感传出抑制作用发生钝化与GABAB受体的表达量下调有关,结果提示RVLM内GABAB受体功能的减弱和GABAB受体的表达量下调是心衰状态下心血管功能异常(如交感兴奋性增强等)的重要病理机制之一.
[1]COHN J N,LEVINE T B,OLIVARI M T,et al.Plasma norepinephrine as a guide to prognosis in patients with chronic congestive heart failure[J].N Engl J Med,1984,311:819-823.
[2]ZHANG K,LI Y F,PATEL K P.Reduced endogenous GABA-mediated inhibition in the PVN on renal nerve discharge in rats with heart failure[J].Am J Physiol Regul Integr Comp Physiol,2002,282(4):1006-1015.
[3]WANG REN-JUN,ZENG QING-HUA,WANG WEI-ZHONG,et al.GABAAand GABABreceptor-mediated inhibition of sympathetic outflow in the paraventricular nucleus is blunted in chronic heart failure[J].Clinical and Experimental Pharmacology and Physiology,2009,36(5):516-522.
[4]王仁俊,寇正涌.运动训练改善心衰大鼠室旁核GABAA受体介导的交感传出抑制作用[J].东北师大学报:自然科学版,2009,41(3):107-113.
[5]王仁俊,韩俊杰.运动训练改善心衰大鼠室旁核GABAB受体介导的交感传出抑制作用[J].吉林师范大学学报:自然科学版,2009,30(1):65-68.
[6]周苏娅,黄德明,陈应城.延髓头端腹外侧区调节心血管活动的γ-氨基丁酸机制[J].浙江医科大学报,1998,27(5):193-196.
[7]PAXIONS G,WATSON C.The rat brain in stereotoxic coordinates[M].New York:Academic Press,1986.
[8]徐叔云,卞如濂,陈修.药理实验方法学(第二版)[M].北京:人民卫生出版社,1994:921-922.
[9]BETTLER B,KAUPMANN K,MOSBACHER J,et al.Molecular structure and physiological functionsof GABA(B)receptors[J].Physiol Rev,2004,84(3):835-867.
[10]MARGETA-MITROVIC M,MITROVIC I,RILEY R C,et al.Immunohistochemical localization of GABA(B)receptors in the rat central nervous system[J].J Comp Neurol,1999,405(3):299-321.
[11]AMANO M,KUBO T.Involvement of both GABAAand GABABreceptors in tonic inhibitory control of blood pressure at the rostral ventrolateral medulla of the rat[J].Naunyn Schmiedebergs Arch Pharmacol,1993,348(2):146-153.
