含芳胺及二肽的铜ギ配合物的结构及其应用
2013-09-15傅夏兵林子华乐学义
傅夏兵 林子华 乐学义*,,2
(1华南农业大学理学院应用化学系,广州 510642)
(2华南农业大学生物材料研究所,广州 510642)
铜作为生物正常生长发育必需的微量金属元素,具有固定的环境,可与蛋白质结合形成铜蛋白或含铜酶,参与生物体内的电子转移、氧的输送、底物的生物氧化还原反应,另外还具有调节体内铁的吸收,血红蛋白合成以及形成皮肤、头发和眼睛的色素等功能,在生物体中起着十分重要的作用[1]。芳胺具有生物分子中咪唑、嘌呤碱和嘧啶碱等配位基团类似的配位性质,并且本身具有抗菌、抗癌等生物活性,常常选作金属酶及蛋白等模型化合物的有效配体[2-5]。二肽为重要的生物分子,具有优良的生理活性和营养作用[6-11],同时还具备良好的吸收性,作为配体不仅易于构建酶活性中心的微环境,提高配合物的生物活性,而且有助于增大配合物在液体环境中的溶解性,提高生物利用率,降低毒副作用[12-15]。
基于上述原因,国内外学者设计合成了系列含芳胺及二肽的铜ギ配合物并深入研究了这些配合物的结构、性质及其应用等。研究发现,此类配合物对DNA具有良好的插入切割作用,有望作为新型的DNA切割试剂、DNA结构探针和DNA足迹试剂;对超氧阴离子自由基(O2-·)具有较好的催化歧化作用,可作超氧化物歧化酶模拟物,有望作为植物生长抗逆增产剂;对拓扑异构酶表现出较好的催化抑制作用,有望作为酶靶点的新型抗肿瘤药物。因此,对含芳胺及二肽的铜ギ配合物进行研究不仅具有理论意义而且应用前景广阔。本文结合本课题组近年来的研究工作综述了国内外对含芳胺及二肽的铜ギ配合物的研究,着重介绍该类配合物的结构及其应用等。
1 含芳胺及二肽的铜ギ配合物的结构
自Bell等[16]1969年合成出以imidazole为芳胺配体,Gly-Gly为二肽配体的首个含芳胺及二肽的铜ギ配合物以来,国内外学者利用溶剂挥发法、液相扩散法及重结晶等各种方法合成了系列含芳胺及二肽的铜ギ配合物,并通过元素分析(EA)、红外光谱(IR)、紫外可见光谱(UV-Vis)、电子自旋谐振光谱(ESR)、电子顺磁共振光谱(EPR)、X-射线单晶衍射等方法对这些配合物进行了组成及结构研究。已合成的含芳胺及二肽的铜ギ配合物如表1所示。
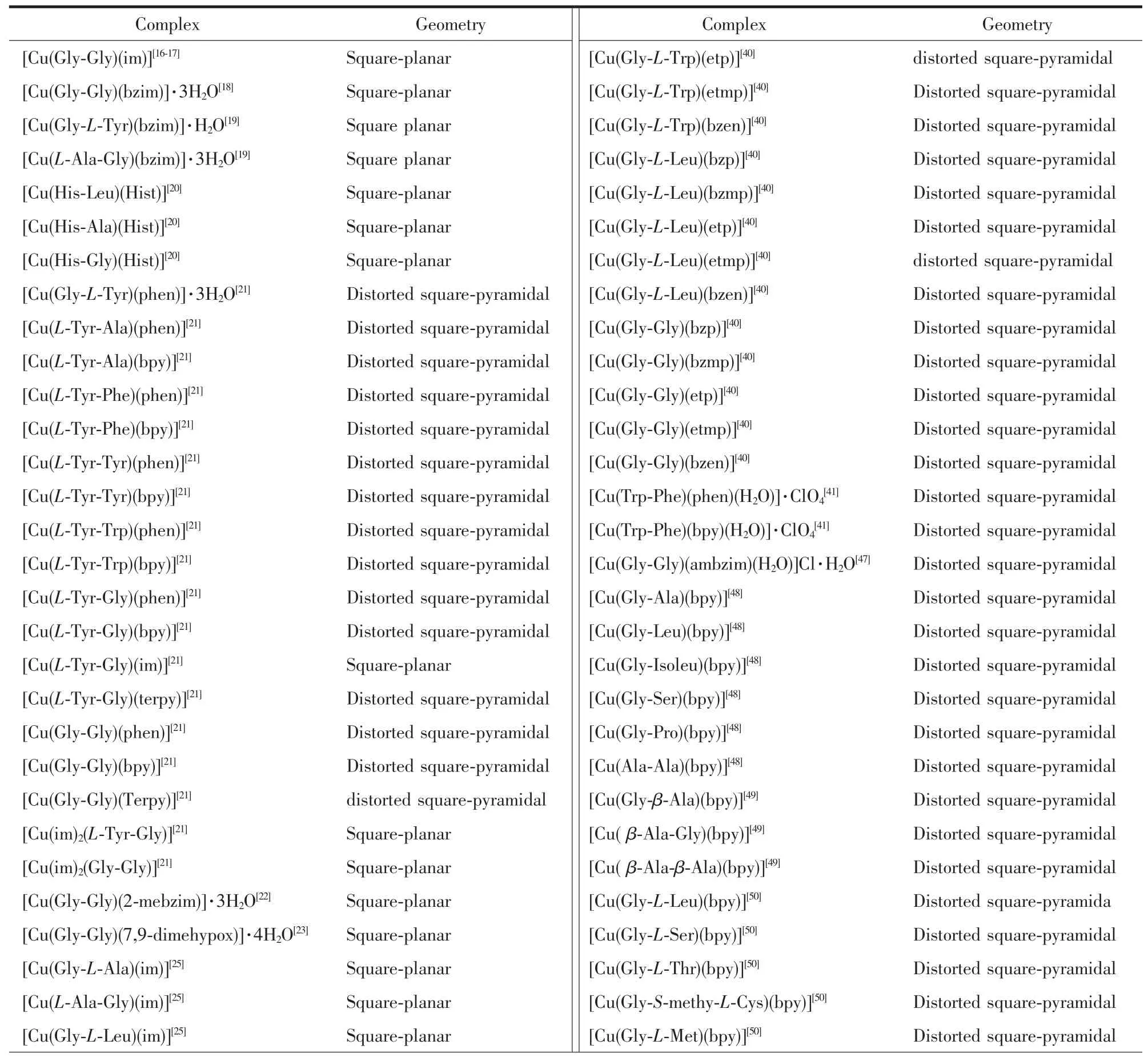
表1 已合成的含芳胺及二肽的铜ギ配合物及其几何构型Table 1 Synthesised copperギcomplexes containing aromatic amine and dipeptide and their molecular geometry

续表1
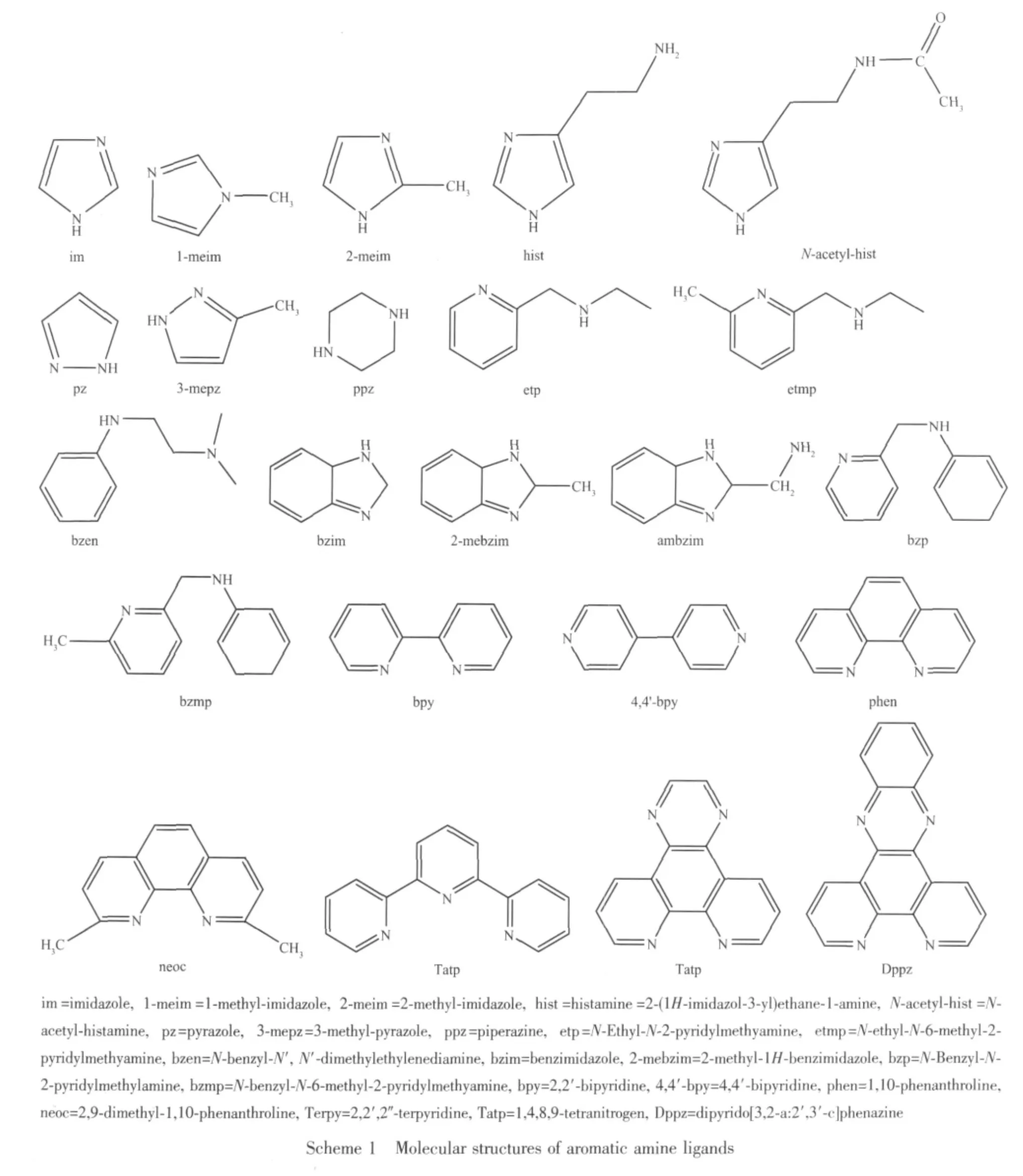
表1中含芳胺及二肽的铜ギ配合物分子中芳胺配体的分子结构式如Scheme 1所示。
研究表明,含芳胺及二肽的铜ギ配合物常见的分子结构类型有平面四边形、变形四面体、变形四方锥和双核结构等。
1.1 平面四边形结构
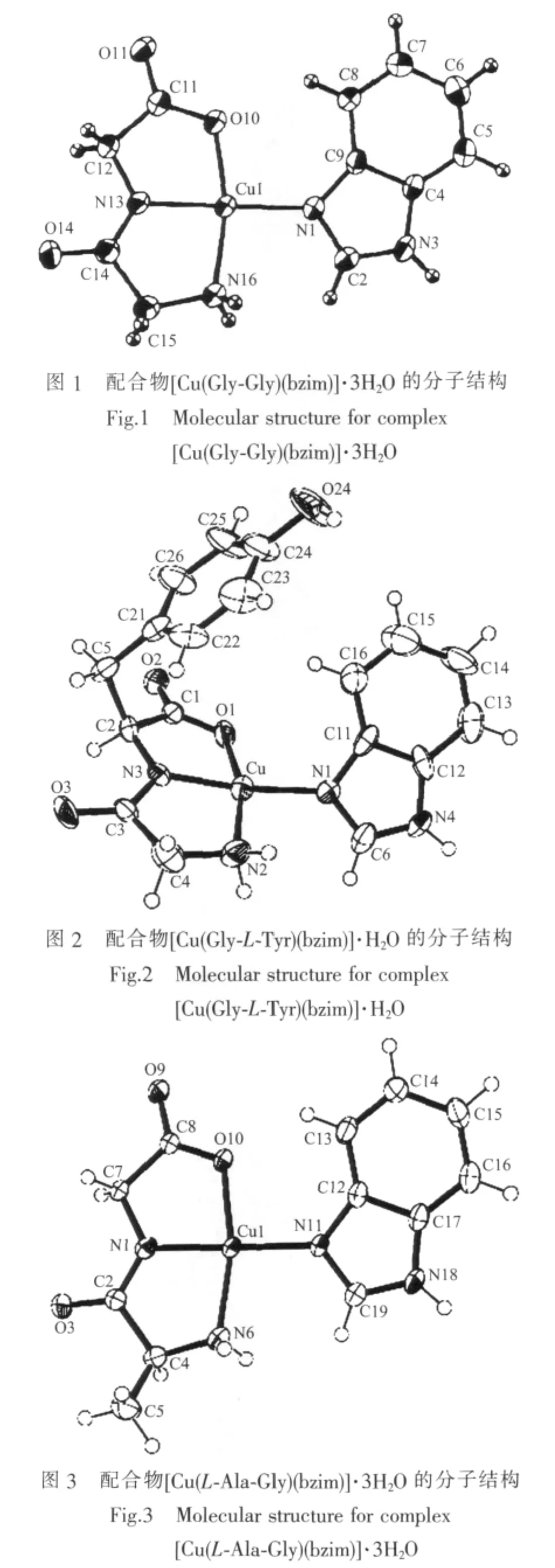
郭秀英、王凤山[17]应用重结晶法由甘二肽、Cu-Cl2·2H2O和咪唑合成了配合物[Cu(Gly-Gly)(im)]。X-射线单晶衍射测定结果表明,甘二肽中的氨基N原子、酰胺N原子和羧基O原子与中心Cuギ离子多齿螯合配位,咪唑环上的N原子侧接配位,从而形成了四配位的平面四边形结构。研究发现,中心Cuギ离子位于四边形平面之下,其键长和键角数据表明四个配位原子所构成的平面四边形发生了一定程度的扭曲,推测这是由于酰胺中的O原子和羧基中的羰基O原子间的静电作用和空间效应引起的。Garcia-Raso等[18]运用结晶法合成了配合物[Cu(Gly-Gly)(bzim)]·3H2O,X-射线单晶衍射测定结果表明该配合物分子中二肽平面与咪唑环平面之间存在一个二面角(19.0°),而具有变形平面四边形配位结构(图 1)。
Garcia-Raso等[19]在研究配合物Cu(Gly-Gly)(bzim)]·3H2O的基础上合成了配合物[Cu(Gly-L-Tyr)(bzim)]·H2O 和[Cu(L-Ala-Gly)(bzim)]·3H2O。ESR 和 X-射线单晶衍射研究表明这2个配合物亦具有上述类似的变形平面四边形结构。值得注意的是,在配合物[Cu(Gly-L-Tyr)(bzim]·H2O 的分子结构中(图 2),苯并咪唑与二肽部分不呈共平面排布,而配合物[Cu(LAla-Gly)(bzim)]·3H2O 的分子结构中(图 3),苯并咪唑与二肽部分之间扭转角较小,近似共平面排布,前者扭曲不共面可以促成苯并咪唑的C-H与二肽部分Tyr氨基酸残基的苯环之间的CH…π共轭作用,同时还可以消除苯并咪唑的C-H与二肽部分的羧基O之间的C-H…O氢键作用,后者共平面可促成分子内的氢键作用C(13)-H…O(10),均有助于提高配合物的稳定性。
Reddy等[20]运用电位滴定、1H NMR光谱和电子光谱法研究了配合物[Cu(His-Leu)(Hist)]、[Cu(His-Ala)(Hist)]和[Cu(His-Gly)(Hist)],结果表明这 3个配合物均具有N4型的平面四边形构型,即Hist中咪唑基的1个N原子和氨基N原子,以及二肽咪唑基的1个N原子和氨基N原子分别位于分子平面上与中心离子Cuギ配位。
Sugimori等[21]合成的配合物[Cu(L-Tyr-Gly)(im)],Li等[22]合成的配合物[Cu(Gly-Gly)(2-mebzim)]·3H2O,以及 Marzilli等[23]合成的配合物[Cu(Gly-Gly)(7,9-dimehypox)]·4H2O通过X-射线单晶衍射测定发现均具有变形平面四边形结构。Patil等[24]与Nair等[25]分别运用X光吸收光谱(XAS)和电位滴定研究了系列含芳胺及二肽的铜ギ配合物,初步推测也具有此类的变形平面四边形结构。
此外,Sugimori等[21]研究发现配合物[Cu(im)2(LTyr-Gly))、[Cu(im)2(Gly-Gly)]亦具有变形平面四边形结构,不同之处在于L-Tyr-Gly、Gly-Gly类似于氨基酸,以其氨基N原子、羧基的一个O原子与中心Cuギ离子配位。
1.2 变形四面体结构
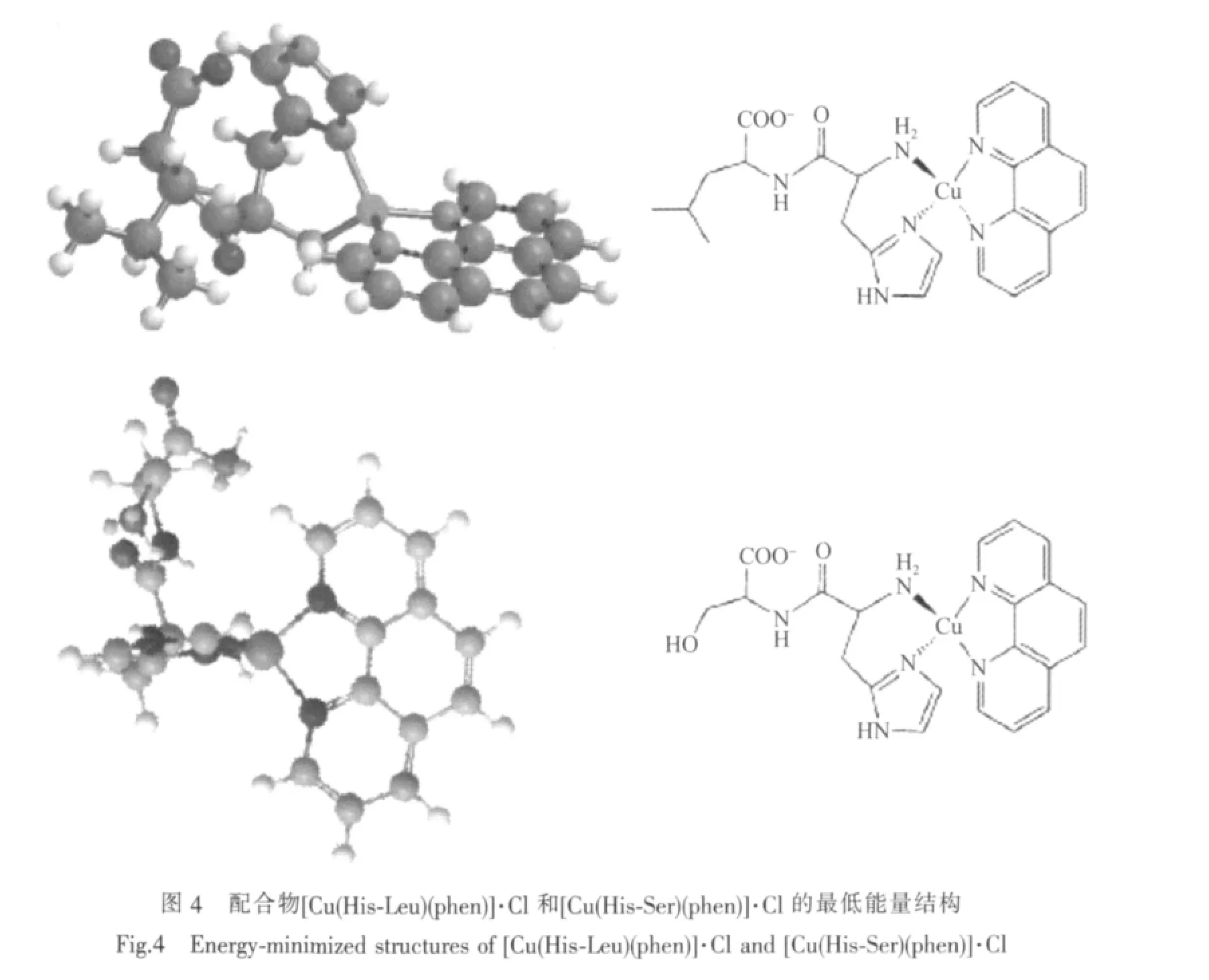
Reddy 等[26]通过结晶法由 CuCl2、phen、His-Leu/His-Ser 合 成 了 配 合 物[Cu(His-Leu)(phen)]·Cl、[Cu(His-Ser)(phen)]·Cl,通过 EA、IR、UV-VIS、MS 等方法对配合物的结构进行了探究,并运用分子力学的化学计算获得了配合物的最低能量结构(图4),实验数据与理论计算表明上述2个配合物均具有变形四面体结构,其中His-Leu/His-Ser的氨基N原子、咪唑基N原子和phen的2个N原子分别与中心Cuギ配位,且4个配位原子非共面排布。值得注意的是,这种配位方式与含芳胺及二肽的铜ギ配合物常见的变形四方锥、平面四边形等配位方式大不相同,His-Leu/His-Ser二肽配体充当1个二齿配体,且参与配位的原子并不是常见的氨基氮原子和羧基氧原子,而是二肽的氨基氮原子和His侧链咪唑基的氮原子。
1.3 变形四方锥结构
综合数十种含芳胺及二肽的铜ギ配合物X-射线单晶衍射测定解析结果,发现五配位的变形四方锥构型是该类配合物分子中铜ギ离子最典型的配位结构。
Garcia-Raso等[27]应用溶剂挥发法合成了配合物[Cu(L-Ala-Gly)(phen)]·3.5H2O、[Cu(L-val-Gly)(phen)]和[Cu(Gly-L-Trp)(phen)]·2H2O,X-射线单晶衍射结果表明均具有变形四方锥配位结构(图5),中心Cuギ离子与phen的1个N原子,及二肽部分的氨基N原子、酰胺N原子和羧基O原子配位形成四方锥的底面,而phen中另1个N原子占据四方锥顶点位置。并且发现,3个配合物中phen和Cuギ-二肽部分几乎均是呈正交的,但配合物[Cu(L-Ala-Gly)(phen)]·3.5H2O、[Cu(Gly-L-Trp)(phen)]·2H2O 中 N(5)-Cu-N(33)键角均小于100°,而配合物[Cu(L-Val-Gly)(phen)]中此键角接近108°,这种差别可能是由二肽部分N端氨基酸残基侧链的空间位阻(L-val>L-ala,gly)导致的。
Sugimori等[21]合成了系列具有此类结构的配合物,并且发现配合物[Cu(L-Tyr-Gly)(phen)]·3H2O(图6)分子中Cuギ-二肽部分与phen近似正交,中心离子Cuギ向顶点N4偏离配位平面,L-Tyr-Gly中的苯环侧链近似垂直于配位平面,与phen之间形成面-面芳环堆积作用,使得配合物能够稳定存在。

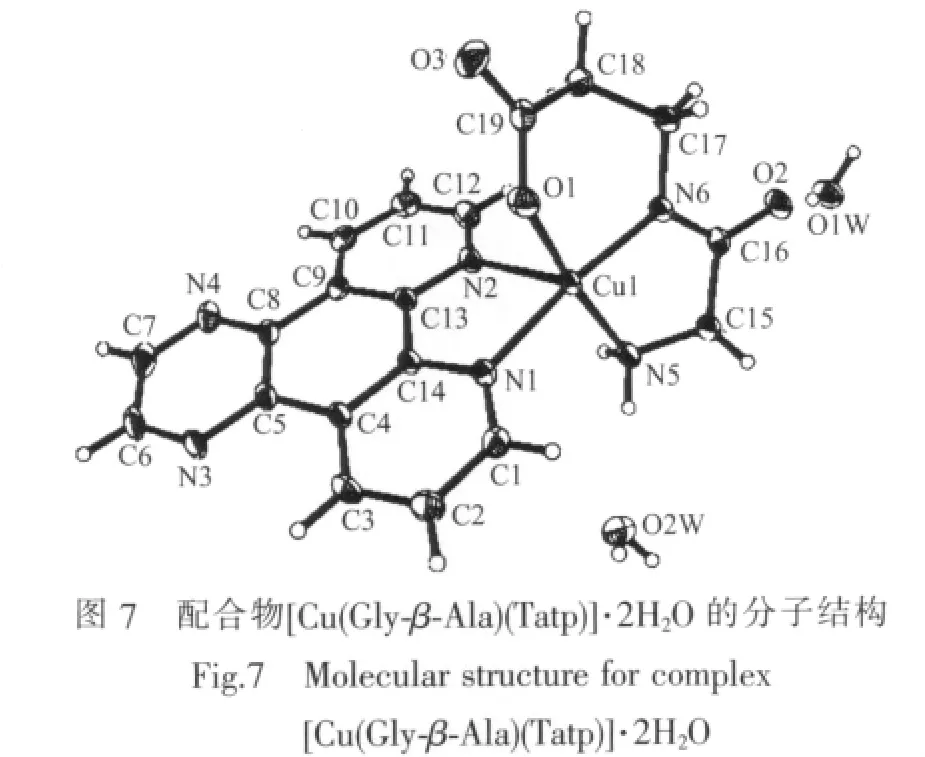
近年来,本课题组合成了系列含芳胺及二肽的铜ギ配合物[28-33],并通过 EA、IR、UV-Vis、摩尔电导率、以及X-射线单晶衍射对这些配合物进行了表征,结果表明均具有类似于配合物 [Cu(Gly-β-Ala)(Tatp)]·2H2O[32-33](图7)N4O型的变形四方锥构型。其中Phen/Tatp/DPPZ(N,N)中的1个N原子与二肽(N,N,O)在四方锥底面上与中心Cuギ离子配位,另一个N原子位于顶点位置参与配位。
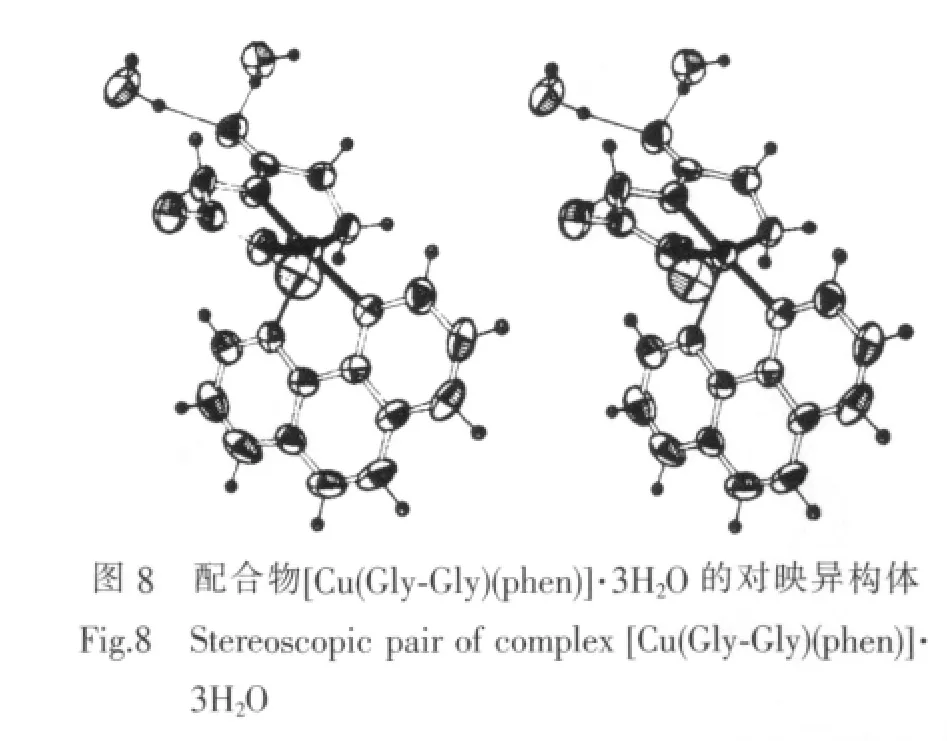
Srivastava课题组[34-35]合成的系列此类配合物、Lim 等[36]合成的配合物[Cu(Gly-Gly)(phen)]·3H2O(图8)、Simmons 等[37]合 成 的 配 合 物 [Cu(Gly-Gly)(2,9-dimethyl-phen)]·5H2O,以及 Akira 等[38]合成的[Cu(Gly-Tyr)(bzp)],均具有与本课题组所研究配合物相类似的变形四方锥构型,并发现相关键长和键角均相近。
Srivastava课题组[39]合成了系列含咪唑及二肽的铜ギ配合物,研究发现具有上述类似的变形四方锥结构,不同的是配合物分子中咪唑类芳胺配体为单齿配体和二肽(N,N,O)与中心Cuギ离子配位,构成四方锥的底面,而轴向配位则为水分子。
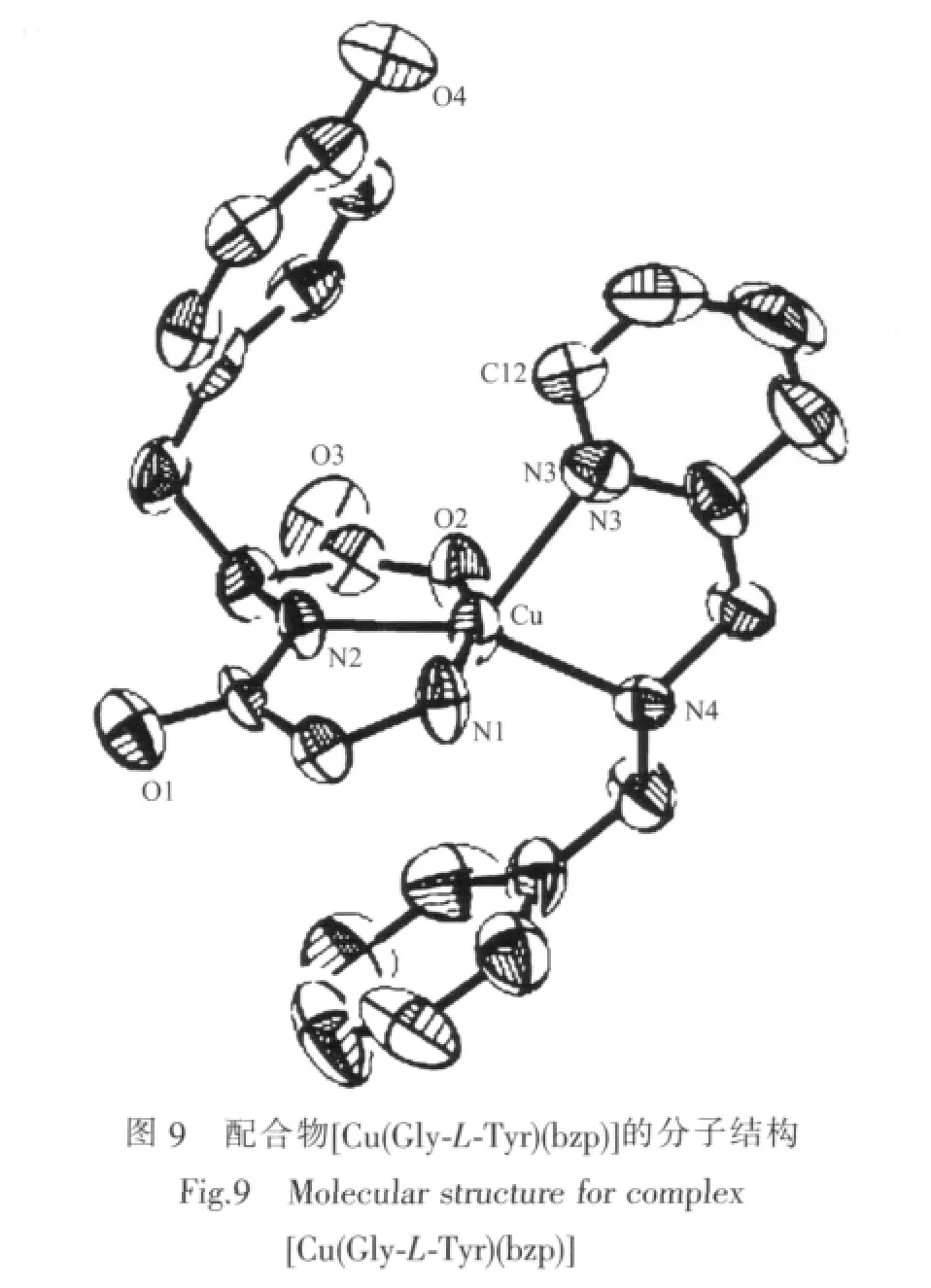
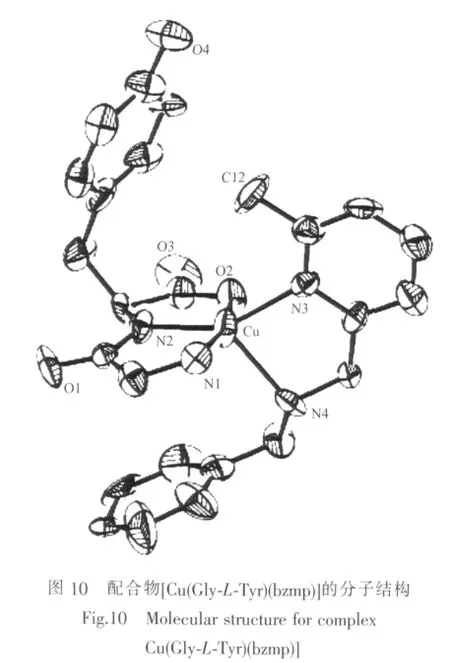
Yajima等[40]合成了系列具有变形四方锥配位结构的含芳胺及二肽的铜ギ配合物,并且发现这类配合物的稳定性与[Cu(Gly-Gly)(DA)]相当,推断这与配合物分子中芳胺配体的芳环与二肽氨基酸残基上的苯环之间的堆积等非键作用有关。如在配合物[Cu(Gly-L-Tyr)(bzp)]分子结构(图 9)中,Gly-L-Tyr 中的苯环向中心铜弯曲以靠近bzp的吡啶环,形成分子内的芳环边-面堆积作用;配合物 [Cu(Gly-L-Tyr)(bzmp)]分子结构(图 10)中,Gly-L-Tyr中的苯环向中心铜倾斜以接近6-甲基吡啶环的甲基,形成分子内的CH-π共轭作用。
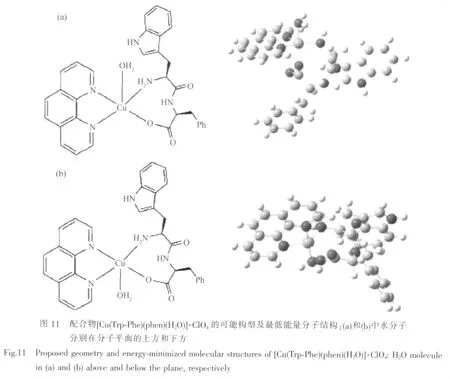
Reddy等[41]合成的配合物[Cu(Trp-Phe)(phen)(H2O)]·ClO4和[Cu(Trp-Phe)(bpy)(H2O)]·ClO4, 通 过EA、IR、UV-Vis、MS、EPR、磁性测定等方法初步推测为变形四方锥配位结构,并且通过最低能量构象分析得到了进一步证实。如在配合物 [Cu(Trp-Phe)(phen)(H2O)]·ClO4分子结构(图 11)中,phen(N,N)和Trp-Phe(氨基N,羧基O)与中心Cuギ离子配位形成四方锥的底面,水分子参与顶点配位,二肽类似于氨基酸以二齿配体形式参与配位。这种特殊的配位方式促使轴向配位H2O与配合物分子中的氨基N原子和羧基O原子形成分子内氢键,同时存在分子内phen与吲哚环之间芳环堆积作用使得与近年来本课题组合成并研究的系列含芳胺及L-α-氨基酸铜ギ配合物[42-46]的结构相似。
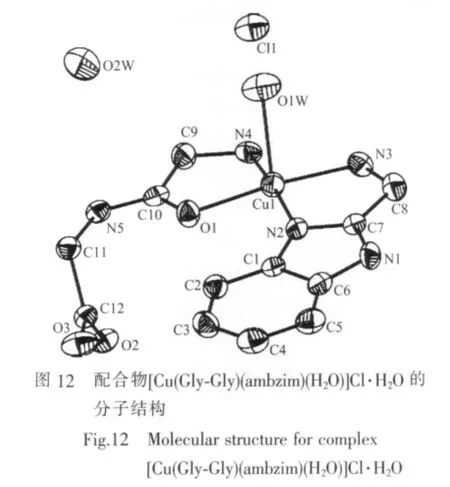
Liu等[47]应用单晶结构测定研究了配合物[Cu(Gly-Gly)(ambzim)(H2O)]Cl·H2O,结果表明二齿芳胺配体 ambzim(N,N)与 Gly-Gly(氨基 N,酰胺 O)占据赤道平面,水分子位于轴向配位形成变形四方锥结构(图12)。尤为引人注意的是,与含芳胺及二肽的铜ギ配合物不同,Gly-Gly作为二齿配体参与配位,且配位原子为氨基N和酰胺O,这可能与Gly-Gly(氨基N,酰胺O)和ambzim(N,N)之间位阻较小而易共平面有关。
此外,Sigel等[48-50]运用电位滴定法研究了系列含芳胺及二肽的铜ギ配合物,初步推测这些配合物分子也具有变形四方锥配位结构。
1.4 双核结构
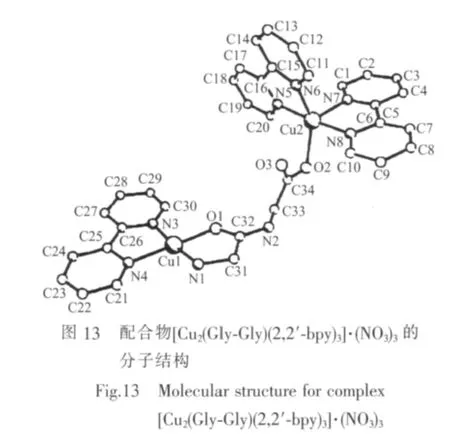
Nakao等[51]在碱性条件下合成了配合物[Cu2(Gly-Gly)2(im)]和[Cu2(Gly-β-Ala)2(im)],Matsumoto 等[52]制得了配合物Na[Cu2(Gly-Gly)2(im)]·6H2O。X射线单晶衍射测定表明,这些配合物是以咪唑为桥的双核配合物,双核均为平面四边形构型,二肽(N,N,O)和咪唑基中1个N原子参与配位。1984年,Srivastava课题组[53]利用IR、电子光谱、EPR等方法研究了系列含芳胺及二肽的铜ギ配合物,结果表明2个中心Cuギ离子均为变形四方锥配位结构,之间以咪唑基桥联,二肽(N,N,O)和咪唑基中1个N原子与中心Cuギ离子配位构成四方锥底面,水分子则轴向配位。Mori等[54]同样在碱性溶液中合成并研究了以吡唑基为桥联的双核配合物Ca[Cu2(Gly-Gly)2(pz)]·8H2O和Ca[Cu2(Gly-Gly)2(3-mepz)]·8H2O。王凤山等[55]合成了以Gly-GlyO为桥联基的新型双核铜配合物[Cu2(Gly-Gly)(2,2′-bpy)3]·(NO3)3(图 13)。 结构研究表明,2个中心Cuギ离子的配位方式不同,其中Cu1具有平面正方形配位结构,2,2′-bpy(N3,N4)与 Gly-GlyO(N1,O1)构成赤道平面;而Cu2则具有变形三角双锥配位结构,2个2,2′-bpy(N5和N6,或N7和N8)及Gly-Gly的O2参与配位成键。
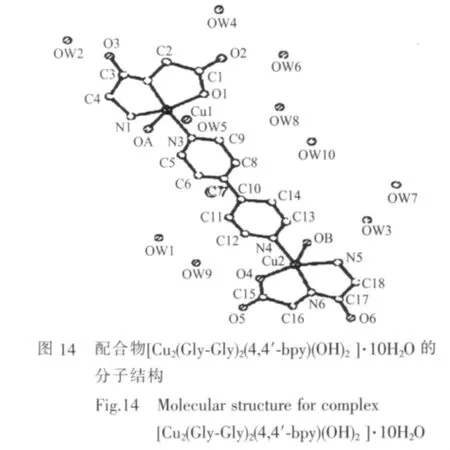
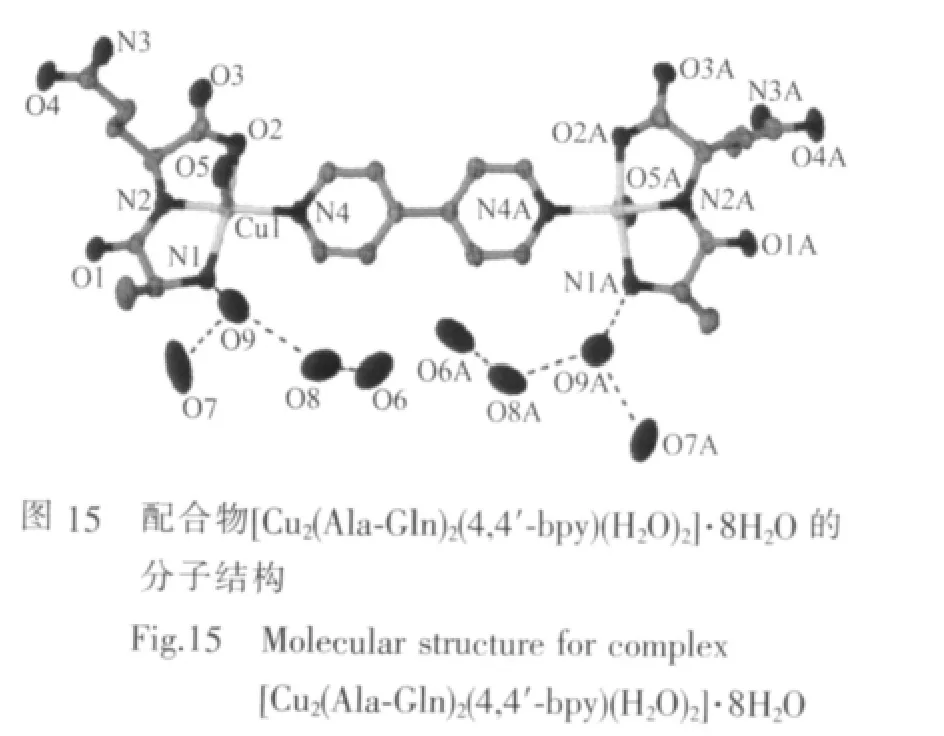
郭秀英等[56]合成了双核配合物[Cu2(Gly-Gly)2(4,4′-bpy)(OH)2]·10H2O, 结构测定表明 2 个核均具有变形四方锥结构(图14)。研究发现,Cu1与N1-N2-O1-N3锥底及Cu2与N4-N5-N6-O4锥底均不共面,2 个锥底面与中继基 4,4′-bpy(N3,N4)所在的平面互相错开,与王凤山等[57]研究的配合物[Cu2(Gly-Gly)2(4,4′-bpy)(OH)2]·9H2O 结构相似。 Lou 等[58-59]合成的配合物[Cu2(Ala-Gln)2(4,4′-bpy)(H2O)2]·8H2O 和[Cu2(Gly-Ala)2(4,4′-bpy)(H2O)2]·8H2O 也具有类似的结构(图15),不同之处在于轴向配位的是游离水而不是羟基OH。
最近,Tabassum等[60]合成了以哌嗪为桥基的新双核配合物[Cu2(Gly-Gly)2(ppz)(H2O)4]·2H2O,结构研究表明2个核均具有变形八面体构型,Gly-Gly(N,N,O)和ppz的一个N原子与中心Cuギ离子配位构成八面体的分子平面,2个水分子分别位于轴向配位。
1.5 配合物分子结构的影响因素
通常情况下,影响配合物分子结构的因素有配体、铜盐阴离子及酸碱性环境。综合上述结构分析结果,发现芳胺配体、二肽配体及酸碱性环境对配合物的分子结构均有影响,而铜盐阴离子由于几乎不参与配位且形成的配合物一般为非电解质,因而不影响配合物的分子结构。
芳胺配体对配合物分子结构影响较大。芳胺通常通过配位键及反馈键与Cuギ离子配位,配位能力较二肽、水分子及铜盐阴离子强,且导致Cuギ中心上电子云密度发生变化,而变化大小将影响水分子能否参与配位及配位作用大小[66],如Tatp/DPPZ/bzp所形成的配合物均为水分子不参与配位的变形四方锥结构[28-33,40],而im/pz/bpy/Phen/ambzim配合物的结构较为多变,且通常有水分子参与配位[26,41,47,51-54]。二肽配体结构对配合物的结构也有一定影响,如Gly-Gly/L-Ala-Gly/L-Val-Gly/Gly-L-Trp/L-Tyr-Gly/Gly-L-Tyr等大多数二肽通常以三齿配体参与配位[17-19,21,27,38,40],而Trp-Phe为二齿配体[41],这可能主要归因于后者结构中芳环侧链的立体效应不利于酰胺氮与中心Cuギ离子配位(图 11)。 另外,His-Leu/His-Ser/His-Ala/His-Gly均以二齿配体配位[20,26],可能主要归因于侧链咪唑基氮配位能力较强并存在一定的空间位阻,从而形成四面体结构的配合物。
另外,配合物合成过程所处的酸碱性环境不同,配合物的分子结构也会有较大差异。郭秀英、王凤山[17]等在中性条件下合成的配合物[Cu(Gly-Gly)(im)]为平面四边形结构,而Nakao等[51]和Matsumoto等[52]在碱性条件下合成的配合物[Cu2(Gly-Gly)2(im)]、Na[Cu2(Gly-Gly)2(im)]·6H2O为双核结构,这归因于中性条件下im为单齿配体,而碱性条件下咪唑氮上的氢可游离出来变为二齿配体。
2 含芳胺及二肽的铜ギ配合物的应用
研究含芳胺及二肽的铜ギ配合物不仅具有理论意义,而且潜在着广阔的应用前景。研究表明,这类配合物具有良好的DNA切割活性、SOD活性和抗肿瘤活性,可作化学核酸酶、SOD模拟物和肿瘤化疗药物等。
2.1 化学核酸酶
化学核酸酶可用作DNA切割试剂、DNA结构探针和DNA足迹试剂以及肿瘤治疗药物等,通过研究金属配合物与DNA的作用,对设计、合成新型化学核酸酶具有重要理论意义和广阔应用前景。
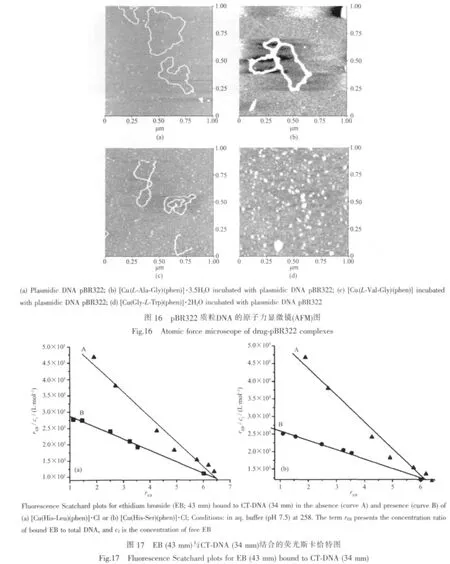
2003年,Garcia-Raso等[27]应用凝胶电泳法、原子力显微镜法研究了系列含芳胺及二的肽铜ギ配合物对DNA的裂解作用 (图16)。结果表明:配合物[Cu(Gly-L-Trp)(phen)]·2H2O能够将 pBR322质粒DNA裂解为粉末,表现出良好的核酸酶活性;配合物[Cu(L-Val-Gly)(phen)]使DNA超螺旋化,且可能表现出弱核酸酶活性;而配合物[Cu(L-Ala-Gly)(phen)]·3.5H2O只使DNA聚集并不表现出核酸酶活性。同时推测这些配合物切割DNA作用可能与形成[Cu(phen)2]+有关。
2004 年,Reddy 课题组[20]通过 UV-Vis、荧光光谱、凝胶电泳等方法研究了配合物 [Cu(His-Leu)(Hist)]、[Cu(His-Ala)(Hist)]、[Cu(His-Gly)(Hist)]与 DNA的相互作用。结果表明,这些配合物可能以插入方式与DNA作用并且表现出良好的核酸酶活性。
2007 年,Reddy 课题组[26]采用 UV-Vis、荧光光谱、热变性等方法又研究了配合物 [Cu(His-Leu)(phen)]·Cl、[Cu(His-Ser)(phen)]·Cl与 DNA 的结合作用,并通过凝胶电泳法研究了配合物对DNA的切割作用。DNA热变性研究发现,配合物与DNA作用后,DNA的熔点升高了5~6℃,由此推测先是带正电的配合物与带负电的DNA磷酸骨架之间静电相互作用,然后与DNA进行插入作用,与UV-VIS和荧光光谱研究结果一致。荧光斯卡恰特图(图17)进一步证实了配合物以插入模式与DNA作用。切割实验表明配合物均具有核酸酶活性,且 [Cu(His-Ser)(phen)]·Cl的切割活性稍大于[Cu(His-Leu)(phen)]·Cl,由此推测这与配合物[Cu(His-Ser)(phen)]·Cl中额外存在的Ser-OH有关。2011年Reddy课题组[41]研究了配合物[Cu(Trp-Phe)(phen)(H2O)]·ClO4和[Cu(Trp-Phe)(bpy)(H2O)]·ClO4与DNA之间的相互作用,也获得了类似的结果。

近年来,本课题组[30-32]通过电子吸收光谱、荧光光谱、粘度测定及凝胶电泳等方法研究了系列含芳胺及二肽的铜ギ配合物与DNA之间的相互作用。结果发现,作用强度随芳胺芳环增大而增强,随配合物空间位阻增大而减弱,由此推测这些配合物以插入方式与DNA作用。凝胶电泳结果(图18)表明,配合物在抗坏血酸存在下表现出较高核酸酶活性,并且其切割活性相对大小与其插入作用大小一致,说明配合物对DNA的切割作用与其插入作用有关。另外,DNA切割机理研究结果(图19)表明配合物是通过自由基对DNA进行切割的,推测这种作用与配合物具有SOD活性,通过氧化还原反应生成羟基自由基(·OH)进而氧化切割DNA有关,其作用机理如下:首先,配合物([CuⅡ]表示)被还原剂Vit C还原为[CuⅠ];然后,[CuⅠ]与 DNA 作用生成[CuⅠ]-DNA,[CuⅠ]-DNA中Cuガ离子能激活空气中O2产生超氧阴离子自由基,而配合物具有超氧化物歧化酶(SOD)活性,能快速催化发生歧化反应生成H2O2;最后,产生的H2O2能被还原剂([CuⅠ]-DNA中Cuガ或)还原产生羟基自由基·OH,该活性氧进攻并最终切割DNA双螺旋结构。
此外,2012年Tabassum等[60]应用多种光谱方法研究了配合物[Cu2(Gly-Gly)2(ppz)(H2O)4]]·2H2O与DNA的体外相互作用。结果表明该配合物能够强烈的与DNA进行结合,随之切割。并且由此推测该配合物是以混合模式与DNA结合,即结合过程中插入结合与小沟结合可能同时存在,但以小沟结合为主。
2.2 SOD模拟
超氧化物歧化酶(superoxidedismutase,简称SOD)是一类广泛存在于生物体内的重要金属酶[67-68],不仅具有防辐射、抗衰老、消炎、抑制肿瘤和癌症等功能作用,同时也能提高植物的抗旱捞、抗盐碱、抗寒和抗病虫害能力[69],在医学、食品、化妆品、农业等领域有着广泛的应用前景。然而,天然SOD存在着分离提纯工艺复杂、价格昂贵、存活期短,易失去活性、分子量大,不易透过生物膜,生物利用率低等不足之处,其应用范围受到极大的限制。 因此,研究既能避免天然SOD不足,又具有SOD活性的物质SOD模拟物已成为当今化学生物学界重要的研究课题[70-74]。
近年来,本课题组[28-29,33]应用改进的氯化硝基四氮唑蓝光照还原法研究了含芳胺及二肽的铜ギ配合物:[Cu(Gly-Gly)(Dppz)]·2H2O、[Cu(Gly-Gly)(Tatp)]·2H2O、[Cu(Gly-Gly)(Phen)]·3H2O 和 [Cu(Gly-β-Ala)(Tatp)]·2H2O的SOD活性,发现这些配合物对O2-·的半抑制率IC50分别为 0.522、0.504、0.407和0.367 μmol·L-1,对应的表观催化速率常数KQ值为1.08×107、1.11×107、1.20×107和 1.53×107mol-1·L·S-1,由此推测这些配合物具有良好的超氧化歧化酶 (SOD)活性。对比他人研究结果(表2)发现,上述具有N4O型变形四方锥配位结构配合物的SOD活性较平面四边形、三角双锥形、八面体形等配位结构配合物要高,这可能主要归因于这些配合物在水溶液中均具有类似于天然SOD活性中心Cuギ的变形四方锥配位结构,具有一个相对柔性的配位环境,在溶液中易与O2-·作用,Cuギ变形四方锥配位结构与Cuガ变形四面体配位结构容易发生相互转化,氧化还原循环容易进行,因而能较快地催化O2-·歧化分解,显示出较高的SOD活性。研究还发现配合物催化O2-·歧化分解的活性随着多吡啶芳环配体增大而减小,推测这是因为多吡啶芳环配体Phen、Tatp和Dppz均为疏水性配体,且其疏水性作用随着芳环增大而增强,而疏水作用不利于带有负电荷的O2-·接近中心铜离子。另外,为了进一步深入研究配合物的SOD活性,应用循环伏安法研究了这些配合物的电化学性质,由此进一步证实了这些配合物均具有催化超氧阴离子自由基歧化分解的SOD活性。
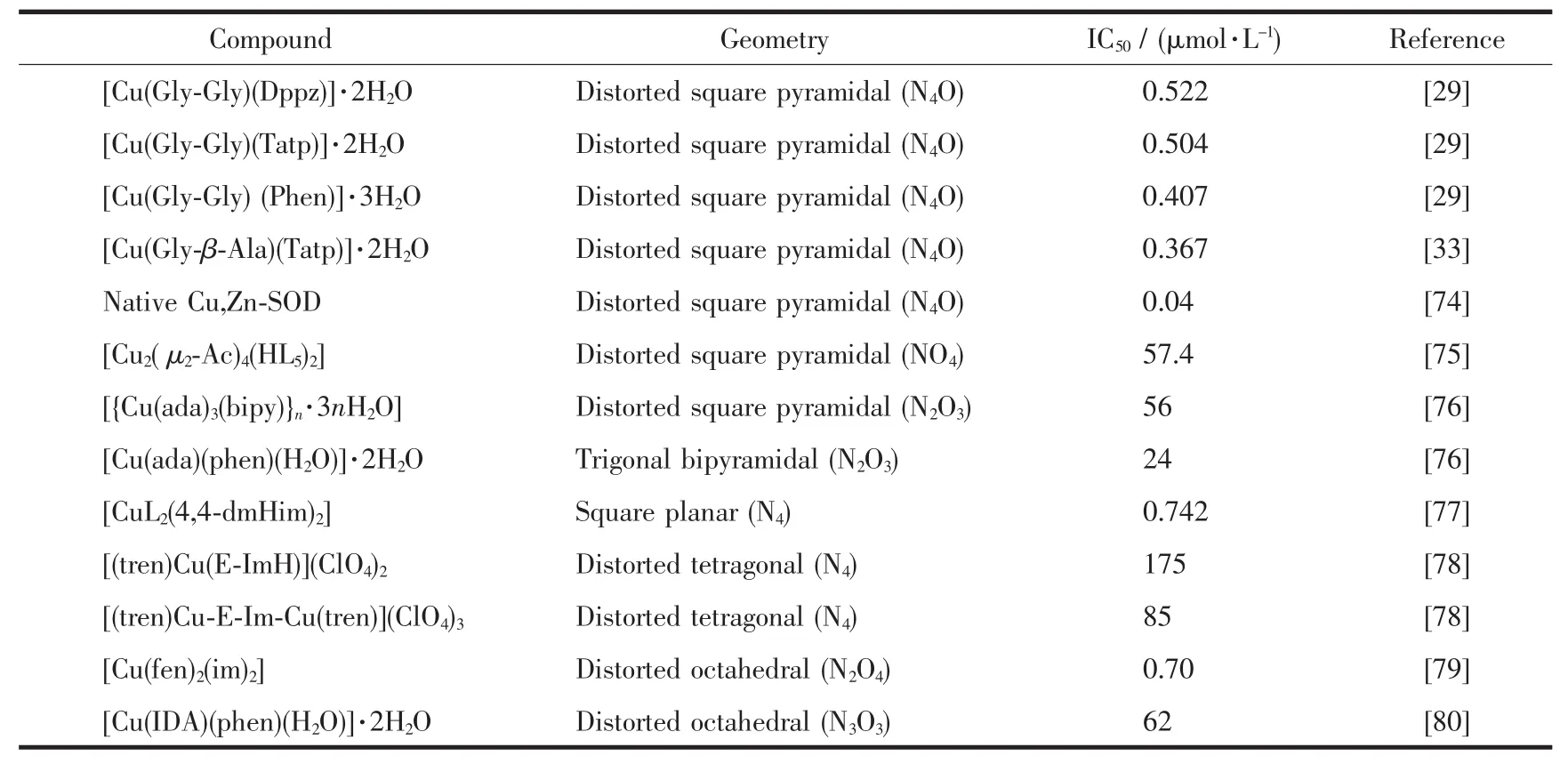
表2 几种不同几何构型的配合物和天然SOD酶的IC50值Table 2 IC50 values of several complexes with different geometry and the native enzyme
此外,本课题组正在对含芳胺及二肽的铜ギ配合物进行深入细致的研究,进一步优化其组成与结构,为开发具有应用前景的SOD模拟物提供科学依据。
2.3 肿瘤化疗药物
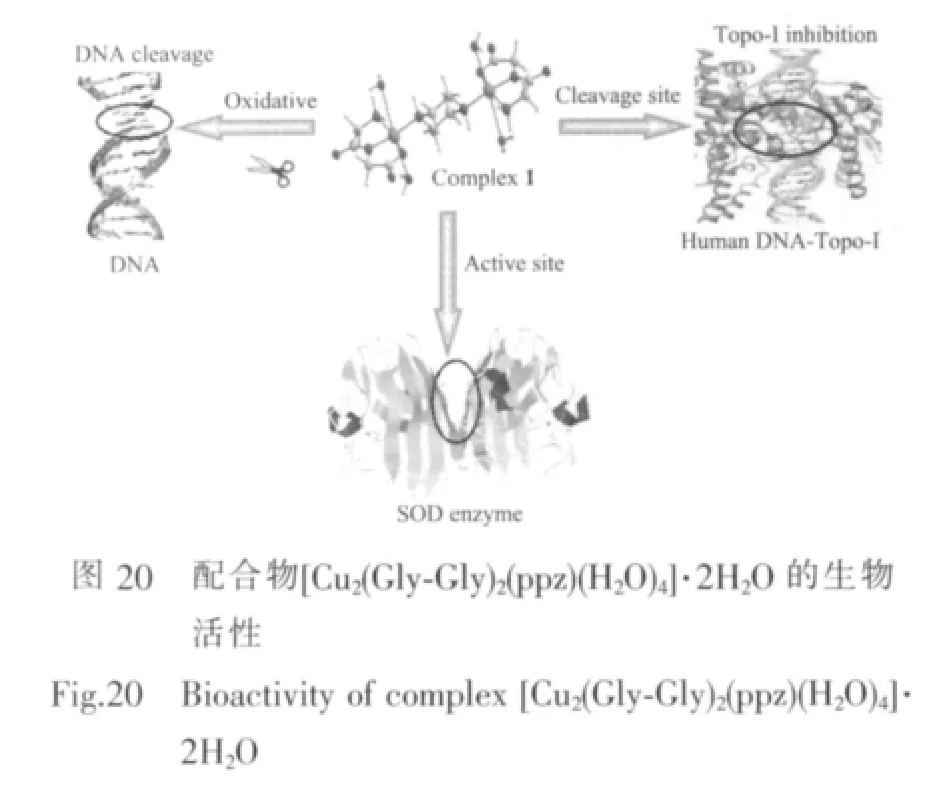
自从Rosenberg等[81-82]首次发现顺铂能抑制细胞生长,具有抗肿瘤活性以来,人们对金属配合物的抗肿瘤研究就一直没有中断,期待发现疗效更高、适用范围更广、毒副作用更低、更经济的肿瘤化疗药物品种。 最近,Tabassum 等[60]由 Gly-Gly、Cu(NO3)2和ppz合成了配合物[Cu2(Gly-Gly)2(ppz)(H2O)4]]·2H2O,并且研究了该配合物的生物活性。研究结果发现,该配合物对DNA具有氧化切割作用、对拓扑异构酶I最小抑制浓度接近12.5μmol·L-1,以及SOD活性的IC50值为 0.086 μmol·L-1(图 20)。 在此研究基础上,Tabassum等[61]通过光谱学及分子对接技术进一步研究了该配合物与人血清白蛋白(HSA)的相互作用和光切割活性,发现该配合物通过静电和疏水作用于HSA的214位氨基酸Trp(图21),通过羟基自由基对HSA进行光切割,并对不同组织源的人类肿瘤细胞系有着较好的杀伤作用。由此可见,该配合物在抑制肿瘤细胞DNA复制、抑制肿瘤细胞拓扑异构酶活性、清除自由基和抗氧化等方面起到很好的作用,有望成为一种新型、有效的肿瘤化疗药物,有关药物活体药理,毒理等试验有待进一步研究。因此,进一步深入研究含芳胺及二肽的铜ギ配合物的抗肿瘤活性,并深入探究其作用机制,对开发出新型、低毒、高效的肿瘤化疗药物具有重要意义。
3 研究展望
一直以来,国内外学者在含芳胺及二肽的铜ギ配合物的合成、结构表征及其与DNA相互作用研究等方面做了大量工作,但对这类配合物其它的潜在功能,例如SOD模拟、抗肿瘤、抗菌等方面研究甚少,有待于进一步深入研究。未来的研究将倾重于:(1)寻找含芳胺及二肽的铜ギ配合物作用的新靶点,研究其抗肿瘤活性,并深入探究其作用机理。(2)研究此类配合物的抗菌活性,并探索其抗菌机理,为开发一类新型有机-无机复合抗菌剂提供理论依据;(3)探究此类配合物SOD活性的构效关系及其抗逆(抗盐、抗旱等)作用机制,优化配合物组成与结构,为研制高效、低毒、绿色的新型植物生长抗逆增产剂及绿色农药提供科学依据。
[1]GAO Chao-Ming(高朝明),MENG Fan-Zong(孟繁宗).J.Dezhou Teacher′s College(Dezhou Shizuan Xuebao),1997,13(2):51-54
[2]Sugimori T,Masuda H,Ohata N,et al.Inorg.Chem.,1997,36(4):576-583
[3]Devereux M,O′Shea D,Kellett A,et al.J.Inorg.Biochem.,2007,101(6):881-892
[4]LU Yan-Mei(卢艳梅),OU Zhi-Bin(区志斌),LIU Hai-Feng(刘海峰),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(4):704-710
[6]Guiotto A,Calderan A,Ruzza P,et al.Curr.Med.Chem.,2005,12(20):2293-2315
[7]Kitts D D,Weiler K.Curr.Pharm.Des.,2003,9(16):1309-1323
[8]Yagasaki M,Hashimoto S.Appl.Microbiol.Biotechnol.,2008,81(1):13-22
[9]Vetsch W.Food Chem.,1985,16(3-4):245-258
[10]Renwick A G.Food Addit.Contam.,2006,23(4):327-338
[11]Sallam A,Steinbüchel A.Appl.Microbiol.Biotechnol.,2010,87(3):815-828
[12]Bonomo R P,Bruno V,Conte E,et al.Dalton Trans.,2003(23):4406-4415
[13]Boudesocque S,Damaj Z,Dupont L,et al.J.Inorg.Biochem.,2008,102(7):1514-1522
[14]Bellia F,Amorini A M,Mendola D L,et al.Eur.J.Med.Chem.,2008,43(2):373-380
[15]Facchin G,Kremer E,Barrio D A,et al.Polyhedron,2009,28(12):2329-2334
[16]Bell J D,Freeman H C,Wood A M,et al.J.Chem.Soc.D:Chem.Commun.,1969(23):1441-1443
[17]GUOXiu-Ying(郭秀英),WANGFeng-Shan(王凤山).J.Inner Mongolia Normal Univ.:Nat.Sci.Ed.(Neimenggu Mingzu Shifan Xueyuan Xuebao:Ziran Kexue Ban),1996,11(2):160-163
[18]Garcia-Raso A,Fiol J J,Adrover B.Polyhedron,1996,15(11):1829-1834
[19]Garcia-Raso A,Fiol JJ,Adrover B,et al.Polyhedron,2003,22(25-26):3255-3264
[20]Reddy P R,Rao K S,Mohan S K.Chem.Biol.,2004,1(6):839-853
[21]Sugimor T,Shibakawa K,Masuda H,et al.Inorg.Chem.,1993,32(22):4951-4959
[22]Li L,Zhu M L,Lu L P.Acta Cryst.,2006,C62(6):227-228
[23]Marzilli L G,Wilkowski K,Chiang C C,et al.J.Am.Chem.Soc.,1979,101(25):7504-7510
[24]Patil S,Kumar A,Padalia B D,et al.Spectrochim.Acta Part A:Mol.Biomol.Spectr.,1985,41(3):495-498
[25]Nair M S,Santappa M,Natarajan P.Inorg.Chim.Acta,1980,41(1):7-10
[26]]Reddy PR,Manjula P.Chem.Bio.,2007,4(3):468-480
[27]Garcia-Raso A,Fiol JJ,Adrover B,et al.J.Inorg.Biochem.,2003,95(2-3):77-86
[28]DING Yang(丁杨),REN Xiang-Xiang(任祥祥),SHEN Shu-Yi(沈淑仪),et al.J.South China Agriculture Univ.:Nat.Sci.Ed.(Huanan Nongye Daxue Xuebao:Ziran Kexue Ban),2010,31(1):108-111
[29]DING Yang(丁杨),SHEN Shu-Yi(沈淑仪),REN Xiang-Xiang(任祥祥),et al.Chem.Bull.(Huaxue Tongbao),2009,72(10):922-926
[30]DING Yang(丁杨),REN Xiang-Xiang(任祥祥),ZHUANG Chu-Xiong(庄楚雄),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(4):656-662
[31]DING Yang(丁杨),REN Xiang-Xiang(任祥祥),WANG Cai-Xia(王彩霞),et al.Chem.Res.Appl.(Huaxue Yanjiu Yu Yingyong),2010,22(3):283-287
[32]DING Yang(丁杨).Master Dissertation of South China Agriculture University(华南农业大学硕士论文).2008.
[33]DING Yang(丁杨),DENG Jian-Sheng(邓剑生),LE Xue-Yi(乐学义).Chinese J.Org.Chem.(Zhongguo Youji Huaxue),2011,31(7):1081-1086
[34]Bhirud R G,Srivastava T S.Inorg.Chim.Acta,1991,179(1):125-131
[35]Deshpande SV,Srivastava T S.Inorg.Chim.Acta,1983,78(2):75-80
[36]Lim M C,Sinn E,Martin R B.Inorg.Chem.,1976,15(4):807-811
[37]Simmons C J,Lundeen M,Seff K.Inorg.Chem.,1978,17(6):1429-1435
[38]Akira O,Maki O,Kaname I,et al.Sakutai Kagaku Toronkai Koen Yoshishu,2000,50:570-574
[39]Deshpande SV,Srivastava T S.Polyhedron,1983,2(8):761-767
[40]Yajima T,Okajima M,Odani A,et al.Inorg.Chim.Acta,2002,339:445-454
[41]Reddy P R,Raju N,Satyanarayana B.Chem.Bio.,2011,8(1):131-144
[42]Le X Y,Zhou X H,Song Z J,et al.J.Coord.Chem.,2003,56(10):861-867
[43]Zhou X H,Yang C,Le X Y,et al.J.Coord.Chem.,2004,57(5):401-409
[44]Zhou X Y,Le X H,Chen S.J.Coord.Chem.,2005,58(12):993-1001
[45]Le X Y,Liao SR,Liu X P,et al.J.Coord.Chem.,2006,59(9):985-995
[46]Le X Y,Gu Q,Song Z J,et al.J.Coord.Chem.,2007,60(13):1359-1371
[47]Liu W L,Zou Y,Ni C L,et al.J.Coord.Chem.,2004,57(11):899-906
[48]Sigel H.Inorg.Chem.,1975,14(7):1535-1540
[49]Sigel H,Prijs B,Martin R B.Inorg.Chim.Acta,1981,56(2):45-49
[50]Sigel H,Naumann C F,Prijs B,et al.Inorg.Chem.,1977,16(4):790-796
[51]Nakao Y,Mori W,Sakurai T,et al.Inorg.Chim.Acta,1981,55(4):103-107
[52]Matsumoto K,Ooi S,Nakao Y,et al.J.Chem.Soc.,Dalton Trans.:Inorg.Chem.,1981(10):2045-2048
[53]Deshpande SV,Srivastava T S.Polyhedron,1984,3(4):463-467
[54]Mori W,Sakurai T,Nakahara A,et al.Inorg.Chim.Acta,1987,132(2):247-252
[55]WANG Feng-Shan(王凤山),GUO Shi-Shan(郭石衫),HUANG Dong-Lv(黄东律).Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),1992,13(7):884-888
[56]GUO Xiu-Ying(郭秀英),ZHANG Wen-Xiang(张文祥),CUI Ai-Li(崔爱莉),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),1998,19(4):629-632
[57]WANG Feng-Shan(王凤山),CUI Ai-Li(崔爱莉),CHEN Hai-Ming(陈海明),et al.Chem.J.Chinese Universities(Gaodeng Xuexiao Huaxue Xuebao),1994,15(3):319-322
[58]Lou B Y,Huang X D,Lin Q.Z.Anorg.Allg.Chem.,2010,636:2539-2542
[59]Lou B Y,Wei Y Q,Lin Q.Crystengcomm,2012,14(6):2040-2045
[60]Tabassum S,AI-Asbahy W M,Afzal M,et al.Dalton Trans.,2012,41(16):4955-4964
[61]Tabassum S,AI-Asbahy W M,Afzal M,et al.Mol.Biosyst.,2012,8(9):2424-2433
[62]Gatlin C L,Rao R D,Turecek F,et al.Anal.Chem.,1996,68(2):263-270
[63]Gergely A,Farkas E.J.Chem.Soc.,Dalton Trans.:Inorg.Chem.,1982(2):381-386
[64]Sovago I,Kiss A,Farkas E,et al.J.Inorg.Biochem.,1997,65(2):103-108
[65]Nair M S,Santappa M,Natarajan P.J.Chem.Soc.,Dalton Trans.:Inorg.Chem.,1980,11:2138-2142
[66]LU Yan-Mei(卢艳梅),LE Xue-Yi(乐学义).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(2):199-213
[67]Holm R H,Kennepohl P,Solomon E I.Chem.Rev.,1996,96(7):2239-2314
[68]LIU Yuan-Dong(刘元东),LIU Chu-Gan(刘楚干),QIU Guan-Zhou(邱冠周).Progress in Modern Biomedicine(Xiandai Shengwu Yixue Jinzhang),2008,8(6):1057-1060
[69]LIN Qing-Bin(林庆斌),LIAO Sheng-Rong(廖升荣),XIONG Ya-Hong(熊亚红),et al.Chem.World(Huaxue Shijie),2006,47(6):378-381
[70]Zhou Y H,Fu H,Zhao W X,et al.Inorg.Chem.,2007,46(3):734-739
[71]Patel M N,Gandhi DS,Parmar PA.Inorg.Chem.Commun.,2011,14(1):128-132
[72]Abuhijleh A L,Khalaf J.Eur.J.Med.Chem.,2010,45(9):3811-3817
[73]Starha P,Travnicek Z,Herchel R,et al.J.Inorg.Biochem.,2009,103(3):432-440
[74]Fu H,Zhou Y H,Mao Z W,et al.J.Am.Chem.Soc.,2006,128(15):4924-4925
[75]Novotna R,Herchel R,Travnicek Z.Polyhedron,2012,34(1):56-66
[76]Siddiqi Z A,Sharma P K,Shahid M,et al.Spectrochim.Acta Part A:Mol.Biomol.Spectr.,2012,93:280-289
[77]Casanova J,Alzuet G,Ferrer S,et al.Inorg.Chim.Acta,2000,304(2):170-177
[78]Patel R N.Spectrochim.Acta.Part A:Mol.Biomol.Spectr.,2004,60(10):2201-2208
[79]Agotegaray M A,Dennehy M,Boeris M A,et al.Polyhedron,2012,34(1):74-83
[80]Siddiqi Z A,Shahid M,Khalid M,et al.Eur.J.Med.Chem.,2009,44(6):2517-2522
[81]Rosenberg B,VanCamp L,Trosko J E,et al.Nature,1969,222(5191):385-386
[82]Rosenberg B.Cancer Chemother.Rep.,1975,59(3):589-598
