N-苯胺叉二乙酸根与4,4′-联吡啶构筑的一维梯状铜ギ配位聚合物的合成、结构与磁性
2013-09-15王小兵刘宏文卢文贯
王小兵 刘宏文 卢文贯
(韶关学院化学系,韶关 512005)
近年来,由于结构上的多样性和在催化[1-3]、化学发光[4-7]、气体的选择性吸附与分离[8-9]、磁性[10-14]以及手性拆分[15-19]等领域具有广阔的应用前景,设计和合成新型的金属-有机配位聚合物一直是众多化学工作者的一个研究热点问题。芳香羧酸类配体由于羧基配位能力强,配位方式多样化,经常被用于构筑金属-有机配位聚合物[4-6,11]。而芳香氨基羧酸类有机配体由于同时具有可以参与配位的羧基氧原子以及氮原子,配位方式显得更为灵活多变,也已广泛应用于构筑金属-有机配位聚合物[20-25]。此外,在金属-有机配位聚合物的设计与合成过程中,通常引入一些间隔基团,例如刚性的4,4′-联吡啶(4,4′-bpy)等作为辅助配体,它可以诱导出具有各种特殊结构的配位聚合物的形成[26-28]。我们以一种新合成的新型氨基多羧酸类配体N-苯胺叉二乙酸(C6H5N(CH2COOH)2,H2L)为主配体,以 4,4′-bpy 作为辅助配体,在常温条件下与Cu(ClO4)2反应,采用溶剂挥发的方法得到了一个结构新颖的一维梯状配位聚合物{[Cu2L2(H2O)(4,4′-bpy)]·DMF·3H2O}n(1),通过元素分析、红外光谱、热重等对它的组成和结构进行了表征,并用单晶X-射线衍射分析测定了它的晶体结构。配位聚合物1的变温磁化率实验测试结果表明在它们的铜ギ离子间存在反铁磁相互作用。本文将报道它的的合成、晶体结构及磁性质。
1 实验部分
1.1 试剂与仪器
配体N-苯胺叉二乙酸 [C6H5N(CH2COOH)2,H2L]按照文献方法合成[20]。其余试剂为市售分析纯,未经进一步纯化直接使用。Vario EL CHNS-O元素分析仪;Nicolet 330 FTIR红外光谱仪 (4 000~370 cm-1,KBr压片法);Netzsch TG-209热重分析仪 (空气氛,升温速率 10℃·min-1);磁性测量采用 Quantum Design MPMS-XL7 SQUID磁学性质测量仪,磁性数据经过Pascal常数和样品架背景的抗磁矫正。
1.2 配合物1的合成
将 0.105 g(0.5 mmol)N-苯胺叉二乙酸(C6H5N(CH2COOH)2,H2L),0.185 g(0.5 mmol)Cu(ClO4)2·6H2O分别溶于5 mL水后,在磁力搅拌下将Cu(ClO4)2溶液缓慢地逐滴加入N-苯胺叉二乙酸的溶液中,搅拌1 h 后,将 0.039 g(0.25 mmol)4,4′-联吡啶甲醇溶液(10 mL)加入上述混合液中,继续搅拌2 h后,生成大量绿色沉淀,过滤,沉淀用10 mL的DMF和甲醇混合溶液(体积比为1∶1)溶解,再次过滤,滤液常温静置,一周后析出绿色块状晶体。产率为:46%(以Cu 计)。 元素分析计算值 C33H45Cu2N5O15(1·2H2O)(%):C,45.10;H,5.16;N,7.97; 测定值 (%):C:45.31;H,4.87;N,8.00。 主要的红外吸收峰:IR(KBr,cm-1):1637(m),1617(m),1143(m),1122(s),871(w),822(m),467(w)。
1.3 晶体结构的测定
在 293(2)K 下,选取大小为 0.36 mm×0.32 mm×0.30 mm的配合物单晶, 在 Bruker SMART 1000 CCD单晶衍射仪上,用经石墨单色器单色化的 Mo Kα 射线 (λ=0.071 073 nm), 以 ω/2θ方式在1.94°≤θ≤26.00°范围内收集到 11 070 个衍射数据,其中 6 951 个独立衍射点(Rint=0.035 4),I≥2σ(I)的可观测衍射点4 985个。晶体结构采用直接法解得,并对全部非氢原子坐标及各向异性热参数进行了全矩阵最小二乘法修正。水分子上的氢原子从差值傅立叶图上找出,其它氢原子用理论加氢的方法得到。所有的计算均使用SHELXTL程序完成。表1给出了配合物1的晶体学数据,部分键长及主要键角则列于表2。

表1 配合物1的晶体学数据Table 1 Crystal structure parameters of complex 1
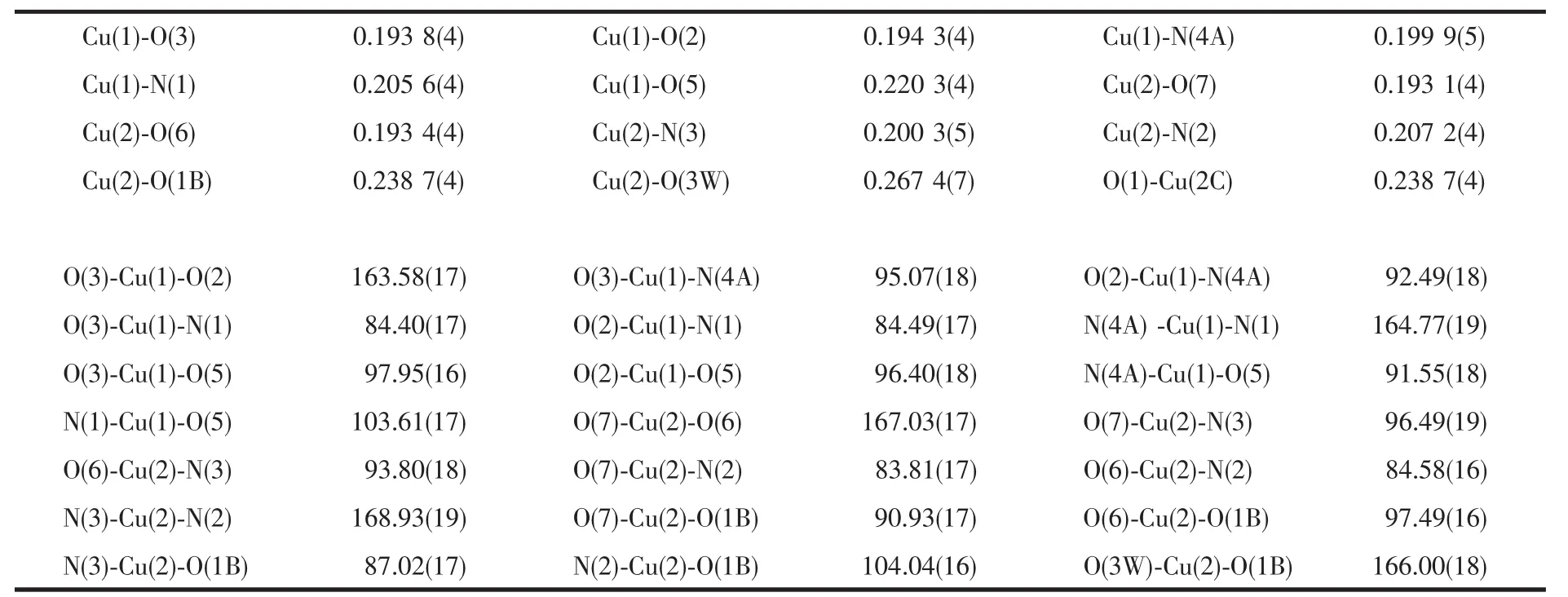
表2 配合物1的部分键长及主要键角Table 2 Selected bond distances(nm)and bond angles(°)of complex 1
CCDC:871729。
2 结果与讨论
2.1 晶体结构
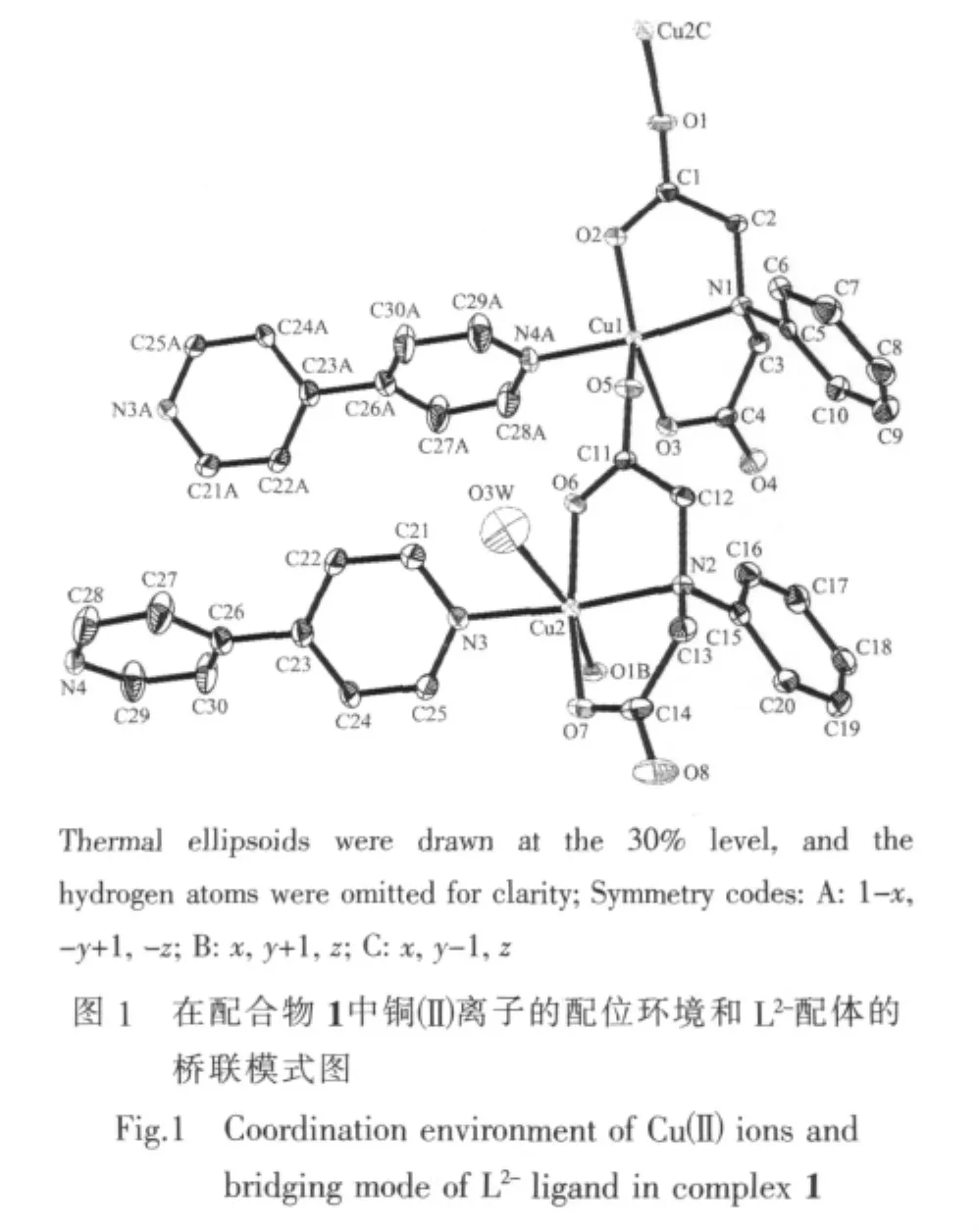
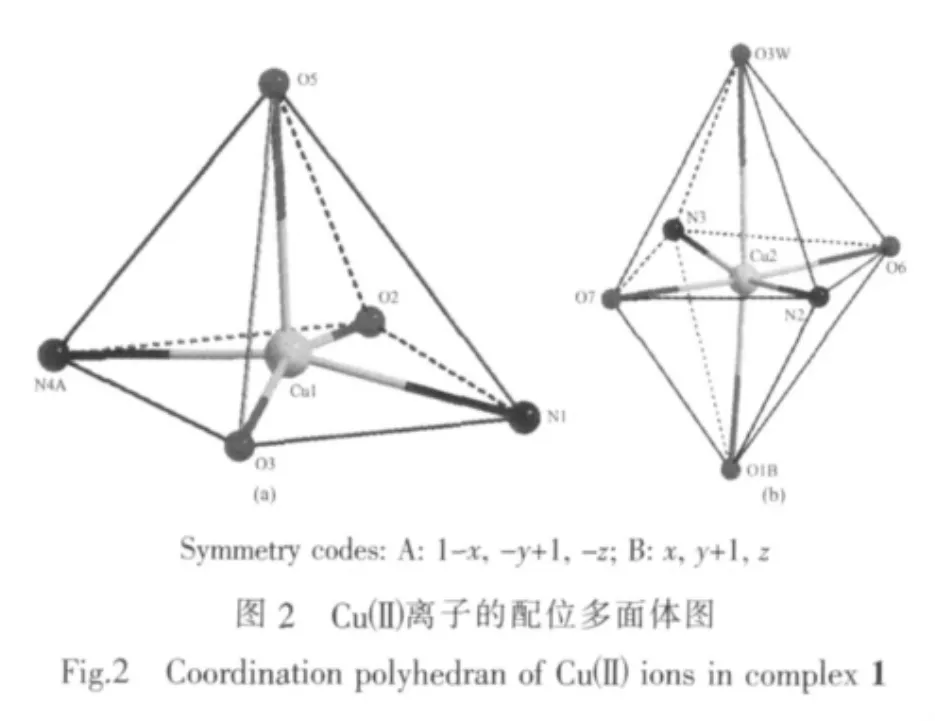
单晶X-射线分析测定结果表明,配合物1属于三斜晶系,空间群为P1。在它的不对称结构单中元包含2个Cuギ离子(Cu(1)和Cu(2)),2个配位模式相同的 N-苯胺叉二乙酸根(μ2-L2-)配体,1 个 4,4′-联吡啶(μ2-4,4′-bpy)配体,1 个 DMF 分子,1 个配位水分子(O3W)和3个晶格水分子(O1W,O2W和O4W)。如图1所示,Cu(1)与来自于2个不同的μ2-L2-配体的1个氮原子N(1)和3个羧基氧原子O(2)、O(3)和O(5),以及 1 个 μ2-4,4′-bpy配体的一个氮原子 N(4A)配位,形成了配位数为5的四方锥配位环境。其中O(5)占据了锥顶位置,N(1),O(2),O(3)和 N(4A)则位于四方锥的底面(图2a),其最小二乘平面的平均偏差为 0.015 60 nm,Cu(1)偏离该平面 0.002 40 nm。Cu(2)则与来自于2个不同的μ2-L2-配体的1个氮原子 N(2)和 3 个羧基氧原子(O(6)、O(7)和 O(1B)),1 个μ2-4,4′-bpy配体的1个氮原子N(3), 以及1个配位水分子 (O3W)配位形成了配位数为6的扭曲八面体配位环境(图 2b)。 其中 N(2),N(3),O(6)和 O(7)位于赤道平面,其最小二乘平面的平均偏差为0.004 04 nm,Cu(2)偏离该平面 0.015 57 nm,O(1B)和O(3W)则占据轴向位置,O(1B)-Cu(2)-O(3W)键角为166.00(18)°。沿b轴方向,2种配位环境的不同Cuギ离子(Cu(1)和Cu(2))通过μ2-L2-配体连接形成了[Cu2(μ2-L)2(H2O)]n的一维锯齿形链状结构(图 3),链内Cuギ离子(Cu(1)和Cu(2))之间的距离是0.541 6 nm。2个一维锯齿链再通过μ2-4,4′-bpy配体中的2个氮原子(N(3)和N(4))分别连接2个Cuギ离子(Cu(1)和 Cu(2)),沿 bc 平面形成了[Cu2(μ2-L)2(H2O)(μ2-4,4′-bpy)]n一维梯状的双链结构(图 3),链间两个Cuギ离子(Cu(1)和Cu(2))之间的距离是1.105 7 nm。DMF 和 O(1W),O(2W),O(3W)及 O(4W)等水分子分布在 2 条[Cu2(μ2-L)2(H2O)(μ2-4,4′-bpy)]n梯状链之间,它们之间、以及它们与来自于μ2-L2-配体的羧基氧原子之间形成了众多的氢键(图4a及表3)。也正是这些氢键作用将[Cu2(μ2-L)2(H2O)(μ2-4,4′-bpy)]n一维梯状链之间连接形成了二维结构(图4b)。
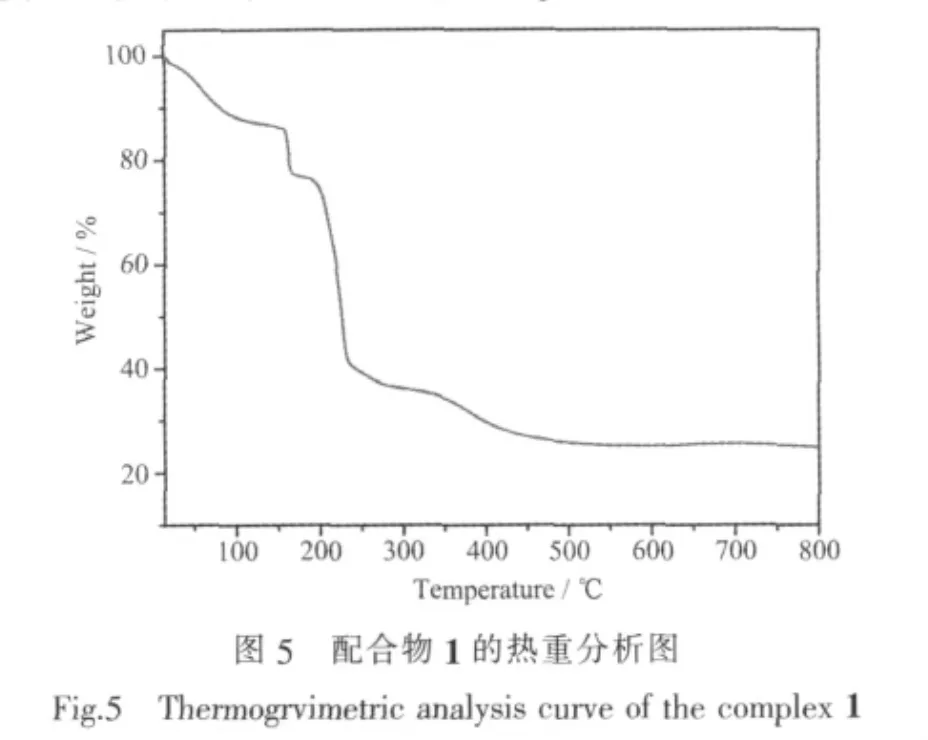
2.2 配合物的热稳定性
在空气氛下的热重分析结果(图5)表明,配合物1从室温开始失重,在150℃左右失重13.9%,略大于失去配位水分子和晶格水分子的重量 (理论值为12.3%),这可能是由于配合物1在测试前从空气中吸收了水分子的缘故。从150到190℃左右失重10.1%,也相应高于失去1个DMF溶剂分子的重量(理论值为 7.0%)。 继续升温,配合物 1 中的 μ2-4,4′-bpy和μ2-L2-有机配体逐渐分解,骨架开始坍塌,到500℃左右配合物1分解完毕。
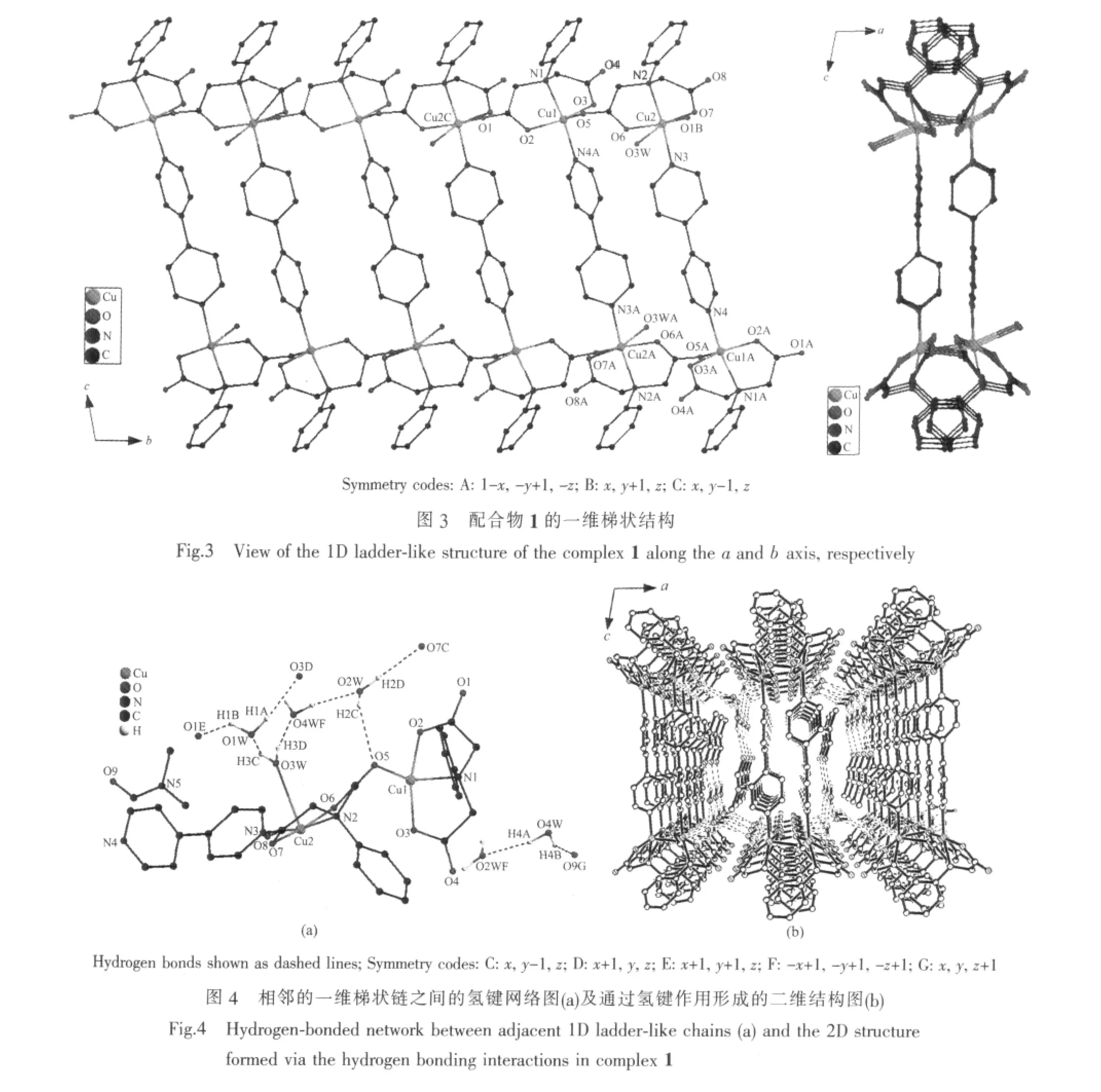
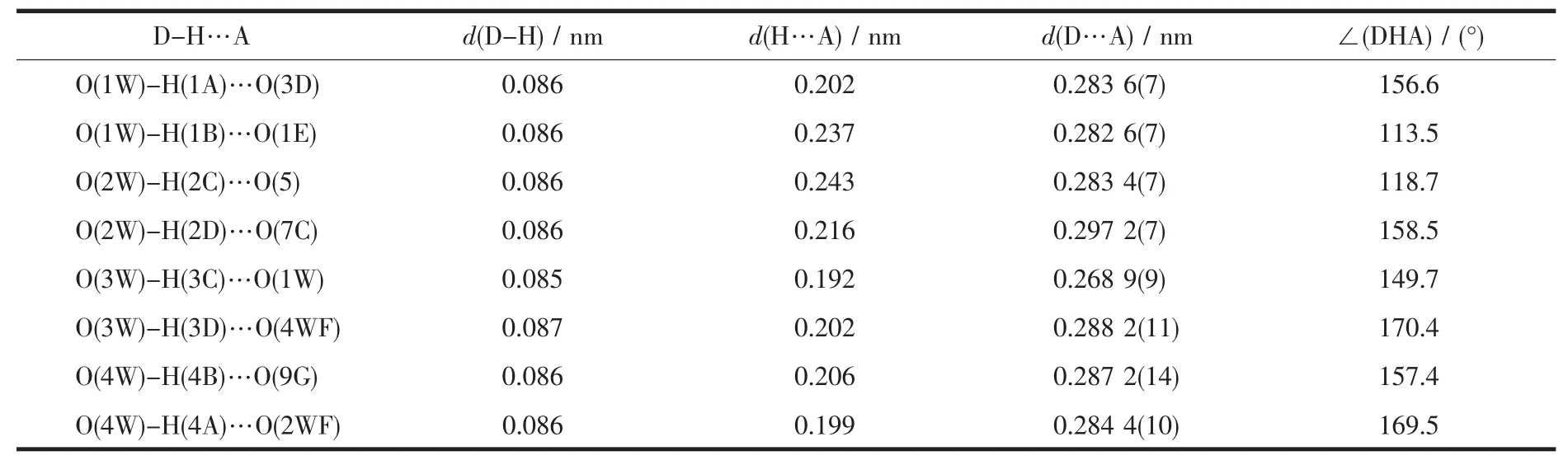
表3 配合物1的氢键键长及键角Table 3 Hydrogen bonds distances and angles for complex 1
2.3 配合物的磁性质
配合物1的变温磁化率(2~300 K)在外场1 000 Oe下使用粉末样品测得,如图6所示。室温时,χMT值为 1.478 cm3·mol-1·K,略低于一个孤立的 Cuギ离子(SCu=1/2,g=2.0)的预期值 1.732 cm3·mol-1·K。随着温度的降低,χMT值缓慢下降,到30 K时为1.439 cm3·mol-1·K,然后快速下降,在 2.0 K 时达到 1.160 cm3·mol-1·K, 这说明在配合物1中 Cuギ离子之间存在典型的反铁磁性耦合作用。在2~300 K的温度范围内,配合物1的磁化率很好地遵守Curie-Weiss定律 χM=C/(T-θ)。经过拟合得 Curie 常数 C=1.481 cm3·mol-1·K,Weiss 常数 θ=-0.769 K,负的 θ值进一步证明了在配合物1中Cuギ离子之间存在反铁磁性耦合作用。
3 结 论
以柔性芳香氨基羧酸N-苯胺叉二乙酸(C6H5N(CH2COOH)2,H2L)作为有机配体,4,4′-联吡啶(4,4′-bpy)为桥连配体,在常温下通过溶剂挥发方法得到了一个新的一维梯状配合物{[Cu2L2(H2O)(4,4′-bpy)]·DMF·3H2O}n(1),对它进行了单晶结构测试、元素分析、红外光谱、热重分析等表征,磁性测试结果表明该配合物的Cuギ离子间存在反铁磁性耦合作用。
[1]Bao S S,Ma L F,Wang Y,et al.Chem.Eur.J.,2007,13:2333-2343
[2]Aillaud I,Collin J,Duhanyon C,et al.Chem.Eur.J.,2008,14:2189-2202
[3]Barder TE.J.Am.Chem.Soc.,2006,128:898-904
[4]LIU Hong-Wen(刘宏文),LU Wen-Guan(卢文贯).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(1):152-156
[5]Yang J,Yue Q,Li G D,et al.Inorg.Chem.,2006,45:2857-2865
[6]Chen B L,Wang L B,Zapata F,et al.J.Am.Chem.Soc.,2008,130:6718-6719
[7]Thibon A,Pierre V C.J.Am.Chem.Soc.,2009,131:434-435
[8]Zhong D C,Lin J B,Lu W G,et al.Inorg.Chem.,2009,48:8656-8658
[9]Devic T,Serre K,Audebrand N,et al.J.Am.Chem.Soc.,2005,127:12788-12789
[10]Zeng M H,Yao M X,Liang H,et al.Angew.Chem.,Int.Ed.,2007,46:1832-1835
[11]LÜ Dong-Yu(吕 东 煜),GAO Zhu-Qing(高 竹 青),GU Jin-Zhong(顾金忠),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27(11):2318-2322
[12]Wang X T,Wang,X H,Gao S,et al.Inorg.Chem.,2009,48:1301-1302
[13]Chen H J,Gao S,Chen X M,et al.Chem.Commun.,2001:2320-2321
[14]Zhao J P,Hu B W,Bu X H,et al.Inorg.Chem.,2009,48:2482-2489
[15]Mantion A,Massuger L,Rabu P,et al.J.Am.Chem.Soc.,2008,130:2517-2526
[16]Jouaiti A,Hosseini M W,Kyritsakas N.Chem.Commun.,2002:1898-1899
[17]Telfer SG,Kuroda R.Coord.Chem.Rev.,2003,242:33-46
[18]Demko Z P,Sharpless K B.Angew.Chem.,Int.Ed.,2002,41:2110-2113
[19]Li X Z,Li D.Angew.Chem.,Int.Ed.,2008,120:6471-6474
[20]WANG Xin-Yi(王新益),LI Jun-Ran(李俊然),GAO Song(高松),et al.Chem.J.Chin.Univ.(Gaodeng Xuexiao Huaxue Xuebao),2002,27(1):152-156
[21]Wang C C,Yang C H,Lee C H,et al.Inorg.Chem.,2002,41:429-432
[22]Mukhopadhyay S,Chatterjee P B,Mandal D,et al.Inorg.Chem.,2004,43:3413-3420
[23]Yong G P,Wang Z Y,Chen J T.J.Mol.Struct.,2004,707:223-229
[24]Lou B Y,Yuan D Q,Wu B L,et al.Inorg.Chem.Commun.,2005,8:539-542
[25]Xu Y Q,Yuan D Q,Wu B L,et al.Cryst.Growth Des.,2006,6:1168-1174
[26]Lu JY,Ge ZH.Inorg.Chim.Acta,2005,358:828-833
[27]Wang Y L,Yuan D Q,Bi W H,et al.Cryst.Growth Des.,2005,5:1849-1855
[28]Lu WG,Jiang L,Feng X L,et al.Cryst.Growth Des.,2008,8:986-994
