含碳硼烷膦氧配体镍、铱化合物的合成与表征
2013-09-15一飞
蒋 其 柏 季 一飞 沈 旭 杰 燕 红
(南京大学化学化工学院,配位化学国家重点实验室,南京 2 10093)
近几十年来,1,2-二碳代-闭式(或巢式)碳硼烷及其衍生物由于其独特的在催化[1-2]、材料[3-4]、能源[5]和医学[2-6]等方面的应用而备受人们的关注,其中1,2-二硫(或硒)[7-13]和 1,2-二膦取代碳硼烷衍生物[14-17]被化学工作者广泛研究。
碳硼烷膦配体配体的合成自从被报道以来,这些膦配体应用在配位化学和分子自组装化学的工作越来越多。然而,关于含碳硼烷膦氧配体衍生物的工作鲜有报道。本文中利用空气中的氧气为氧源、以碳硼烷1,2-二苯基膦为配体以及三苯基膦氯化镍和1,5-环辛二烯氯化铱为反应原料一锅法合成含巢式碳硼烷膦氧配体的镍、铱化合物1和2,并利用核磁、质谱、红外及单晶衍射等手段进行了化合物的表征,进一步丰富了含碳硼烷的配位化学。
1 实验部分
1.1 试剂与仪器
正丁基锂(2.4 mol·L-1的正己烷溶液,百灵威),氯化二苯基膦(J&K),三苯基膦氯化镍[18]和1,5-环辛二烯氯化铱[19]按照文献制备,柱层层析硅胶(100~200目,试剂级,青岛海洋化工厂分厂),直接由试剂公司购买,使用前做烘干处理。溶剂:乙醚,四氢呋喃,60~90℃石油醚,在氮气气氛下回流,加入钠丝并用二苯甲酮做指示剂,回流溶剂致墨绿色;氯仿加入氢化钙在氮气下回流。碳硼烷1,2-二苯基膦[20]的合成反应应用标准Schlenk技术,并在氩气(BOC级Ar)气氛下操作。
元素 C、H含量测定在 Perkin-Elmer 240C和elementar vario ELⅢ元素分析仪上进行。质谱EIMS由Micromass GC-TOF(70 eV)质谱仪测量。物质熔点由北京技术仪器有限公司的X-6显微熔点测定仪测量。核磁共振谱由Bruker AM-500型核磁共振仪(500 MHz)测定,氘代氯仿(CDCl3)为溶剂,1H NMR:25 ℃,TMS 作为内标(CHCl3δ(1H)=7.27);13C{1H}NMR:25 ℃,CHCl3/CDCl3作为内标(δ(3C)=77.0);11B{1H}NMR:25 ℃,Et2OBF3作为外标(δ(11B)=0),31P{1H}NMR:25 ℃,85%磷酸氘代水溶液作为外标(δ(31P)=0)。 红外光谱(IR)以固体 KBr压片方法,使用Vector-22 Bruker型红外光谱仪(400~4 000 cm-1)测定。
1.2 化合物的1和2的合成
实验均是在常温下将256.4 mg的碳硼烷1,2-二苯基膦配体 (0.5 mmol)与三苯基膦氯化镍(NiCl2(PPh3)2,0.5 mmol) 或 1,5-环 辛 二 烯 氯 化 铱 ([IrCl(COD)]2,0.5 mmol) 溶于 20 mL 氯仿中回流 12 h,减压除去溶剂得红黑色固体粗产品,经硅胶柱柱层析分离得红色固体化合物1、2。用二氯甲烷与石油醚混合溶剂溶解化合物1和2,用溶液挥发法长出红色块状单晶。
化合物 1:1H NMR(CDCl3,ppm):7.67~7.31(40H,Ph),3.14~1.82(18H,Bcarborane-H),-2.31(1H,br,B-H-B),-2.58(1H,br,B-H-B);11B{1H}NMR(CDCl3,ppm):4.8(1B),2.5(1B),0.1(1B),-0.3(1B),-4.2(1B),-5.0(1B),-6.9(1B),-8.8(1B),-10.2(1B),-11.9(1B),-13.5(1B),-15.7(1B),-16.8(1B),-17.4(1B),-26.4(1B),-30.8(1B),-31.9(1B),-33.4(1B);31P {1H}NMR(CDCl3,ppm):54.3,32.8;MS(70 eV):m/z 1 094.2(M+,19%);IR(KBr):ν(cm-1)2 543(B-H);Element.Anal.Calcd.(%)for C52H60B18NiO2P4:C 57.08,H 5.53;Found(%):C 57.20,H 5.47。做元素分析前,把粉末样品在105℃真空干燥箱干燥24 h,以除去溶剂分子。
化合物 2:1H NMR(CDCl3,ppm):7.58~7.26(20H,Ph),3.09~1.98(9H,Bcarborane-H),-2.46(1H,br,B-H-B);11B{1H}NMR(CDCl3,ppm):2.1(1B),-0.8(1B),-4.6(1B),-6.9(1B),-10.7(1B),-14.4(1B),-16.9(1B),-28.8(1B),-32.9(1B);31P{1H}NMR(CDCl3,ppm):52.7,30.2;MS(70 eV):m/z 817.15(M+,56%);IR(KBr):ν(cm-1)2 530(B-H);Element.Anal.Calcd.(%)for C34H41B9IrOP2:C 49.98,H 5.06;Found(%):C 49.79,H 5.03.
1.3 单晶结构测定及晶体学数据
化合物的单晶结构测定:在Bruker SMART APEX CCD衍射仪上收集强度数据,利用石墨单色器单色化了的 Mo Kα 射线(λ=0.071 073 nm),实验温度为 293 K,采用 ω-2θ扫描方式,收集 2θ在 3.2°~52.0°(化合物 1)或 2θ在 3.6°~52.0°(化合物 2)范围内的衍射数据。其衍射数据用SAINT程序进行还原处理,用SADABS程序进行数据校正。晶体初始结构模型,在Pentium PC计算机上用SHELXS-9721结构解析程序,选用直接法解出或Patterson法解出。利用SHELXL-97结构解析程序,采用全矩阵最小二乘法进行结构修正[22]。化合物的氢原子坐标由差Fourier合成和理论加氢程序找出。所有氢原子的坐标和各向同性温度因子参加结构计算,但不参加修正。最后的残余峰均已不具有化学意义。化合物1中有2个氯仿溶剂分子,其中一分子氯仿存在无序,并做了无序的处理。
CCDC:927419,1;927420,2。
2 结果与讨论
2.1 化合物1的合成及其核磁、晶体结构的讨论
金国新课题组已经报道了常温下氩气气氛中的碳硼烷1,2-二苯基膦配体与三苯基膦氯化镍反应[13],生成了双三苯基膦被碳硼烷1,2-二苯基膦配体取代的二氯化镍配合物。考虑到膦配体在空气中易氧化的性质,我们把反应条件由氩气常温环境改变为空气中加热回流的条件,希望一锅法实现碳硼烷膦氧配体及其配合物的合成。
当2个反应底物以1∶1反应(Scheme 1)后,我们同样分离到大概20%产率的与文献[13]相同的化合物,同时分离到约30%极性较大的化合物1。从核磁1H NMR谱图位于化学位移-2.31与-2.58 ppm处的宽峰可以看出化合物1中有2个不等价的B-H-B结构单元,同时11B{1H}NMR谱图上18个独立的硼信号单峰表明了化合物1中碳硼烷的巢式结构,峰的形状与位置与文献相当[7-13]。31P{1H}NMR谱图中2个独立的P信号分别位于54.3和32.8说明了化合物1中存在2种化学环境的P原子,暗示化合物1中的P原子有部分被氧化成P=O键。

表1 配合物1、2的晶体学数据和结构修正参数Table 1 Crystal data and structure refinement parameters for the complex 1 and 2
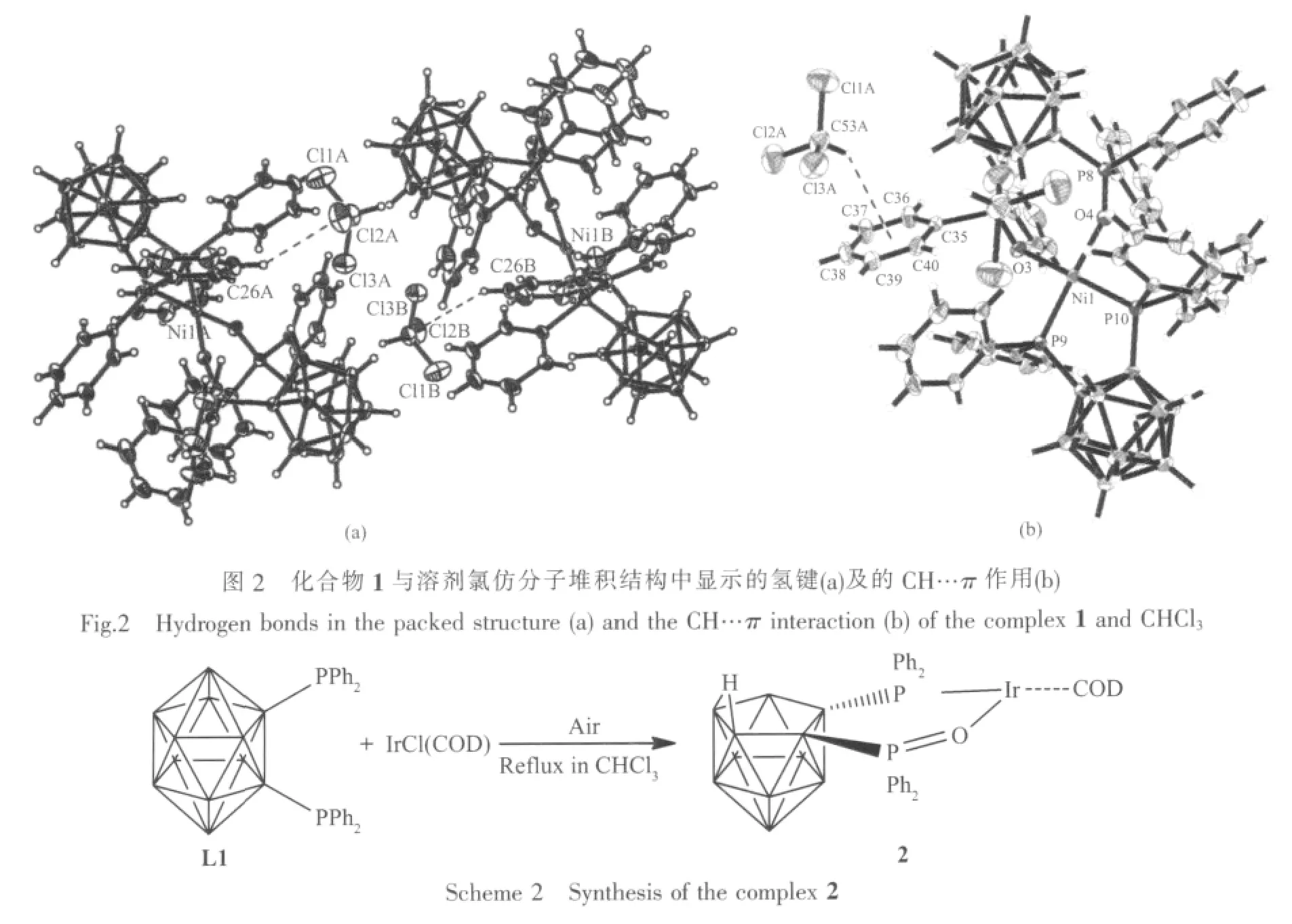
将化合物1溶于二氯甲烷和石油醚的混合溶剂中经由缓慢挥发得到可测试的单晶,单晶结构见Fig.1。从图中可以看出Niギ配位数为4,配位原子分别为P1、P2、O1和 O2,P=O键长为分别为0.150 3(3)nm 和 0.150 6(3)nm,与文献键长类似[23-24]。这 4个配位原子在Niギ离子周围形成1个稍微畸变的平面四边形配位构型,Niギ原子位于平面四边形的中心。键角 O(1)-Ni(1)-O(2)92.03(11)°、O(1)-Ni(1)-P(1)90.16(8)°、O(2)-Ni(1)-P(2)88.88(8)°、P(1)-Ni(1)-P(2)88.94(4)°,总键角为 360.01(4)°。 中心 Niギ离子与 O(1),O(2),P(1)和 P(2)原子几乎在同一平面,O1O2Ni1 平面 与 P1P2Ni1 平 面 的二 面 角为 0.65°。 Ni1-O1、Ni1-O2 的 键 长 分 别 为 0.189 1(3)nm 和 0.189 8(3)nm,而 Ni1-P1、Ni1-P2 的键长为 0.215 31(11)nm 和0.214 54(10)nm,均属正常配位键。值得注意的是在化合物1的堆积图中,溶剂氯仿分子中的Cl2原子与苯环C26原子上的H26存在明显的氢键作用,距离为0.291 nm,同时氯仿分子中的CH与相邻的苯环平面存在CH…π作用,距离为0.284 nm[25],这两种弱作用在生物分子中应用较多。

2.2 化合物2的合成及其核磁、晶体结构的讨论
尝试了碳硼烷1,2-二苯基膦配体在空气中反应一锅法得到了碳硼烷1,2-二苯基膦氧配位化合物1后,我们又使用1,5-环辛二烯氯化铱([IrCl(COD)]2)与二膦配体反应希望更多的获得膦氧配位类型的化合物。
当2个反应底物以1∶1反应(Scheme 2)后,我们分离到约70%极性较大的化合物2。从核磁1H NMR谱图位于化学位移-2.46处的宽峰可以看出化合物2中仅有1个B-H-B结构单元,同时11B{1H}NMR谱图上9个独立的硼信号单峰表明了化合物2中碳硼烷的巢式结构[7-13],峰的形状与化合物1相当。31P {1H}NMR谱图中也存在2个独立的P信号分别位于52.7和30.2说明了化合物2中存在两种化学环境的P原子,同样暗示化合物2中的P原子有部分被氧化成P=O键。
将化合物2溶于二氯甲烷和石油醚的混合溶剂中经由缓慢挥发得到可测试的单晶,单晶结构见Fig.2。这是膦氧配体Ir配合物首例晶体报道,从图中可以看出Irガ配位数为6,配位原子分别为P2、O1和环辛二烯中的双烯碳原子。经二面角计算计算 P1Ir1O1和 Ir1P2O1的二面角较小为 8.52°,而C1C2P1P2平面与P2O1Ir1平面的二面角为45.34°。P=O双键键长为0.151 4(6)nm,明显长与化合物1中的膦氧双键键长,可能的原因是化合物1中金属Ni中心环境较拥挤压迫P=O双键[23-24],使其键长减小,而化合物2中Ir原子中心空间较大。

3 结 论
本文以碳硼烷1,2-二苯基膦配体为原料,以空气中的氧气为氧源一锅法合成了含碳硼烷1,2-二苯基膦氧配体的镍配合物1和铱配合物2。由于金属的不同导致了配合物中膦配体被氧化程度的不同,这不仅丰富了含碳硼烷的配体多样性,也为合成这一类膦氧配体衍生物提供了可借鉴的思路。
[1]Pleek J.Chem.Rev.,1992,92(2):269-278
[2]Grimes R N.Coord.Chem.Rev.,2000,200-202:773-811
[3]ZHOU Quan(周 权),MAO Zu-Ju(茅祖菊),NI Li-Zhong(倪礼忠),et al.Chinese Plast.(Zhongguo Suliao),2006,20(7):6-13
[4]Russell N.Appl.Organomet.Chem.,1996,10:209-225
[5]TANG Jin-Song(唐松青),DINH Hong-Xun(丁宏勋).Chem.Propell.Poly.Mater(Huaxue Tuijinji Yu Gaofenzi Cailiao),2004,2(1):8-11
[6]Cigler P,Kozisek M,Rezacova P.et al.P.Natl.Acad.Sci.USA,2005,102(43):15394-15396
[7]Zhang R,Zhu L,Liu G,et al.J.Am.Chem.Soc.,2012,134(25):10341-10344
[8]Zhong W,Xie M,Jiang Q,et al.Chem.Commun.,2012,48:2152-2154
[9]Xu Z,Han L,Ji C,et al.Dalton Trans.,2011,40:6992-6997
[10]Liu G,Hu J,Wen J,et al.Inorg.Chem.,2011,50:4187-4194
[11]Jin G.Coord.Chem.Rev.,2004,248:587-602
[12]Wang J,Weng L,Jin G.Rev.Inorg.Chem.,2005,25:55-56
[13]Liu S,Han Y,Jin G.Chem.Soc.Rev.,2007,36:1543-1560
[14]Tutusaus O,Nunez R,Vias C,et al.Inorg.Chem.,2004,43:6067-6074
[15]Hampton D.J.Am.Chem.Soc.,1965,87:1817-1818
[16]Dou J,Zhang D,Zhu Y,et al.Polyhedron,2007,26:4216-4222
[17]Teixidor F,Benakki R,Vias C,et al.Organometallics,1998,17:4630-4633
[18]Garton G,Henn D,Powell H,et al.J.Am.Soc.,1963:3625-3633
[19]Tabrizi D,Manoli J,Dereigne A.J.Less-Common Met.,1970,21:337-341
[20]Alexander R,Schroeder H.Inorg.Chem.,1963,22:1107-1110
[21]Sheldrick G M.SHELXS-97,Program for the Solution of Crystal Structures,University of Göttingen,Germany,1990.
[22]Sheldrick G M.SHELXL-97,Program for the Refinement of Crystal Structures,University of Göttingen,Germany,1997.
[23]Sun K,Wang L,Wang Z.Organmetallics,2008,27:5649-5656
[24]Fey N,Harris S,Harvey J,et al.J.Chem.Inf.Model,2006,46:912-916
[25]Tsuzuki S,Honda K,Uchimaru T,et al.J.Phys.Chem.,2002,106(17):4423-4428
[26]Takahashi O,Kohno Y,Nishio M.Chem.Rev.,2010,110(10):6049-6076
