丙戊酸钠对烧伤休克大鼠肺微血管内皮细胞活化和通透性的影响
2013-09-14周国勇贾赤宇
周国勇,胡 森,贾赤宇
严重烧伤早期往往出现大量体液和血浆渗出到体外及第三间隙,其引起的低血容量性休克是严重烧伤后器官功能损伤及预后不良的病理生理基础。在一些特殊情况下,如现代战场或自然灾害现场,常规休克补液治疗往往难以及时实施[1]。因此,休克的药物治疗逐渐发展为目前研究的热点[2-5]。
丙戊酸钠(VPA)是一种组蛋白去乙酰化酶抑制剂(HDACI),以往作为抗癫痫药物。国内外最新研究表明,VPA具有良好的生命维持作用,其表现为可延长动物失血性休克时的存活时间,但作用机制尚不明确[6]。另有研究显示,HDACI可以抑制炎症细胞活化、聚集,减少炎症介质释放,减轻炎症反应[7]。因此我们假设VPA能抑制烧伤休克大鼠肺组织炎症反应,保护微血管内皮细胞功能,降低其肺血管通透性,从而改善重度烧伤休克的预后。为了验证此假设,我们进行了如下实验。
1 材料和方法
1.1 主要试剂和材料 VPA、2-甲基-2-戊烯酸(2M2P,Sigma公司,美国);Rabbit Anti-VEGF、Anti-ICAM-1和Anti-E-selectin(Invitrogen,美国);TUNEL细胞凋亡试剂盒(Roche,美国)。
1.2 50%TBSAⅢ度烫伤休克大鼠模型制备 雄性清洁级SD大鼠,体重220~250 g(军事医学科学院实验动物中心)。购入后适应性饲养1周,自由饮食。实验前12 h禁食,自由饮水。氯胺酮+速眠新(2∶1,0.5 ml/kg)肌注麻醉后,大鼠背、腹部及双下肢备皮,给予水浴(背部及双下肢均为15 s、腹部8 s);假烫组水温为37℃;烫伤组水温为80℃。观察动物一般状况,颈动脉置管监测平均动脉压,烫伤深度病理检查证实。
1.3 实验方案及分组 实验分为假烫组、烫伤组、烫伤+2M2P组与烫伤+VPA组。根据各组死亡率不同补足各时间点存活大鼠至6只(烫伤组除外),总计使用大鼠150只。假烫组和烫伤组程序按上述模型制作过程进行,2M2P组和VPA组在烫伤后即刻皮下注射100 mg/ml相应药物300 mg/kg,假烫组及烫伤组皮下注射3 ml/kg生理盐水。
1.4 取材与指标检测 分别于烫伤后2 h,6 h和12 h处死实验动物。腹主动脉取血,检测红细胞压积(HCT)、丙氨酸转氨酶(ALT)、肌酸激酶同工酶(CK-MB)和肌酐(Cr)。取新鲜肺组织,应用干湿重法检测肺组织含水率,伊文斯蓝(Evans blue,EB)比色法检测肺微血管通透性,HE染色观察肺组织病理变化,免疫组织化学染色Power Vision两步法检测肺微血管内皮细胞(pulmonary microvascular endothelium cell,PMEC)、血管内皮细胞生长因子(VEGF)、E-选择素(E-selectin)和细胞间黏附分子-1(ICAM-1)表达,以CMIAS病理图像分析系统对病理图像进行定量分析,TUNEL法检测肺微血管内皮细胞凋亡率,采用 Spot Advance Version 4.0.2采集图像并分析计算。
2 结果
2.1 50%TBSAⅢ度烫伤休克大鼠模型的鉴定
2.1.1 一般状况:烫伤后大鼠早期即出现精神萎靡、活动少、不进食,死亡前有战栗、抽搐等表现。背、腹部及双下肢烫伤创面呈皮革状,创面发白,部分出现溃疡。
2.1.2 平均动脉压(MAP):致伤后2 h大鼠MAP即迅速下降至约50 mmHg;6 h左右,MAP再次快速下降,随后多数大鼠死亡,12 h存活率为0。
2.1.3 脏器功能及死亡率:致伤后6 h,烫伤组大鼠的血浆CK-MB、ALT、Cr等肝肾脏器功能指标较假烫组显著升高(P<0.05),见表1;烫伤组大鼠6 h和12 h死亡率分别为80%(24/30)和100%(12/12)。
表1 2组大鼠50%TBSAⅢ度烫伤6 h脏器功能变化(±s)
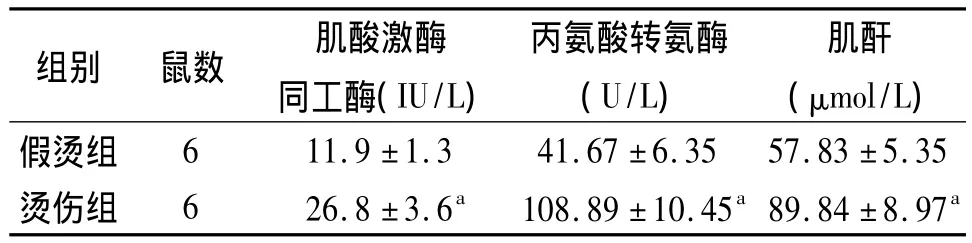
表1 2组大鼠50%TBSAⅢ度烫伤6 h脏器功能变化(±s)
注:烫伤组水浴水温为80℃,假烫组水浴水温为37℃;aP <0.05
组别 鼠数 肌酸激酶同工酶(IU/L)丙氨酸转氨酶(U/L)肌酐(μmol/L)假烫组6 11.9 ±1.3 41.67 ±6.35 57.83 ±5.35烫伤组 6 26.8 ±3.6a 108.89 ±10.45a89.84 ±8.97a
2.2 观察指标
2.2.1 HCT:烫伤组肺组织HCT较假烫组明显增加(P<0.05),烫伤+VPA组及烫伤+2M2P组2 h和6 h HCT均明显低于烫伤组(P<0.05),烫伤+VPA组较烫伤+2M2P组降低更明显(P<0.05),见表2。
2.2.2 肺组织含水率:伤后2 h和6 h,烫伤组肺组织含水率较假烫组明显增加(P<0.05),而烫伤+2M2P组和烫伤+VPA组显著低于烫伤组(P<0.05),但仍高于假烫组。治疗组间相比,烫伤+VPA组各时间点均低于烫伤+2M2P组,但只有6 h差异显著(P <0.05),见表2。
2.2.3 肺血管通透性:伤后2 h和6 h,烫伤组EB含量明显高于假烫组,而烫伤+2M2P组和烫伤+VPA组比烫伤组显著降低(P<0.05);治疗组间相比,伤后6 h和12 h时间点烫伤+VPA组肺血管通透性显著低于烫伤+2M2P组(P<0.05),见表2。
2.2.4 PMEC凋亡率:烫伤组2 h和6 h PMEC凋亡率较假烫组显著升高;与烫伤组相比,烫伤+VPA组和烫伤+2M2P组2 h和6 h凋亡指数均显著降低;治疗组间相比,烫伤+VPA组各时间点均显著低于烫伤+2M2P组(P<0.05),见表2。
2.3 肺组织病理学变化 HE染色后镜下观察可见:假烫组大鼠肺组织结构清晰,未见肺水肿、间质水肿及炎症细胞的浸润。而烫伤组和烫伤+2M2P组大鼠伤后2 h肺组织可见部分肺泡壁增厚,毛细血管充血,少量肺泡腔内出血。伤后6 h及12 h,上述变化加重,肺泡壁明显增厚,毛细血管内皮肿胀,少数肺泡中充满嗜伊红液体,肺泡腔内多见出血,并伴有中性粒细胞和单核细胞浸润,支气管黏膜水肿、上皮坏死脱落,部分区域可见肺大泡形成。烫伤+VPA组大鼠伤后2 h肺组织结构尚清晰,个别区域毛细血管轻度充血,未见明显组织水肿及出血。伤后6~12 h可见肺泡壁轻度增厚,毛细血管充血较前明显,血管内皮细胞轻度肿胀,少数肺泡腔可见出血,部分肺泡腔闭塞,支气管黏膜轻度水肿,炎症细胞轻度浸润,黏膜纤毛少量脱失。见图1。
表2 4组大鼠50%TBSAⅢ度烫伤后观察指标的变化(±s)

表2 4组大鼠50%TBSAⅢ度烫伤后观察指标的变化(±s)
注:烫伤组水浴水温为80℃,假烫组水浴水温为37℃,烫伤+2M2P组烫伤后即刻皮下注射2-甲基-2-戊烯酸300 mg/kg,烫伤+VPA组烫伤后即刻皮下注射丙戊酸钠300 mg/kg。与假烫组同时间比较,aP<0.05;与烫伤组同时间比较,cP<0.05;与烫伤+2M2P组同时间比较,eP<0.05
组别 鼠数 红细胞压积(%)肺组织含水率(%)伊文斯蓝浓度(μg/g)肺微血管内皮细胞凋亡率(%)假烫组2 h 6 35.42 ±1.13 65.58 ±2.39 41.39 ±3.78 4.31 ±0.54 6 h 6 34.24 ±1.52 66.23 ±3.12 42.04 ±4.38 4.50 ±0.38 12 h 6 35.62 ±1.61 64.84 ±2.35 40.81 ±3.89 4.76 ±0.62烫伤组2 h 6 43.74 ±1.23a 72.15 ±2.41a 68.43 ±4.37a 19.44 ±2.25a 6 h 6 49.57 ±1.12a 79.38 ±2.46a 74.29 ±7.46a 21.76 ±2.86a 12 h0----烫伤+2M2P组2 h 6 40.32 ±1.14c 69.32 ±1.34c 51.73 ±3.24c 15.34 ±1.74c 6 h 6 45.72 ±1.37c 76.52 ±2.12c 67.52 ±4.79c 16.43 ±1.82c 12 h 6 43.26 ±1.73 72.39 ±2.57 64.92 ±3.57 18.46 ±2.02烫伤+VPA组2 h 6 38.26 ±1.46ce 68.26 ±2.26c 49.74 ±4.19c 12.03 ±1.33ce 6 h 6 42.53 ±1.26ce 73.16 ±1.86ce 58.40 ±3.19ce 13.72 ±1.95ce 12 h 6 40.24 ±1.21e 71.83 ±2.15 57.28 ±4.53e 15.13 ±1.62e

图1 4组大鼠50%TBSAⅢ度烫伤后肺组织病理学变化(HE×200)
2.4 肺组织 VEGF、ICAM-1、E-selectin表达VEGF、E-selectin和ICAM-1主要于血管内皮细胞受损后表达,E-selectin和ICAM-1是炎症反应时中性粒细胞黏附于血管内皮细胞并向血管外转移的主要配体。伤后2~6 h,烫伤+VPA组肺组织中上述因子的阳性率显著低于烫伤组(P<0.05),烫伤 +2M2P组与烫伤组相比无统计学意义(P>0.05)。治疗组间相比,伤后各时间点烫伤+VPA组均显著低于烫伤+2M2P组(P<0.05),见表3。
表3 4组大鼠50%TBSAⅢ度烫伤后肺组织相关因子表达阳性率的比较(±s)

表3 4组大鼠50%TBSAⅢ度烫伤后肺组织相关因子表达阳性率的比较(±s)
注:烫伤组水浴水温为80℃,假烫组水浴水温为37℃,烫伤+2M2P组烫伤后即刻皮下注射2-甲基-2-戊烯酸300 mg/kg,烫伤+VPA组烫伤后即刻皮下注射丙戊酸钠300 mg/kg。与假烫组同时间比较,aP<0.05;与烫伤组同时间比较,cP<0.05;与烫伤 +2M2P 组同时间比较,eP <0.05
组别 鼠数 血管内皮细胞生长因子E-选择素 细胞间黏附分子-1假烫组2 h 6 0.032 ±0.011 0.057 ±0.012 0.048 ±0.022 6 h 6 0.031 ±0.008 0.047 ±0.011 0.050 ±0.017 12 h 6 0.035 ±0.012 0.052 ±0.009 0.049 ±0.013烫伤组2 h 6 0.360 ±0.017a0.320 ±0.013a0.450 ±0.023a 6 h 6 0.390 ±0.018a0.370 ±0.014a0.470 ±0.019a 12 h0---烫伤+2M2P组2 h 6 0.340 ±0.016 0.330 ±0.015 0.420 ±0.025 6 h 6 0.370 ±0.020 0.350 ±0.021 0.460 ±0.026 12 h 6 0.340 ±0.015 0.350 ±0.017 0.440 ±0.017烫伤+VPA组2 h 6 0.220 ±0.015ce0.240 ±0.013ce0.300 ±0.018ce 6 h 6 0.270 ±0.013ce0.280 ±0.016ce0.340 ±0.021ce 12 h 6 0.260 ±0.017e0.270 ±0.020e0.330 ±0.025e
3 讨论
战争、大规模突发事故及自然灾害(如火灾、地震)时,往往短时间内成批出现休克伤员;但由于交通破坏、医疗资源匮乏,使得常规静脉补液等抗休克治疗难以实施,从而大大增加病死率。因此,无静脉液体复苏条件下休克救治技术的研究对于战场、事故及灾害等情况的现场早期救治具有重要意义。无静脉液体复苏条件时休克救治技术主要有口服液体复苏、抗休克裤、生命维持和细胞保护药物等。其中生命维持与细胞保护药物作为一种简便可行的治疗方案,具有广阔的应用前景,是国内外研究的热点。
多项研究表明,HDACI在失血、创伤及脓毒症等休克模型中具有抗休克和提高存活率的作用[8-11]。Gonzales等[12]研究发现:60% 血容量失血大鼠伤前及伤后即刻皮下注射VPA,致伤后12 h VPA组大鼠存活率为70%,而生理盐水对照组大鼠存活率则为0;VPA组大鼠生存时间是生理盐水对照组大鼠的5倍。胡森等[13]发现:在无静脉复苏条件下,VPA能有效地维持50%TBSAⅢ度烧伤休克犬的平均动脉压,保护脏器功能,并显著提高动物的24、48 h存活率;白慧颖等[14]研究则表明VPA可以改善烫伤休克大鼠心肌酶学指标,减轻其组织损伤。本研究证实了VPA显著改善烧伤休克主要靶器官之一的肺组织损伤,具有潜在应用价值。
在重度烧伤早期,由于血浆大量渗出到体外及第三间隙,血液浓缩,可表现为HCT上升;虽然此时红细胞受多种因素影响出现大量破坏,但总体上容量的下降表现更明显,因此HCT可间接反映烧伤休克时血容量降低程度。肺组织含水率是烧伤休克大鼠炎症组织水肿程度的直接体现。EB比色法直接体现了肺微血管通透性的变化。大鼠50%TBSAⅢ度烫伤后2~12 h血HCT持续升高原因即在于血容量丢失,血细胞大量浓缩。肺组织含水率增加,出现肺水肿、炎症细胞浸润等病理改变,表明重度烧伤后由于炎症介质的大量释放,损伤微血管内皮细胞,导致肺微血管通透性增加,血液从血管中转移到血管外,引起有效循环血量的降低;炎症细胞如中性粒细胞和巨噬细胞的活化和转移则直接损伤了肺泡组织的换气功能。烫伤后即刻给予300 mg/kg VPA皮下注射,血HCT和肺组织含水率显著低于烫伤组,肺水肿等病理改变也明显减轻。
组蛋白乙酰化是基因转录调控的关键环节[15],VPA作为一种HDACI,其对组蛋白乙酰化水平的调节可能是生物功能多样化的主要原因[16]。Fu等[17]研究表明:VPA主要作用于HDACⅠ类分子(HDAC1与HDAC3),影响细胞生存与凋亡相关基因的表达,从而发挥生命维持与细胞保护作用。2M2P分子结构与VPA类似,但对组蛋白乙酰化的抑制作用较弱。本实验通过对照药物2M2P与VPA,结果也表明VPA的作用机制与其对组蛋白乙酰化水平的调控相关。
在烧伤休克治疗中,我们认为VPA对脏器功能的保护作用可能与其对炎症因子表达的调控有关。研究表明,脂多糖(LPS)致小鼠脓毒症模型给予单次口服 HDACI SAHA 可以降低 TNF-α、IL-1β、IL-6及IFN-γ水平,并呈剂量依赖性[18]。重度烧伤后也易出现上述炎症因子的瀑布样释放,形成全身性炎症反应,是心、肝、肺等重要脏器损伤的病理生理基础。在肺组织中,这些炎症因子的具体作用表现为损伤PMEC,增加血管通透性,促进中性粒细胞和巨噬细胞的活化和血管外转移。在本实验中,VPA对重度烧伤后血管活性因子表达率的调控及肺组织病理学观察结果也充分证实了上述推论。
综上所述,本实验证实了VPA在重度烧伤休克动物模型中能抑制内皮细胞活化,减轻其损伤,改善血管通透性,从而保护肺脏功能;其作用可能与其对组蛋白乙酰化调控相关,但具体途径尚不清楚。进一步研究可针对明确其具体基因和信号途径调控机制入手,为HDACI在烧伤休克治疗的临床应用提供更明确的实验依据。
[1]胡森.无静脉输液条件时低血容量休克救治技术的研究[J].中国危重病急救医学,2010,22(6):323-325.
[2]赵平,郑瑞强,陈齐红,等.脉搏指示连续心排血量监测在感染性休克早期液体复苏中的应用[J].中国综合临床,2013,29(3):263-267.
[3]陈东,陈伟,殷晓煜,等.胰十二指肠切除术后并发症发生的相关因素分析[J].中华消化外科杂志,2012,11(4):331-334.
[4]李丽娟,陈炜,古旭云,等.血浆B型钠尿肽前体浓度的动态变化对脓毒性休克患者心肌抑制严重程度及预后的评估意义[J].中国综合临床,2012,28(12):1268-1272.
[5]赵登秋,周龙翔,汤建燕.265例胆道再次或多次手术的临床分析[J].中华消化外科杂志,2012,11(5):422-425.
[6]Gonzales E R,Chen H,Munuve R M,et al.Hepatoprotection and lethality rescue by histone deacetylase inhibitor valproic acid in fatal hemorrhagic shock[J].J Trauma,2008,65(3):554-565.
[7]Kim H J,Rowe M,Ren M,et al.Histone deacetylase inhibitors exhibit anti-inflammatory and neuroprotective effects in a rat permanent ischemic model of stroke:multiple mechanisms of action[J].J Pharmacol Exp Ther,2007,321(3):892-901.
[8]Xu W S,Parmigiani R B,Marks P A.Histone deacetylase inhibitors:molecular mechanisms of action[J].Oneogene,2007,26(37):5541-5552.
[9]Li Y,Liu B,Zhao H,et al.Protective effect of suberoylanilide hydroxamic acid againstLPS-induced septic shock in rodents[J].Shock,2009,32(5):517-523.
[10]Sailhamer E A,Li Y,Smith E J,et al.Hypoxic"second hit"in leukocytes from trauma patients:modulation of the immune response by histone deacetylase inhibition[J].Cytokine,2010,49(3):303-311.
[11]Alam H B,Shuja F,Butt M U,et al.Surviving blood loss without blood transfusion in a swine poly-trauma model[J].Surgery,2009,146(2):325-333.
[12]Gonzales E R,Chen H,Munuve R M,et al.Valproic acid prevents hemorrhage associated lethality and affects the acetylation pattern of cardiac histones[J].Shock,2006,25(4):395-401.
[13]胡森,侯经元,李琳,等.丙戊酸钠对致死性休克犬脏器功能和病死率的影响[J].中国应用生理学杂志,2009,25(3):27.
[14]白慧颖,周国勇,张立俭,等.丙戊酸钠对重度烫伤大鼠心肌保护作用及其机制研究[J].中国临床药理学杂志,2011,27(2):130-132.
[15]Mahlknecht U,Hoelzer D.Histone acetylation modifiers in the pathogensis of malignant disease[J].Mol Med,2000,6(8):623-644.
[16]Alam H B,Stegalkina S,Rhee P,et al.cDNA array analysis of gene expression following hemorrhagic shock and resuscitation in rats[J].Resuscitation,2002,54(2):195-206.
[17]Fu Q,Mc Knight R A,Yu X,et al.Uteroplacental insufficiency induces site-specific changes in histone H3 covalent modifications and affect DNA-histone H3 positioning in day 0 IUGR rat liver[J].Physiol Genomics,2004,20(1):108-116.
[18]Leoni F,Zaliani A,Bertolini G,et al.The antitumor histonedeacetylase inhibitorssuberoylanilide hydroxamic acid exhibits anti-inflammatory properties via suppression of cytokines[J].Proc Natl Acad Sci USA,2002,99(5):2995-3000.
