枇杷花醇提物止咳化痰作用实验研究
2013-09-14陈晓芳吴文倩刘春宇
陈晓芳, 张 倩, 吴文倩, 刘春宇
(苏州大学医学部药学院,江苏苏州215123)
枇杷Eriobotrya japonica(Thunb.)Lindl为蔷薇科植物,药用历史悠久,具有化痰止咳、和胃降气之功效,作为传统中药,枇杷的研究集中于叶和果实,对枇杷花的相关研究相对较少,枇杷花气味香醇独特,性温,可入肺散寒,化痰止咳,润肺下气[1-2]。目前,虽有枇杷花止咳方面的药效研究,但对其作用机制及药效物质基础的研究未见报道。另外,枇杷树在花期进行疏花以提高枇杷品质,而疏掉的花蕾大多没有充分利用。为了进一步开发利用枇杷花的资源,课题组对枇杷花的止咳化痰药理作用及药效物质基础进行了系统研究,本实验采用多种动物模型观察了枇杷花醇提物的止咳化痰作用,并初步探讨了其作用机制。
1 仪器与材料
1.1 仪器 电子天平 (EL303梅特勒-托力多仪器);超声雾化器WH-802型(广东粤华医疗器械厂);小鼠/豚鼠玻璃容器(自制);RE-52A旋转蒸发仪(上海亚荣生化仪器厂);DZF-6050真空干燥箱(上海精宏实验设备有限公司)。
1.2 实验动物 昆明种小鼠,雌雄各半,体质量18~22 g;豚鼠,雌雄兼用,体质量150~190 g,均由苏州大学医学部实验动物中心提供。实验动物生产许可证SCXK(苏)2007—0007,实验动物使用许可证SYXK(苏)2007—0035。
1.3 材料
枇杷花:采于苏州东山,经本院生药教研室刘春宇教授鉴定为枇杷Eriobotrya japonica(Thunb.)Lindl的花,干燥后备用。
枇杷花醇提物:取枇杷花粉末1000 g,加10倍量95%乙醇,60℃,回流提取2.5 h,过滤,重复2次,合并滤液,浓缩得浸膏,给药剂量以相当于原药材质量计算。豚鼠灌胃剂量:枇杷花醇提物高剂量组 (3 g/kg),枇杷花醇提物中剂量组 (1.5 g/kg),枇杷花醇提物低剂量组 (0.75 g/kg);小鼠灌胃剂量:枇杷花醇提物高剂量组 (4 g/kg),枇杷花醇提物中剂量组 (2 g/kg),枇杷花醇提物低剂量组(1 g/kg)。
念慈庵蜜炼川贝枇杷膏 (香港京都念慈总厂有限公司,批号:Y3808010);P物质试剂盒(R&D分装);其他试剂均为分析纯。
2 方法
2.1 对氨水引咳小鼠的影响 采用小鼠氨水引咳法[4],预实验用氨水引咳法筛选一批体质量18~22 g的昆明小鼠,3 min内不发生咳嗽的小鼠不予选用,待小鼠稳定2 d后,取合格小鼠50只,雌雄各半,按体质量随机分为5组,对照组 (生理盐水)、念慈庵蜜炼川贝枇杷膏组 (5.4 g/kg)、枇杷花醇提物高剂量组、中剂量组、低剂量组,连续给药7 d,小鼠每次灌胃0.2 mL/10 g溶液,末次给药前禁食不禁水12 h,于末次给药1 h后,将小鼠置于自制密闭玻璃容器中,超声雾化器喷入氨水20 s后,立即取出小鼠,记录小鼠咳嗽潜伏时间和3 min内咳嗽次数。
2.2 对枸橼酸引咳[3]豚鼠的影响 预实验,将豚鼠放入自制密闭玻璃容器内,待其在容器内稳定1 min后,用超声波雾化吸入器匀速将17.5 g/L的枸橼酸喷入容器内,喷雾时间为40 s,以豚鼠出现第一声响亮的咳嗽声为准,开始记录豚鼠咳嗽潜伏期及5 min内咳嗽次数,咳嗽次数<10次和>30次者不予选用。
次日将挑选筛选合格的豚鼠35只随机分5组,每组7只,分为枇杷花醇提物高剂量组、中剂量组、低剂量组,对照组 (生理盐水)、念慈庵蜜炼川贝枇杷膏阳性药物组(10 g/kg),各组灌胃给药,对照组给予生理盐水,每天1次,连续7 d,于末次给药前禁食不禁水12 h,末次给药后1 h按预实验方法重复引咳实验,记录豚鼠咳嗽潜伏期及5 min内豚鼠咳嗽次数。
2.3 对小鼠酚红排泌[5]的影响 取昆明种小鼠50只,雌雄各半,分为枇杷花醇提物高剂量组、中剂量组、低剂量组,对照组 (生理盐水)、念慈庵蜜炼川贝枇杷膏组 (5.4 g/kg),每组10只,各组按上述剂量灌胃给药,每天1次,连续7 d,模型组则灌胃等体积生理盐水0.1 mL/10 g,末次给药前,禁食不禁水12 h,末次给药30 min后,给小鼠腹腔注射0.5%苯酚红溶液,剂量为每只0.5 mL,注射1 h后断颈处死小鼠,沿甲状软骨剪下一段气管,每只小鼠剪下的气管要求等长,放入离心管中,加入3 mL生理盐水和1 mol/L的氢氧化钠溶液0.2 m L,离心 (转速2 000 r/min,时间5 min),取上清液,于紫外可见分光光度计546 nm波长处测量并记录吸光值。
2.4 对辣椒素刺激豚鼠C-纤维释放P物质的影响 取35只豚鼠,随机分为正常组、模型组、枇杷花醇提物高剂量组、中剂量组、低剂量组,每组7只。实验前禁食不禁水12 h,模型组按0.4mL/100 g灌胃生理盐水,灌胃1 h后将豚鼠放入特制的4 000 mL烧杯中,用超声波雾化器以最大量雾化30μmol/L辣椒素,喷雾2 min,制备辣椒素致豚鼠咳嗽模型,正常组灌胃生理盐水后不进行喷雾。喷雾2 min后,立即取出豚鼠,深度麻醉豚鼠 (水合氯醛,0.1 m L/100 g,腹腔注射),完整取下气管心肺组织,用注射器套管注射5 mL冰冷的生理盐水于气管,共灌洗3次,收集支气管肺泡灌洗液 (BALF),3 500 r/min离心10 min,收集上清液,冻干,用1 mLPBS缓冲液重溶[6],采用酶联免疫吸附法测定P物质。
2.5 统计学处理 采用SPSS 17.0统计软件对数据处理,实验结果以± s表示,采用单因素方差分析,P<0.05认为有统计学差异。
3 结果
3.1 对氨水引咳小鼠咳嗽的抑制作用 枇杷花醇提物对氨水引起小鼠咳嗽潜伏期及咳嗽次数的影响,结果见表1,念慈庵密炼川贝枇杷膏阳性药物组、枇杷花醇提物高剂量组、中剂量组、低剂量组均有延长小鼠咳嗽潜伏期和减少小鼠咳嗽次数的作用,与模型对照组比较有显著差异(P<0.01),实验结果提示,枇杷花醇提物对氨水引起小鼠咳嗽有良好的抑制作用。
表1 对小鼠氨水引咳法的咳嗽次数和咳嗽潜伏期的影响( ± s,n=10)
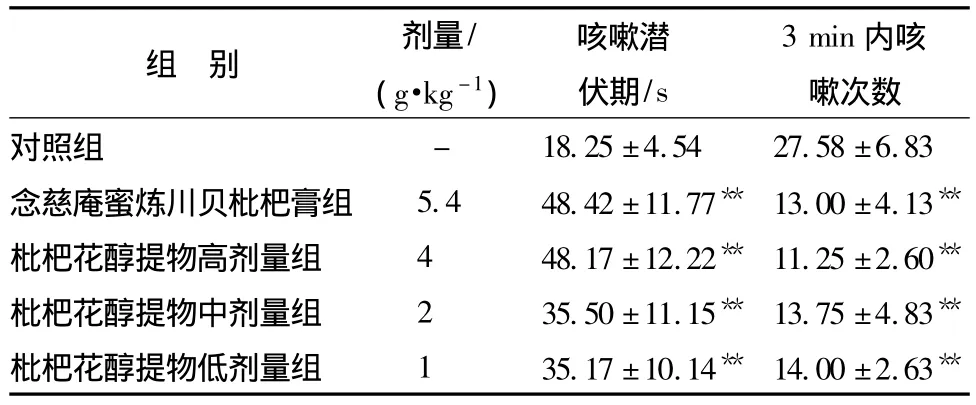
表1 对小鼠氨水引咳法的咳嗽次数和咳嗽潜伏期的影响( ± s,n=10)
注:与对照组比较,*P<0.05,**P<0.01。
组 别 剂量/(g·kg-1)咳嗽潜伏期/s 3min内咳嗽次数对照组 - 18.25 ±4.54 27.58 ±6.83念慈庵蜜炼川贝枇杷膏组 5.4 48.42 ±11.77** 13.00 ±4.13**枇杷花醇提物高剂量组 4 48.17 ±12.22** 11.25 ±2.60**枇杷花醇提物中剂量组 2 35.50 ±11.15** 13.75 ±4.83**枇杷花醇提物低剂量组 1 35.17 ±10.14** 14.00 ±2.63**
3.2 对枸橼酸引咳豚鼠咳嗽的抑制作用 如表2所示,与对照组相比,念慈庵蜜炼川贝枇杷膏阳性药物组、枇杷花醇提物高剂量组,中剂量组,低剂量组豚鼠咳嗽次数和咳嗽潜伏期均有显著差异性 (P<0.05),枇杷花醇提物明显抑制枸橼酸引起的豚鼠咳嗽,具有显著的止咳作用。
表2 对豚鼠枸橼酸引咳法的咳嗽次数考察( ± s,n=7)
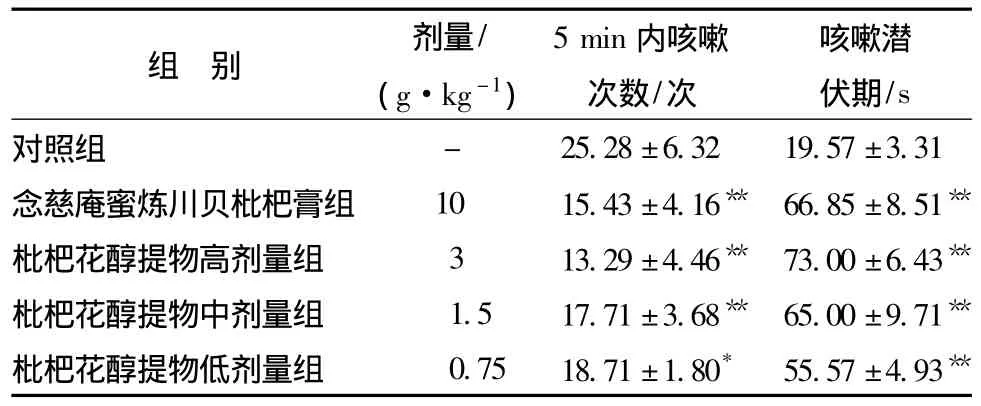
表2 对豚鼠枸橼酸引咳法的咳嗽次数考察( ± s,n=7)
注:与对照组比较,*P<0.05,**P<0.01。
组 别 剂量/(g·kg-1)5min内咳嗽次数/次咳嗽潜伏期/s对照组 - 25.28±6.32 19.57±3.31念慈庵蜜炼川贝枇杷膏组 10 15.43±4.16** 66.85±8.51**枇杷花醇提物高剂量组 3 13.29±4.46** 73.00±6.43**枇杷花醇提物中剂量组 1.5 17.71±3.68** 65.00±9.71**枇杷花醇提物低剂量组 0.75 18.71±1.80* 55.57±4.93**
3.3 对小鼠酚红排泌的影响 见表3。与对照组相比,念慈庵蜜炼川贝枇杷膏阳性药物组和枇杷花醇提物高剂量组、中剂量组、低剂量组小鼠气管酚红排泌量均显著增加(P<0.05),提示枇杷花醇提物具有一定的祛痰作用。
表3 对小鼠酚红排泌的影响( ± s,n=10)
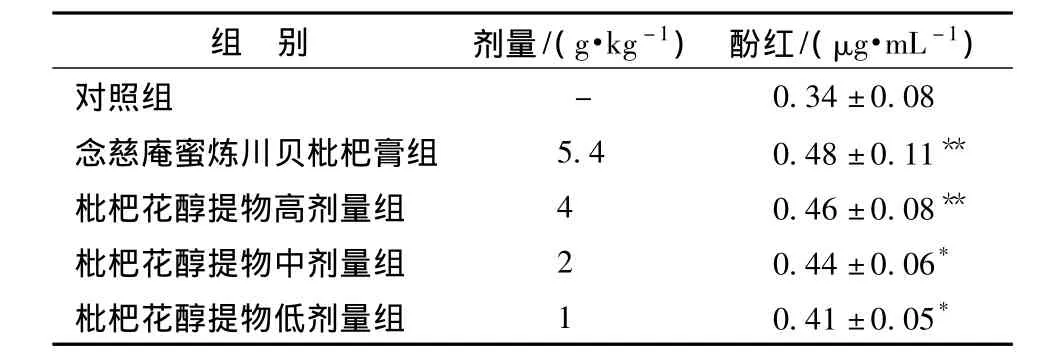
表3 对小鼠酚红排泌的影响( ± s,n=10)
注:与对照组比较,*P<0.05,**P<0.01。
组 别 剂量/(g·kg-1) 酚红/(μg·mL-1)对照组 -0.34±0.08念慈庵蜜炼川贝枇杷膏组 5.4 0.48±0.11**枇杷花醇提物高剂量组 4 0.46±0.08**枇杷花醇提物中剂量组 2 0.44±0.06*枇杷花醇提物低剂量组 1 0.41±0.05*
3.4 对辣椒素刺激豚鼠C-纤维释放P物质的影响 咳嗽的产生与C-纤维受体接受刺激有关,C-纤维受体主要对化学刺激敏感,如辣椒素、枸橼酸等。用小剂量的辣椒素可以使豚鼠气管内C-纤维P物质释放。表4结果显示,模型组P物质量与正常组相比,具有显著性差异 (P<0.01),证明实验造模成功,辣椒素能显著增加气管P物质释放;枇杷花醇提物高剂量组和中剂量组与模型组相比能显著减少P物质生成 (P<0.01),提示,枇杷花醇提物对辣椒素致咳豚鼠气管内C-纤维P物质释放有一定抑制作用。
表4 对豚鼠肺气管灌洗液P物质量影响( ± s,n=7)
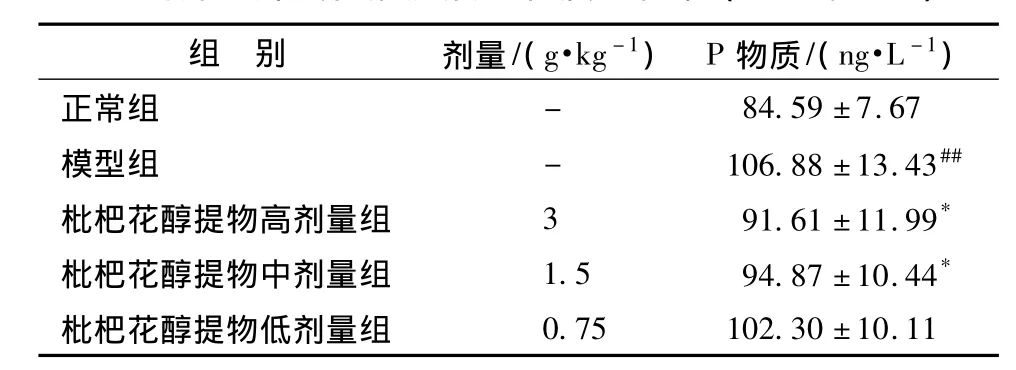
表4 对豚鼠肺气管灌洗液P物质量影响( ± s,n=7)
注:与正常组比较,*P<0.05;与模型组比较,##P<0.01。
组 别 剂量/(g·kg-1) P 物质/(ng·L-1)正常组 -84.59 ±7.67模型组 - 106.88±13.43##枇杷花醇提物高剂量组 3 91.61±11.99*枇杷花醇提物中剂量组 1.5 94.87±10.44*枇杷花醇提物低剂量组0.75 102.30 ±10.11
4 讨论
在研究药物镇咳作用时,多采用机械、化学和电刺激等方法刺激动物的神经和感受器,引发咳嗽。本实验采用化学刺激法,用氨水和枸橼酸雾化吸入,刺激副交感神经系统,引发咳嗽,结果证明枇杷花醇提物有明显的镇咳作用,各剂量组对小鼠氨水和豚鼠枸橼酸引发的咳嗽均具有明显的拮抗作用,枇杷花醇提物能有效抑制小鼠和豚鼠的咳嗽次数和延长咳嗽潜伏期,表明其有良好的止咳作用。P物质是引起咳嗽不良反应发生的重要物质[6-7],研究发现血管紧张素Ⅰ转化酶(ACE)参与P物质等炎症介质的分解,当抑制血管紧张素Ⅰ转化酶时,气道中炎症介质积聚,引发咳嗽[8-10]。本实验采用辣椒素刺激气道模型,观察枇杷花醇提物对C-纤维释放P物质的影响,探讨枇杷花醇提物的止咳机制,实验结果表明,枇杷花醇提物对C纤维-P物质释放有一定的抑制作用,抑制P物质的释放可能为枇杷花醇提物止咳作用的机制之一。
痰液是引起咳嗽的一个重要因素,气管、支气管和肺泡的上皮杯状细胞、黏膜下腺体分泌呼吸道分泌液,润滑气道膜、保护上皮纤毛的正常生理运动,当呼吸道受炎症因子侵入时,纤毛运动减慢,黏膜上皮破损,黏蛋白分泌异常,最终导致黏液分泌增加,积累的黏液变成痰状物质,刺激呼吸道黏膜引起咳嗽,因此,稀释痰液,改善呼吸道分泌物的增加,可以发挥祛痰作用[8]。本实验采用气管酚红排泌法观察枇杷花醇提物的祛痰作用,实验结果表明,枇杷花醇提物灌胃给药7d后,能显著增加小鼠气管酚红排泌量(P<0.05),具有明显的祛痰作用,并提示,枇杷花醇提物通过增加呼吸道液的分泌能力,加快气管纤毛运动速度,利于呼吸道分泌物咳出,达到促进痰液的排出,减轻痰液对气管的刺激。
[1]张 玉,王建清.枇杷的营养及功能成分研究进展[J].食品科学,2005,26(9):602-604.
[2]邓晶晶,卢先明,蒋桂华,等.枇杷花镇咳祛痰和抗炎的药效学研究[J].时珍国医国药,2006,17(12):2469-2470.
[3]徐叔云,卞如濂,陈 修.药理实验方法学[M].3版.北京:人民卫生出版社,2002:1363-1364.
[4]王静波,杨必坤,张 宏,等.枇杷花提取物止咳作用研究[J].中草药,2009,40(7):1107.
[5]徐淑云.中华临床药物学[M].北京;人民卫生出版社,2003:357-9.
[6]Shigematsu S,Ishida S,Gute D C,et al.Bradykinin-induced proinflammatory signalingmechanisms[J].Am JPhysiol Heart Circ Physiol,2002,283(6):676-86.
[7]Dicpinigaitis P V.Angiotensin-converting enzyme inhibitor-induced cough:ACCP evidence-based clinical practice guidelines[J].Chest,2006,129(1):169-73.
[8]秦 岭,胡成平.支气管上皮细胞在呼吸道免疫紊乱中的作用[J].国际病理科学与临床杂志,2010,30(14):304.
[9]叶阮健,何权瀛.血管紧张素转换酶抑制剂所致咳嗽机制研究结果的回顾分析[J].中日友好医院学报,2003,17(2):96-97.
[10]唐晓鸿,袁 洪,李丽军,等.血管紧张素转化酶基因IPD多态性与卡托普利[J].中国动脉硬化杂志,2008,16(5):377.