退黄丸的质量标准研究
2013-09-14于红艳许成刚崔永霞
于红艳, 许成刚, 崔永霞
(1.河南省中医院,河南郑州450002;2.河南中医学院,河南郑州450008)
退黄丸是由绵茵陈、栀子、葛根、大黄、赤芍、秦皮等多味中药粉碎成细粉,过筛,混匀,用水泛丸,干燥制得。具有清热利湿,化瘀通腑,利胆退黄之功效。用于治疗急慢性肝炎,肝硬化,重症肝炎属湿热证者。本方为医院制剂,应用于临床已久,疗效显著,为进一步控制该产品的质量,采用HPLC法对其君药绵茵陈的有效成分绿原酸、栀子有效成分栀子苷、葛根有效成分葛根素、赤芍有效成分芍药苷、大黄有效成分大黄酸及其秦皮有效成分秦皮甲素和秦皮乙素都进行定量测定[1],方法快速、准确、简便。并建立了大黄中大黄酸、葛根中葛根素、赤芍中芍药苷、秦皮中秦皮甲素和秦皮乙素[2-7]的薄层色谱[7]鉴别,结果满意,可用于该制剂的质量控制。
1 样品、仪器与试药
1.1 样品来源 退黄丸 (河南中医学院第二附属医院,批号20100309、20100310、20100311),粉碎成细粉。
1.2 仪器与试剂 戴安高效液相色谱仪;Agilent C18色谱柱 (250mm×4.6mm,5μm)柱;十万分之一电子天平 (AE240);色谱级甲醇、乙腈 (天津市四友精细化学品有限公司);双蒸水自制;其他试剂均为分析纯。绿原酸 (批号 110753-200212);栀子苷 (批号110749-200714);葛根素(批号 110752-200511);大黄酸 (批号 0757-200206);芍药苷 (批号110736-201035);秦皮甲素 (批号0757-200206);秦皮乙素 (批号110752-200511);大黄对照药材 (批号902-8903);赤芍对照药材 (批号121093-200405);秦皮对照药材(批号 908-8904);葛根对照药材 (批号20100506),以上药材均来自中国药品生物制品检定所。
2 定性鉴别
2.1 大黄的鉴别 取退黄丸粉末1.7 g,加入甲醇20 mL,微波超声20 min,过滤,挥干滤液,残渣加水5mL溶解,加盐酸0.5 mL,恒温水浴加热30 min,冰水冷却,乙醚液萃取2次,每次用量10 mL,蒸干合并的乙醚液,残渣用三氯甲烷1 mL溶解,作为供试品溶液。另取大黄对照药材0.1 g和缺少大黄的阴性对照粉末1.6 g,同种方法制成大黄对照药材溶液及缺大黄的阴性对照溶液,再取大黄酸对照品,甲醇溶解制成1 mg/mL的大黄酸对照溶液。照薄层色谱法试验,吸取4种上述溶液各3μL,分别点于同一硅胶GF254薄层板上,配制甲酸-甲酸乙酯-石油 (60~90℃)(1∶5∶15),取上层液为展开剂展开,取出,晾干,置密闭容器中氨蒸气熏,观察斑点。退黄丸溶液色谱中,在与对照品及对照药材色谱相应位置上,有相同斑点,而阴性色谱对照位置中无此斑点。见图1。

图1 大黄的TLC鉴别图Fig.1 TLC chromatogram of Rhei Radix et Rhizoma
2.2 葛根鉴别 取退黄丸16.5 g研细,加20 mL甲醇,静置2 h后滤过,滤液恒温水浴蒸干,加甲醇1 mL使残渣溶解,作为供试品溶液。另取葛根药材0.8 g及缺葛根的阴性对照药材粉末15.7 g,同一制备方法制成对照药材溶液及阴性对照溶液。再取葛根素对照品,加甲醇溶解,制成1 mg/mL的溶液,作为对照品溶液。照薄层色谱法试验,取上述4种溶液各2μL,分别点于同一硅胶GF254薄层板上,用甲醇-三氯甲烷-水 (2∶7∶0.5)展开,取出,晾干,放置紫外光灯 (365 nm)下观察斑点。供试品色谱中,在与对照品及对照药材色谱相应的位置上,有相同颜色的斑点,而阴性色谱对照位置中无此斑点。见图2。
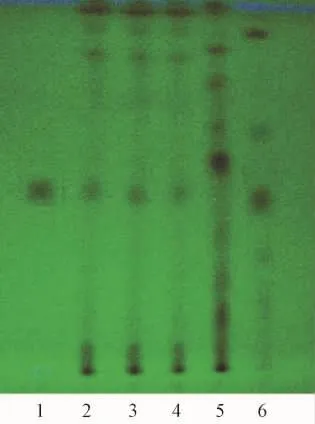
图2 葛根的TLC鉴别图Fig.2 TLC chromatogram of Puerariae lobatae Radix
2.3 秦皮的鉴别 取退黄丸粉末17 g,置圆底烧瓶中,加分析甲醇30 mL,回流提取10 min,放冷,滤过,浓缩至2 mL作为供试品。另取秦皮对照药材1 g和缺秦皮的阴性对照药材粉末16 g,同种方法制成对照药材溶液及阴性对照溶液,再取秦皮甲素及秦皮乙素对照品,加甲醇制成每2 mg/mL的混合溶液,作为对照品溶液。照薄层色谱法试验,吸取上述溶液各4μL,分别点于同一硅胶GF254薄层板上,用三氯甲烷-甲酸-甲醇 (6∶0.5∶1)展开,取出,晾干,紫外光灯 (254 nm)观察斑点,在与对照药材色谱和对照品色谱相应的位置上,供试品色谱有相同颜色的斑点。而阴性色谱在此对照位置无斑点。见图3。
2.4 赤芍的鉴别 取赤芍药材粉末2.6 g,酒精10 mL振摇提取5 min,过滤后蒸干,加2 mL酒精溶解残渣,为供试品溶液。另取赤芍对照药材0.4 g和缺赤芍的阴性对照药材粉末2.2 g,同一方法制备赤芍对照药材溶液及缺赤芍阴性对照溶液,芍药苷对照品加酒精溶解成2 mg/mL的对照品溶液。按照薄层色谱法试验,吸取4种制备溶液各3μL,点于硅胶G薄层板上,以三氯甲烷-甲酸-甲醇-乙酸乙酯 (40∶0.2∶10∶5)为展开剂,展开,以5%香草醛硫酸溶液为显色剂,加热至斑点显色清晰,与对照药材色谱和标准对照品色谱对比,相同位置有相同颜色的斑点。但是阴性色谱对照液在此位置则没有相同颜色的此斑点。见图4。

图3 秦皮的TLC鉴别图Fig.3 TLC chromatogram of Fraxini Cortex
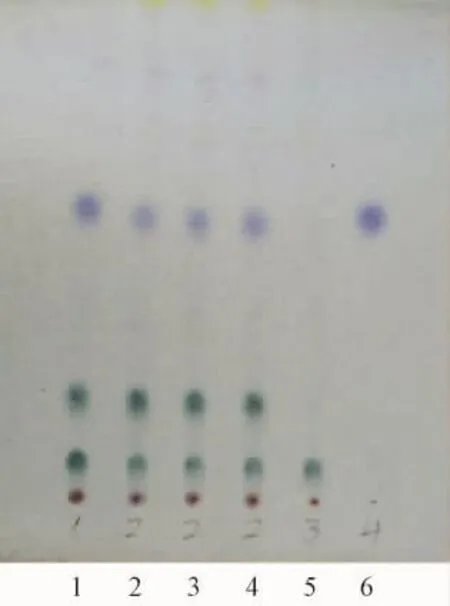
图4 赤芍的TLC鉴别图Fig.4 TLC chromatogram of Paeoniae Radix rubra
3 定量测定
3.1 色谱条件及系统适用性试验 色谱柱均为Agilent C18色谱柱 (250 mm×4.6 mm,5μm);柱温均为30℃;体积流量均为1 mL/min。
绿原酸和栀子苷:流动相B为甲醇,流动相A为0.05%磷酸水溶液作为流动相,梯度洗脱,在0~15min,B相保持17%不变,15~30min,B相从17%线性改变至25%,30~45 min,B相从25%线性改变至17%,45~55min,B相保持17%10 min;检测波长为245 nm;理论板数按绿原酸峰及其栀子苷峰计算不低于3 000。
葛根素:流动相为甲醇-水 (25∶75);检测波长为250 nm;理论板数按葛根素峰计算不低于4 000。
芍药苷:流动相B为甲醇,流动相A为0.05 mol/L磷酸二氢钾水溶液作为流动相,梯度洗脱,在0~10 min,B相从比例25%改变至30%,10~20 min,B相从比例30%改变至38%;检测波长为230 nm;理论板数按芍药苷峰计算不低于3 000。
大黄酸:流动相为甲醇-0.1%磷酸水 (85∶15);检测波长为254 nm;理论板数按葛根素峰计算不低于3 000。
秦皮甲素和秦皮乙素:流动相B为乙腈,流动相A为0.1%磷酸水为流动相,梯度洗脱,在0~30 min,B相从比例5%改变至30%,30~35 min,B相保持30%不变;检测波长为334 nm;理论板数按秦皮乙素峰计算不低于5 000。
3.2 对照品溶液的制备 分别取绿原酸、栀子苷、葛根素、芍药苷、大黄酸、秦皮甲素和秦皮乙素对照品各适量,精密称定,加甲醇制成1 mL含绿原酸、栀子苷、葛根素、芍药苷、大黄酸、秦皮甲素和秦皮乙素分别为126μg、131.6μg、50μg、53.4 μg、17.2μg、24.8μg、42.0μg的溶液,即得。
3.3 供试品溶液的制备
绿原酸及栀子苷:取退黄丸药材研细,精密称定5.0 g,置具塞锥形瓶中,精密量取100 mL 50%甲醇,密塞,称量,超声处理30 min(功率250W,频率60 Hz),放冷,再称定,用50%甲醇补足减失的质量,摇匀,滤过,取续滤液作为供试品溶液。
葛根素:取退黄丸药材研细,精密称定2.0 g,置具塞锥形瓶中,精密量取30%乙醇50 mL,称定质量,加热回流30 min,放冷,在称定质量,用30%乙醇补足减失的质量,摇匀,滤过,取续滤液作为供试品溶液。
芍药苷:取退黄丸药材研细,精密称定2.5 g,置具塞锥形瓶中,精密加入甲醇25 mL,称定质量,浸泡4 h,超声处理20 min(功率250 W,频率60 Hz),放冷,再称定,用甲醇补足减失的质量,摇匀,滤过,取续滤液作为供试品溶液。
大黄酸:取退黄丸药材研细,精密称定2.5 g,置具塞锥形瓶中,精密加入甲醇50 mL,称定质量,超声处理30 min(功率250 W,频率60 Hz),放冷,再称定,用甲醇补足减失的质量,摇匀,滤过,取续滤液作为供试品溶液。
秦皮甲素及秦皮乙素:取退黄丸药材研细,精密称定8.0 g,置具塞锥形瓶中,精密加入甲醇50 mL,密塞,称定质量,加热回流1 h,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液作为供试品溶液。
3.4 方法学考察
3.4.1 线性关系的考察 精密量取3.2项制备项下绿原酸及栀子苷混合对照品溶液2、4、6、8、10 mL,50%甲醇定容至10 mL;按色谱条件测定;以峰积分面积 (Y)为纵坐标,样品质量浓度(X)为横坐标,绘制标准曲线,回归方程为绿原酸Y=0.264 8X-2.923 7(r=0.999 95);栀子苷Y=0.300 1X-3.402 3(r=0.999 95),结果表明绿原酸在0.025 2~0.126 mg/mL,栀子苷在0.026 32~0.131 6 mg/mL范围内线性关系良好。
精密量取3.2项制备项下葛根素、芍药苷、大黄酸对照品溶液2、4、6、8、10 mL,甲醇定容至10 mL;按色谱条件测定;以峰积分面积 (Y)为纵坐标,样品质量浓度 (X)为横坐标,绘制标准曲线,回归方程为葛根素 Y=45.864X-13.658(r=1.000 0);芍药苷Y=136.19X-98.654(r=0.999 7);大黄酸 Y=48.633X-19.322(r=1.000 0)结果表明葛根素在0.010 00~0.050 00 mg/mL、芍药苷在0.010 68~0.053 40 mg/mL、大黄酸在0.003 44~0.017 20mg/mL范围内线性关系良好。
精密量取3.2项制备项下秦皮甲素和秦皮乙素混合对照品溶液1、2、4、8、10 mL甲醇定容至10 mL,按色谱条件测定;以峰积分面积 (Y)为纵坐标,样品质量浓度 (X)为横坐标,绘制标准曲线,回归方程为秦皮甲素Y=66.966X-124.45(r=1.0);秦皮乙素Y=87.981X-141.33(r=0.999 7);结果表明秦皮甲素在0.002 48~0.024 8 mg/mL、秦皮乙素在0.004 2~0.042 0 mg/mL范围内线性关系良好。
3.4.2 精密度试验 精密吸取上述同一对照品溶液8μL,重复进样6次,记录所得峰面积,绿原酸、栀子苷、葛根素、芍药苷、大黄酸、秦皮甲素和秦皮乙素 RSD值分别为0.20%、0.16%、0.33%、0.14%、0.51%、0.47%和 0.29%,表明该仪器精密度良好。
3.4.3 稳定性试验 分别精密吸取不同制备方法的供试品溶液10μL,分别在0、4、8、12、16h测定绿原酸和栀子苷、葛根素、芍药苷、大黄酸、秦皮甲素和秦皮乙素峰面积,RSD值分别为1.31%、 1.58%、 1.03%、 1.77%、 1.19%、0.98%、1.67%,表明7种成分12 h稳定。
3.4.4 重复性试验 精密称取同一批号供试品样品适量共6份,按3.3项下的方法制备供试品溶液,平行进行测定,每次进样10μL,记录绿原酸和栀子苷、葛根素、芍药苷、大黄酸、秦皮甲素和秦皮乙素的峰面积,RSD值分别为1.26%、1.39%、 2.06%、 1.97%、 1.76%、 2.22%、1.53%,表明该方法的重复性良好。
3.4.5 加样回收率试验
绵茵陈及栀子:取已知绿原酸和栀子苷量的制剂样品 (批号20100310)6份,每份约2.5 g,精密称定,精密加入一定质量浓度的混合对照溶液,用上述制备供试品方法制备,作为加样回收供试品溶液。
葛根:取已知葛根素量的制剂样品 (批号20100310)6份,每份约1.0 g,精密称定,精密加入一定质量浓度的葛根素对照溶液,用上述制备供试品方法制备,作为加样回收供试品溶液。
赤芍:取已知芍药苷量的制剂样品 (批号20100310)6份,每份约1.25 g,精密称定,精密加入一定质量浓度的芍药苷对照溶液,用上述制备供试品方法制备,作为加样回收供试品溶液。
大黄酸:取已知大黄酸量的制剂样品 (批号20100310)6份,每份约1.25 g,精密称定,精密加入一定质量浓度的大黄酸对照溶液,用上述制备供试品方法制备,作为加样回收供试品溶液。
秦皮:取已知秦皮甲素和秦皮乙素量的制剂样品 (批号20100310)6份,每份约4.0 g,精密称定,精密加入一定质量浓度的混合对照溶液,用上述制备供试品方法制备,作为加样回收供试品溶液。
将上述配制的供试品溶液每次精密进样10 μL,进行测定,绿原酸、栀子苷、葛根素、芍药苷、大黄酸、秦皮甲素和秦皮乙素的平均回收率分别 为 98.80%、99.38%、99.12%、98.70%、98.72%、100.71%、98.85%;RSD 分 别 为1.18%、 0.95%、 1.56%、 2.11%、 1.65%、0.65%、2.01%(n=6),见表1~3。
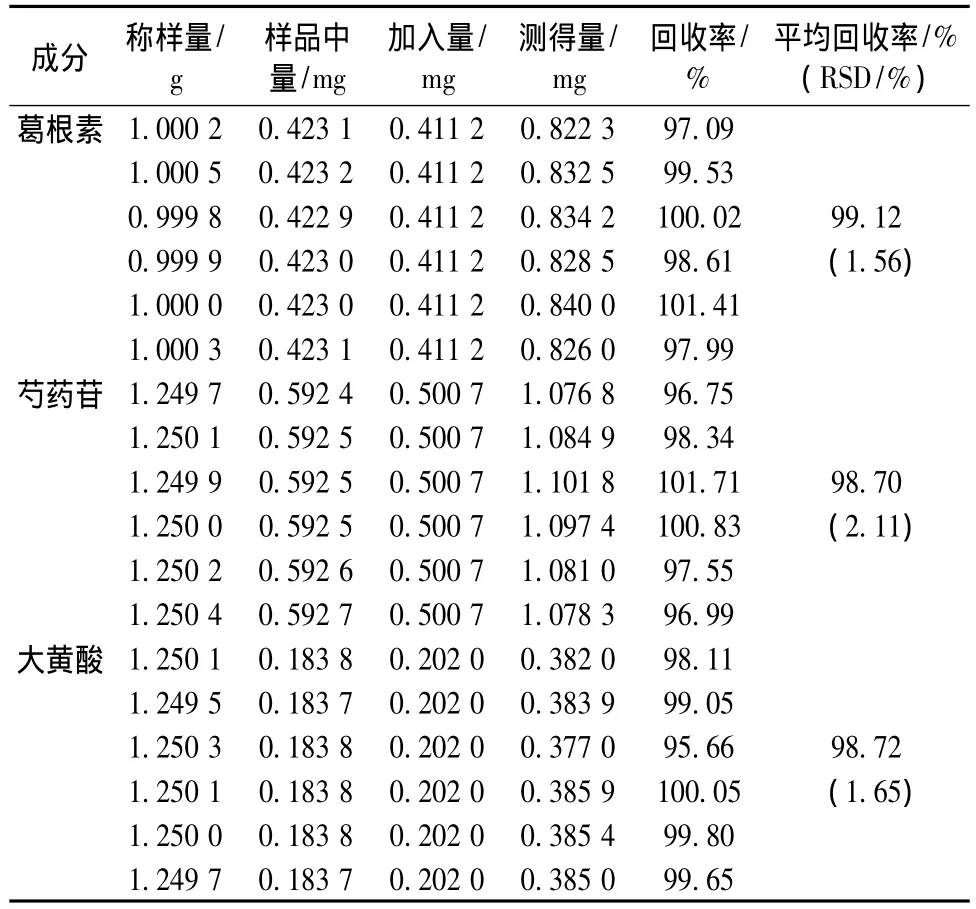
表2 葛根素、芍药苷和大黄酸的回收率试验结果(n=6)Tab.2 Results for recovery tests of puerarin,paeoniflorin and rhein(n=6)
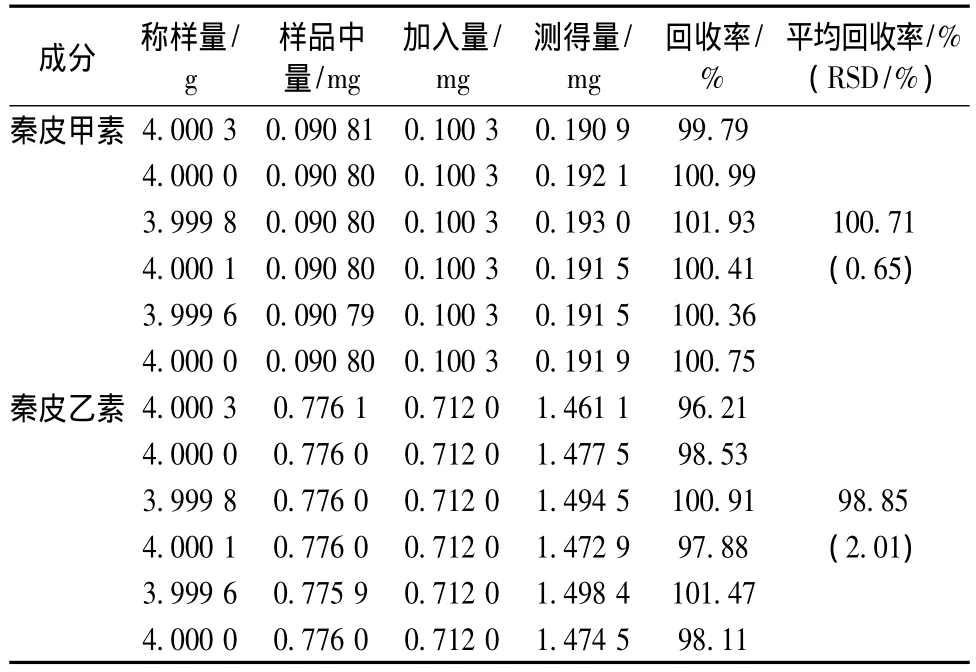
表3 秦皮甲素、秦皮乙素的回收率试验结果(n=6)Tab.3 Results for recovery tests of aesculin and aesculetin(n=6)
3.4.6 专属性试验 按处方配比,去除测定含有量药材后的其他药材,按退黄丸制法项下的工艺制成丸剂,再按供试品溶液的制备方法制得几种阴性供试品溶液。精密吸取阴性供试品溶液10μL,测定,阴性供试品在相应的保留时间无色谱峰干扰。
3.4.6 样品测定 称取成方制剂各3份 (20100309、20100310、20100311),每份一定量,精密称定,制成供试品溶液,利用外标两点法测定,计算绿原酸、栀子苷、葛根素、芍药苷、大黄酸、秦皮甲素和秦皮乙素的质量分数,测定结果见表4~6和图5~9。
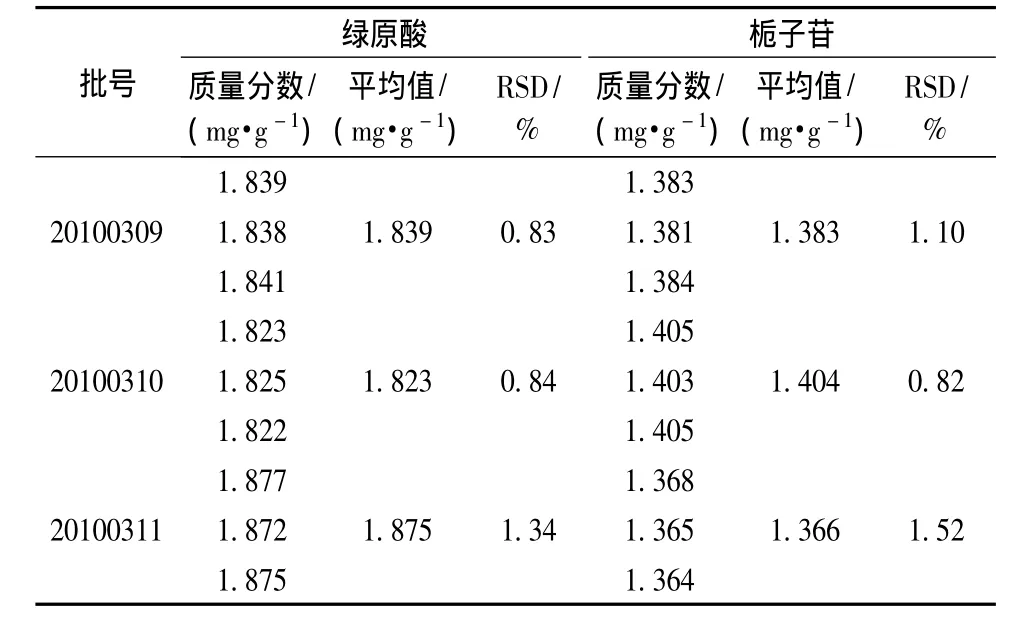
表4 绿原酸和栀子苷的测定结果Tab.4 Determ ination results of chlorogenic acid and geniposide
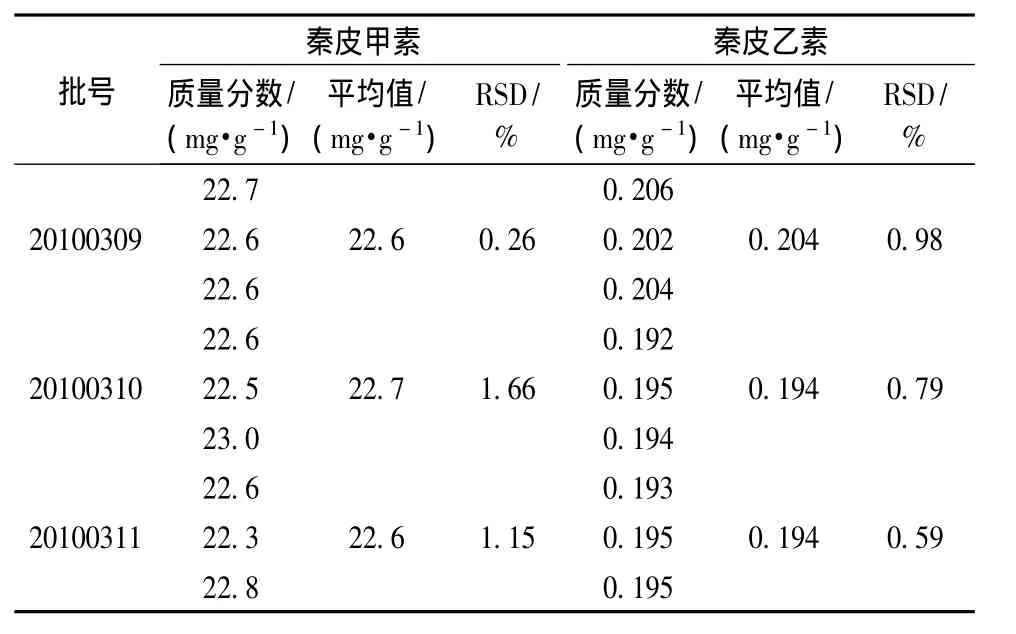
表5 秦皮甲素和秦皮乙素的测定结果Tab.5 Determ ination results of aesculin and aesculetin
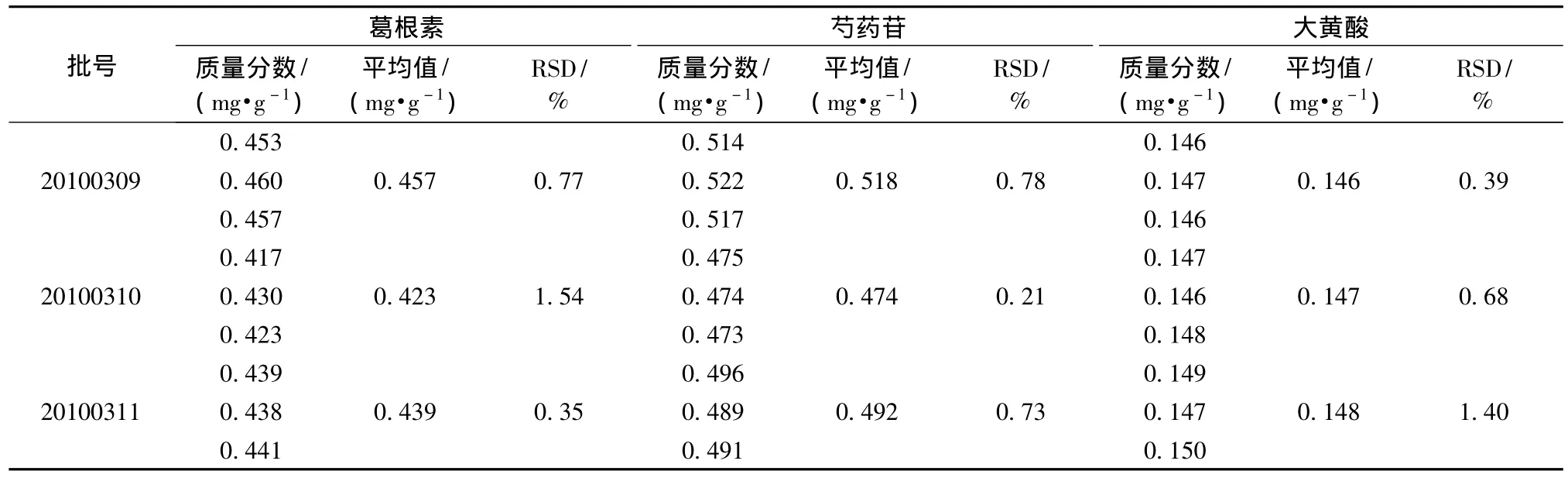
表6 葛根素、芍药苷和大黄酸的测定结果Tab.6 Determ ination results of puerarin,paeoniflorin and rhein
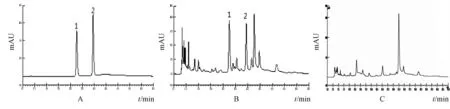
图5 绿原酸和栀子苷混合对照品 (A)﹑退黄丸供试品 (B)﹑缺绵茵陈及栀子的阴性样品 (C)HPLC色谱图Fig.5 HPLC chromatograms of chlorogenic and geniposide reference substances(A),Tuihuang Pills sam p le(B)and negative sam p le w ithout Artem isiae scopariae Herba and Gardeniae Fructus(C)
4 讨论
4.1 退黄丸中大黄、葛根、赤芍、秦皮的定性鉴别,与各自的阴性对照液进行了对照试验,结果无干扰。按处方药味比例,自配不含绵茵陈、栀子、葛根、赤芍、大黄和秦皮的阴性对照,结果发现液相色谱中阴性供试溶液在与对照品相同保留时间处未显色谱峰,表明阴性无干扰,说明本法准确可靠,方法可行。
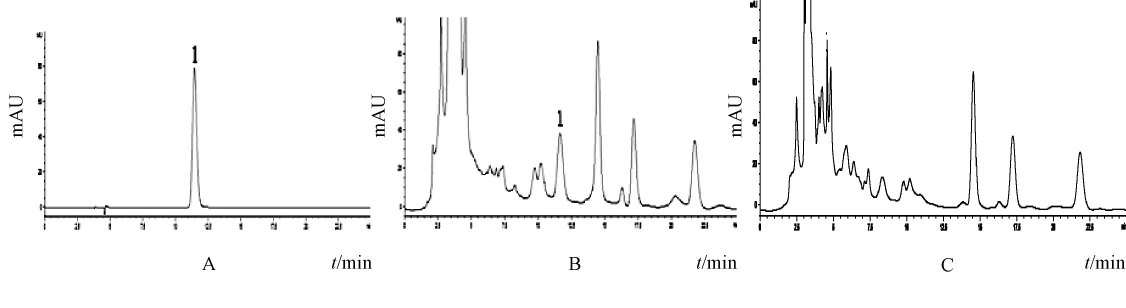
图6 葛根素对照品 (A)、退黄丸供试品 (B)、缺葛根阴性样品 (C)HPLC色谱图Fig.6 HPLC chromatograms of puerarin reference substance(A),Tuihuang Pills sample(B)and negative samp le w ithout Puerariae lobatae Radix(C)

图7 芍药苷对照品 (A)、退黄丸供试品 (B)、缺赤芍阴性样品 (C)HPLC色谱图Fig.7 HPLC chromatograms of paeoniflorin reference substance(A),Tuihuang Pills sample(B)and negative sample w ithout Paeoniae Radix rubra(C)
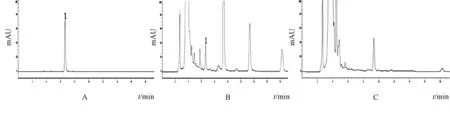
图8 大黄酸对照品 (A)、退黄丸供试品 (B)、缺大黄阴性样品 (C)HPLC色谱图Fig.8 HPLC chrom atogram s of rhein reference substance(A),Tuihuang Pills sample(B)and negative sam ple w ithout Rhei Radix et Rhizoma(C)
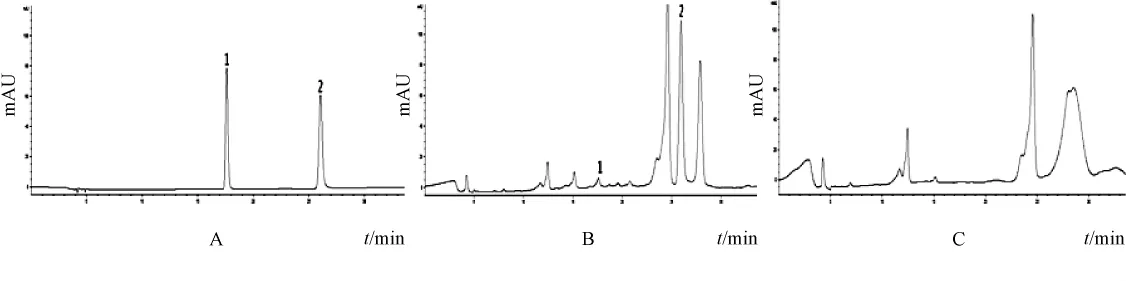
图9 秦皮甲素和秦皮乙素混合对照品 (A)、退黄丸供试品 (B)、缺秦皮阴性样品 (C)HPLC色谱图Fig.9 HPLC chromatogram s of aesculin and aesculetin reference substance(A),Tuihuang Pills sam ple(B)and negative sam ple w ithout Fraxini Cortex(C)
4.2 在定性鉴别中,采用《中国药典》方法三氯甲烷-甲醇-水 (7∶2.5∶0.25)鉴定葛根,葛根素分离效果不好,后改为三氯甲烷-甲醇-水 (7∶2∶0.5)作展开剂,取得满意分离效果。
4.3 由于该制剂为医院制剂,为更好地控制制剂质量,对其中六味药材绵茵陈、栀子、葛根、赤芍、大黄和秦皮做了HPLC的定量测定[8-13],测得结果发现几味药材中有效成分在药材中的转移率比较高,按本方制剂配比绿原酸、栀子苷、葛根素、芍药苷、大黄酸、秦皮甲素和秦皮乙素质量分数应分别不低于1.2 mg/g、0.8 mg/g、0.3 mg/g、0.37 mg/g、0.11 mg/g、0.018 mg/g、0.15 mg/g,结果测定值符合《中国药典》规定。
4.4 对于要同时测定的绿原酸及栀子苷,因其最大吸收波长[14-15]相差较大,利用全波长扫描最后确定在245 nm处两者的响应值相对较好,因此选择245 nm波长作为检测波长。
4.5 因该制剂中其他药材成分中也含有大黄素甲醚,芦荟大黄素等成分,对测定大黄中的其他4种成分有干扰,所以本试验对大黄只测定了大黄酸。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:223-224,232.
[2]高春华,张亚秋,袁子民,等.降糖丸中红参、大黄、葛根的薄层定性鉴别[J].锦州医学院学报,2004,25(4):74-75.
[3]薛 然,龚慕辛,崔 佳,等.二黄胶囊的薄层色谱鉴别[J].中药新药与临床药理,2007,18(3):131-134.
[4]李怀斌,侯建平,邵可众,等.复方天麻首乌酒中天麻素的鉴别[J].安徽中医学院学报,2002,21(6):50-51.
[5]王 艳,金 斌,汪 豪,等.咳舒颗粒质量标准研究[J].安徽中医学院学报,1999,18(2):44-46.
[6]肖 凌,易艳东.复宫胶囊的薄层色谱鉴别[J].湖北中医杂志,2006,28(2):50-51.
[7]冀春茹,王浴铭.中药化学实验技术与实验[M].郑州:河南科学技术出版社,1986:377-379.
[8]曹佩雪,梁光义.反相高效液相色谱法测定栀子苷含量[J].贵阳医学院学报,2003,28(12):480-481.
[9]袁学勤,迟静波,胥 云.HPLC测定野菊花中绿原酸的含量[J].中成药,2005,27(4):493-494.
[10]张建辉,杨代明,吴延瑞,等.HPLC法和紫外分光光度法测定葛根淀粉中葛根素含量的研究[J].食品与机械,2006,22(6):110-112.
[11]王 巧,刘荣霞,毕开顺,等.HPLC法测定白芍总苷胶囊中芍药内酯、芍药苷和苯甲酰芍药苷[J].中草药,2005,36(11):1630-1632.
[12]陈爱瑛,刘 放.反相高效液相色谱法测定大黄及其制剂中大黄酸的含量[J].现代中药研究与实践,2003,17(1):35-36.
[13]张苏阳,陈佳正,李晓英,等.藏药八味秦皮丸中秦皮甲素、秦皮乙素和麝香酮的定量测定[J].中成药,2011,33(6):984-988.
[14]张 颖,蒋俊春,孟建生.HPLC法测定茵栀口服液中栀子苷的含量[J].中国药师,2010,13(7):999-1000.
[15]陈怀冰.HPLC法测定感冒灵颗粒中绿原酸的含量[J].海峡药学,2009,21(1):53-54.