阻塞性睡眠呼吸暂停综合征大鼠海马病理改变及caspase-3的表达☆
2013-09-14史艳红徐平宋凯英潘成玉
史艳红徐平 宋凯英潘成玉
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)是指由于上气道狭窄或阻塞所致的每晚7h睡眠中呼吸暂停反复发作在30次以上,或平均每小时睡眠中呼吸暂停和低通气次数(睡眠呼吸暂停低通气指数)≥5次,伴有白天嗜睡、疲倦、反应迟钝及认知功能障碍的一组临床综合征。研究表明OSAS的认知功能障碍主要表现在短期记忆、警觉性、集中力、注意力和执行能力等方面[1]。受损的脑结构区域有大脑皮质、海马和白质等。尤其海马CA1区对间断缺氧敏感[2],易出现功能紊乱、结构受损[3,4]。但具体机制尚不明确。间歇低氧动物模型对OSAS的病理机制研究已经取得一些成果,但由于不能模拟人类OSAS自然发病状态及间歇低氧标准不一,使研究结果与临床之间存在争议。该实验采取本课题组前期予大鼠咽腔多点注射透明质酸钠凝胶建立上气道阻塞的OSAS模型[5]。观察海马CA1区病理改变,检测海马caspase-3的mRNA表达,探讨OSAS诱导海马损害可能的机制。
1 材料与方法
1.1 研究对象 清洁级雄性Wistar大鼠,体质量200~250g,共20只。由第三军医大学大坪医院动物中心提供[许可证号SCXK(渝)2007-0005]。抽签法随机分组:正常对照组7只,OSAS组13只(因为前期预实过程中大鼠的死亡率约占一半,故设计实验分组时OSAS组大鼠只数约加倍)。
1.2 模型制作
1.2.1 OSAS模型制作适应性喂养1周,隔夜禁食12h,2%戊巴比妥钠溶液55mg/kg腹腔注射麻醉大鼠。仰卧固定于操作台上,临床耳鼻喉科所用鼻镜作为开口器,暴露大鼠咽腔,分别于双侧舌腭弓、咽腭弓及舌根处等多点注射医用透明质酸钠凝胶,注射处可见有局部小隆起。注射时观察大鼠呼吸情况,动物有呼吸暂停出现时即停止注射。整个操作过程用止血钳将大鼠舌头牵拉到口腔外直至动物清醒,以防止窒息死亡。但可能因局部阻塞明显,模型制作中及制作后1h内有5只大鼠窒息死亡。
1.2.2 制作OSAS模型前后监测 OSAS模型制作前及制作4周后,用改造过的插件式多参数神经监护仪对大鼠各进行1次脑电波、口鼻气流及外周血氧饱和度的监测。大鼠隔夜禁食12h,2%戊巴比妥钠溶液25mg/kg腹腔注射浅麻醉模拟睡眠状态(弱刺激无反应,强刺激有反应)。监测过程中,大鼠若有烦躁,追加原注射量1/5的2%戊巴比妥钠溶液。以无菌针灸针为电极,分别刺入大鼠双侧瞳孔上方各0.5cm处及左、右侧乳突处颅骨骨膜(依次为FP1、FP2、A1、A2电极放置位置。其中FP1、FP2为记录电极,A1、A2为参考电极)。观察大鼠脑电波变化情况。口鼻气流热敏传感器置于大鼠鼻孔前方,观察呼吸波变化情况,判断是否有气流呼出。包裹式血氧探头经皮监测大鼠尾部血氧饱和度。判定标准:清醒期为高频率、低波幅脑电波;渐出现低频率、高波幅脑电波为睡眠期;胸腹式呼吸运动存在而口鼻气流呼吸波消失为阻塞性睡眠呼吸暂停;呼吸波消失≥2.5 s为一次呼吸暂停[6]。持续监测2h,统计血氧饱和度和呼吸暂停次数。计算每只大鼠平均血氧饱和度、最低血氧饱和度及呼吸暂停指数,并且造模后与造模前比较,差异有统计学意义,判定为造模成功。
12周后隔夜空腹12h,2%戊巴比妥钠溶液55mg/kg腹腔注射麻醉大鼠后,断头取脑,分离左侧海马,置入放有RNAiso Plus试剂的EP管中,存-80℃冰箱,备实时荧光定量PCR检测。取右侧视交叉后1mm至4mm处的冠状切面脑组织浸泡于10%甲醛溶液,备HE染色。
1.3 HE染色观察海马CA1区结构改变脑组织在10%甲醛溶液中固定24h后,制备组织石蜡块,行冠状切片,片厚5μm。常规HE染色。光学显微镜下观察海马CAI区结构改变。
1.4 实时荧光定量PCR方法检测海马caspase-3表达 样本总RNA提取,并反转录后的cDNA,用于实时荧光定量PCR。caspase-3上游引物:GAGACAGACAGTGGAACTGACGATG,下游引物:GGCGCAAA-GTGACTGGATGA,内参β-actin上游引物:GGAGATTACTGCCCTGGCTCCTA,下游引物:GACTCATCGTACTCCTGCTTGCTG(引物由宝生物工程大连有限公司合成),总反应体系为15μL,其中SYBR Premix Ex TaqTMⅡ7.5μL,上下游引物(10μmol/L)共0.5μL,cDNA(0.5μL/mL)模板3μL,加0.1%DEPC 4μL。扩增条件:预变性95℃,3 min,随后是95℃,10 s;56℃,45 s共40个循环。扩增反应结束后继续缓慢加热到95℃1min,55℃1min,80个循环,55℃10s。每个样本同时行目的基因和内参基因检测,均做复孔。根据Ct值计算各样品caspase-3的mRNA相对表达量:①dCt=(Ct1+Ct2)/2-中间值;②基因的表达=2-dCt;③相对定量=目的基因的表达/内参基因的表达。
1.5 统计学处理统计数据均采用SPSS 20.0处理。计量资料以均数±标准差(x±s)表示,各组变量均经正态性检验,组内造模前后资料对比分析采用配对t检验,两组间比较采用独立样本t检验;变量间相关性分析采用Pearson相关分析。检验水准α=0.05。
2 结果
2.1 一般情况正常对照组大鼠精神状态良好,反应灵敏,动作迅速。OSAS模型组大鼠出现睡眠打鼾,精神状态较差,反应灵敏性下降,行动迟缓;不明原因夜间死亡1只。
2.2 造模前后大鼠各呼吸指标比较 造模4周后再次行睡眠呼吸监测,其中1只大鼠仅有血氧饱和度的轻度降低,无明显的呼吸暂停,故剔除之,不参与下一步实验。OSAS模型组造模后与造模前比较,平均血氧饱和度、最低血氧饱和度均明显降低(t=9.34,P<0.01;t=16.64,P<0.01),呼吸暂停指数明显升高(t=-11.00,P<0.01),差异均有统计学意义。见表1。
2.3 大鼠海马CA1区HE染色结果正常对照组大鼠海马CA1区神经元细胞排列整齐致密,形态结构正常。OSAS模型组大鼠海马CA1区出现神经元细胞数量减少,排列紊乱,周围间隙增大,神经元细胞体积缩小,核固缩深染,核裂解等缺血缺氧性改变。见图1。
2.4 大鼠海马caspase-3 mRNA的表达每一个样本同时扩增目的基因和内参基因,扩增曲线呈“s”型,熔解度曲线呈单一峰,见图2。OSAS模型组与正常对照组比较,大鼠海马caspase-3 mRNA表达(1.21±0.35,0.67±0.10)明显升高,差异有统计学意义(t=-3.93,P<0.01)。
2.5 相关性分析OSAS模型组大鼠海马caspase-3表达与平均血氧饱和度、最低血氧饱和度均呈负相关(r=-0.88,P=0.02;r=-0.89,P=0.02),与呼吸暂停指数无相关性(r=0.77,P=0.07)。
3 讨论
实验通过阻塞上气道建立类似人类OSAS的大鼠模型,监测到造模后较造模前平均血氧饱和度、最低血氧饱和度均明显下降,呼吸暂停指数增加。出现OSAS的临床症状,如睡眠打鼾,呼吸暂停;精神状态较差,反应灵敏性渐下降,行动迟缓。动物夜间死亡考虑可能与上气道阻塞窒息有关。说明该OSAS模型建立成功,该造模方法稳定、可靠。
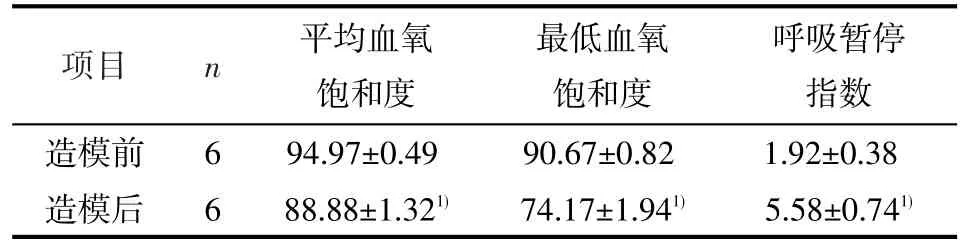
表1 造模前后大鼠平均血氧饱和度、最低血氧饱和度及呼吸暂停指数比较(n=6,x±s)

图1 大鼠海马CA1区HE×200
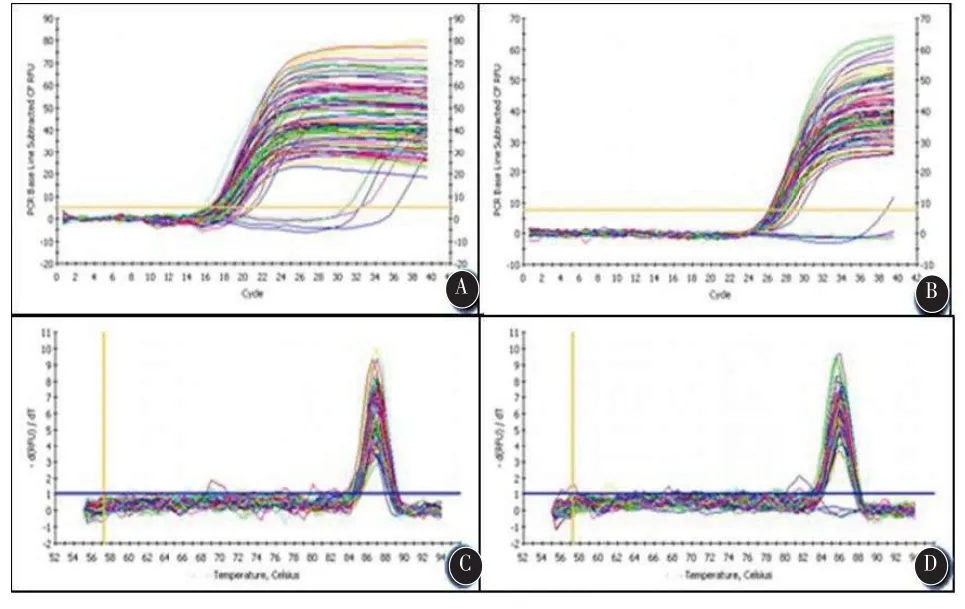
图2 基因的扩增和溶解曲线
OSAS主要以反复间断缺氧导致全身各器官组织受损为致病特点。神经系统耗氧量大,对缺氧敏感,间断低氧对海马的损害可能是认知功能障碍的重要原因。作为形态学证据,MRI研究证明OSAS患者存在包括海马在内的脑结构区域大量灰质缺失[7]。而间歇低氧的动物模型也证明海马非常容易受损,尤其CA1区[2]。因此,实验中模型组大鼠海马CA1区出现神经元细胞缺血缺氧性损伤的表现,可能与大鼠睡眠中上气道阻塞或低通气导致慢性间歇低氧有关。而海马神经元的受损和缺失,可通过N-乙酰天门冬氨酸/肌酸水平下降等机制导致认知障碍的发生[8]。由于考虑到动物耐受性有限,未进行水迷宫记忆能力测试,没有认知功能受损的具体证据,较为遗憾。
caspase-3是caspase家族中最为重要的一种半胱氨酸蛋白酶,是细胞凋亡的总开关。活化的caspase-3可切割许多蛋白质底物,导致细胞蛋白酶级联切割放大,使细胞发生凋亡。同时,caspase-3还可直接酶解抑凋亡基因Bcl-2,使其转为触发凋亡。因此,caspase-3的表达水平是影响细胞凋亡的重要因素。实验中OSAS模型组大鼠海马caspase-3 mRNA表达较正常对照组明显升高,提示OSAS大鼠海马区启动了凋亡程序,使神经元细胞凋亡增加。细胞凋亡是引起海马神经元数目减少的重要原因之一。因此,海马CA1区神经元细胞受损和缺失可能与caspase-3 mRNA表达上调有关。OSAS导致capase-3表达增加的机制尚不明确,可能与体内TNF-α的上调激活死亡受体,以及能量障碍、大量氧自由基等触发线粒体凋亡通路等有关。与该实验相似的研究,有间歇低氧大鼠模型用TUNEL方法检测到海马神经元细胞凋亡的报道[9]。
总之,该实验通过OSAS大鼠模型,证实了反复上气道阻塞或低通气可诱导海马Caspase-3表达增加,神经元细胞发生凋亡,导致CA1区神经元缺损,从而影响海马结构功能。可能在一定程度上揭示了OASA患者认知损害机制。
[1]Bawden FC,Oliveira CA,Caramelli P.Impact of obstructive sleep apnea on cognitive performance[J].Arq Neuropsiquiatr,2011,69(4):585-589.
[2]Hung MW,Tipoe GL,Poon AM,et a1.Protective effect of melatonin against hippocampal injury of rats with intermittent hypoxia[J].J Pineal Res,2008,44(2):214-221.
[3]Feng J,Wu Q,Zhang D,et al.Hippocampal impairments are associated with intermittent hypoxia of obstructive sleep apnea[J].Chin Med J(Engl),2012,125(4):696-701.
[4]Fung SJ,Xi M,Zhang J,et a1.Apnea produces excitotoxic hippocampal synapses and neuronal apoptosis[J].Exp Neurol.2012,238(2):107-113.
[5]宋凯英,徐平,史艳红.OSAS大鼠模型的实验研究[J].遵义医学院学报,2012,35(3):189-192.
[6]Carley D W,Trbovic S,Radulovacki M.Sleep apnea in nor mal and REM sleep deprived normotensive Wistar Kyoto and spontaneously hypertensive(SHR)rats[J].Physiol Behav,1996,59(4-5):827-831.
[7]Torelli F,Moscufo N,Garreffa G,et a1.Cognitive profile and brain morphological changes in obstructive sleep apnea[J].Neuroimage,2011,54(2):787-793.
[8]钟笑梅,宁玉萍,侯乐,等.路易体痴呆及阿尔茨海默病患者海马氢质子磁共振波谱研究[J].中国神经精神疾病杂志,2012,38(12):729-732.
[9]Li L,Wang HY,Chen BY,et al.Influence of different degrees of chronic intermittent hypoxia on c-fos protein and apoptosis in rats[J].Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi,2012,47(2):117-121.
