微小核糖核酸miR-146a-5p、miR-23a-3p在儿童耐药性癫痫血清中的表达
2013-09-14肖慧媚廖建湘蒋莉
肖慧媚廖建湘蒋莉
微小核糖核酸(microRNA,miRNA)是一类长度约为22个核苷酸组成的内源性非编码RNA,其功能是精确调节神经元及其他细胞的发育、分化、增殖、凋亡,以及参与调节免疫反应、神经元可塑性及信号传导中的mRNA转录后处理[1]。特定的血清miRNA表达谱可能成为癌症及其他疾病的诊断新型检测指标[2]。目前认为miR-146a、miR-23a与癫痫的发生密切相关[3,4]。耐药性癫痫的耐药机制不明确,且无明确的生物学诊断指标。本研究用Hiseq测序法及实时荧光定量PCR检测血清miR-146a-5p和miR-23a-3p的表达水平,探讨其在耐药性癫痫诊疗中临床意义。
1 材料与方法
1.1 研究对象本研究耐药组纳入标准:耐药性癫痫的诊断标准[5]根据国际抗癫痫联盟规定,癫痫患儿在经过正确使用两种治疗方案,具有足够的疗程及剂量治疗的情况下,仍未能达到无发作情形者为儿童耐药性癫痫(即:癫痫无发作少于3倍治疗前最长发作间隔或无发作短于12个月)。非耐药组纳入标准:使用抗癫痫药物前3个月发作次数大于3次,采用一种抗癫痫药物,持续6个月以上无发作。排除标准:有进行性神经系统疾病,遗传代谢病或颅内占位性疾病,肝肾功能不全,未规律服药等病史患者。收集2011年6月至2012年11月本院就诊的新诊断癫痫患儿70例。男27例,女43例,年龄5个月~3岁。随访后确诊其中35例为耐药性癫痫,35例为非耐药性癫痫。采集所有新诊断癫痫患儿用药前及达到入组标准用药后静脉血标本各70份。收集同期在本院已经确诊为耐药性癫痫用药后标本33例、非耐药性癫痫用药后标本29例,男27例,女35例,年龄9个月~6岁。收集同期在本院体检健康者55例作为健康对照组,男25例,女30例,年龄5个月~5岁。本研究经医院伦理委员会批准,并获得各研究对象监护人的知情同意。采集各研究对象的空腹静脉血5 mL,4℃、1500r/min离心5 min,收集血清后再4℃、3000r/min离心3 min,收集血清于EP管中,-80℃保存。
1.2 主要仪器及试剂 miRneasy Mini Kit、miScriptⅡRT Kit、内 参 Syn-celmiR-39-3p、miScript SYBR Green PCR Kit(德国Qiagen公司),LightCycler 480实时荧光定量PCR仪(瑞士Roche公司),X-12R台式低温离心机(德国贝克曼公司),Veriti96-W梯度PCR仪(美国ABI公司)。
1.3 Hisqe测序将35例耐药性癫痫及35例非耐药性癫痫患儿用药后血清送至深圳华大基因研究院进行血清总RNA提取、Hiseq测序及miRNA表达量差异性分析(项目编号:F12FTSSCKF0066)。
1.4 血清RNA的提取与逆转录取200µL血清,按miRneasy Mini Kit说明书操作提取RNA;按照miS-criptⅡRT Kit说明书操作提取进行逆转录反应cDNA,样本cDNA-20℃冰箱保存。
1.5 实时荧光定量PCR miR-23a-3p、miR-146a-5p、Syn-cel-miR-39-3p三种引物由德国QIAGEN公司设计和合成。PCR反应总体系为15µL,包括2×QuantiTect SYBR Green PCR Master Mix 7.5µL,10×miScript通用型引物1.5µL,10×miScript特异性引物 1.5µL,ddH2O 3.5µL,cDNA 1µL。循环参数:94 ℃ 15 s,55 ℃ 30 s,70 ℃ 30 s,共45个循环。采用相对定量法,结果以2-ΔΔCt表示。其中ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=ΔCt患者样本-ΔCt健康对照。2-ΔΔCtt为癫痫患儿目的基因表达相对于健康对照组的倍数。
1.6 统计学分析Hiseq测序结果使用log2-ratio、Scatter plot图比较两者共同表达的miRNA表达量的差异,以fold-change≥1.0或者≤0.5时认为miRNAs的表达有明显差异性,具有统计学意义[6];RT-qPCR结果用SPSS 20.0统计软件进行分析。数据满足正态分布,计量资料以xˉ±s表示,耐药性癫痫与非耐药性癫痫比较用独立样本t检验,耐药组用药前后比较及非耐药组用药前后比较用配对样本t检验,检测水准α=0.05。
2 结果
2.1 Hiseq测序结果 测序结果显示,与非耐药性癫痫患儿比较,78种miRNA在耐药性癫痫患儿中表达上升(let-7c、let-7g-5p、miR-100-5p、miR-101-3p、miR-106b-3p、miR-106b-5p、miR-107、miR-10a-5p、miR-10b-5p、miR-1185-1-3p、miR-126-3p、miR-127-3p、miR-1277-5p、miR-140-3p、miR-142-5p、miR-144-5p、miR-146a-5p、miR-146b-5p、miR-148b-3p、miR-16-2-3p、miR-16-5p、miR-17-5p、miR-181b-5p、miR-182-5p、miR-183-5p、miR-185-5p、miR-191-5p、miR-192-5p、miR-199a-3p、miR-199b-3p、miR-19a-3p、miR-203a、miR-20a-5p、miR-215、miR-221-3p、miR-23a-3p、miR-25-5p、miR-26a-5p、miR-26b-5p、miR-27a-3p、miR-301a-3p、miR-30a-5p、miR-30b-3p、miR-30d-5p、miR-30e-5p、miR-3199、miR-345-5p、miR-3613-5p、miR-363-3p、miR-374a-5p、miR-375、miR-378d、miR-381-3p、miR-410、miR-411-5p、miR-423-3p、miR-424-5p、miR-425-5p、miR-4286、miR-450b-5p、miR-451a、miR-454-3p、miR-4646-5p、miR-4732-3p、miR-486-3p、miR-486-5p、miR-493-5p、miR-500a-3p、miR-501-3p、miR-502-3p、miR-532-5p、miR-598、miR-660-5p、miR-92a-3p、miR-92b-3p、miR-93-5p、miR-98-5p、miR-99b-5p);22种miRNA表达下降(let-7d-5p、let-7e-5p、miR-1294、miR-130a-3p、miR-150-5p、miR-151a-3p、miR-151a-5p,miR-151b、miR-181a-3p、miR-186-5p、miR-21-3p、miR-222-3p、miR-320a、miR-320b、miR-339-5p、miR-378a-3p、miR-378c、miR-4454、miR-574-5p、miR-582-3p、miR-744-5p、miR-584-5p),差异性表达见图1。其中miR-146a-5p、miR-23a-3p 的 fold-change>1.0(分别为1.241和1.302)。
2.2 RT-qPCR检测结果
2.2.1 耐药性癫痫患儿、非耐药性癫痫患儿用药前血清miR-146a-5p、miR-23a-3p表达量比较与非耐药性癫痫相比较,耐药性癫痫用药前血清miR-146a-5p、miR-23a-3p的表达量均上升,具有统计学差异性(P<0.05),见表1。
2.2.2 耐药性癫痫患儿、非耐药性癫痫患儿用药后血清miR-146a-5pmiR-23a-3p表达量比较 与非耐药性癫痫相比较,耐药性癫痫患儿用药后血清中miR-146a-5p、miR-23a-3p表达水平均上升(P<0.05),见表2。
2.2.3 耐药性癫痫用药前后血清miR-146a-5p、miR-23a-3p表达量比较 与耐药性癫痫用药后相比较,耐药性癫痫血清miR-146a-5p、miR-23a-3p用药前的表达量与用药后的表达量无明显统计学差异性(P>0.05),见表3。
2.2.4 非耐药性癫痫用药前后血清miR-146a-5p、miR-23a-3p表达量比较 与非耐药性癫痫用药后相比较,非耐药性癫痫血清miR-146a-5p、miR-23a-3p用药前的表达量与用药后的表达量无明显统计学差异性(P>0.05),见表4。
3 讨论
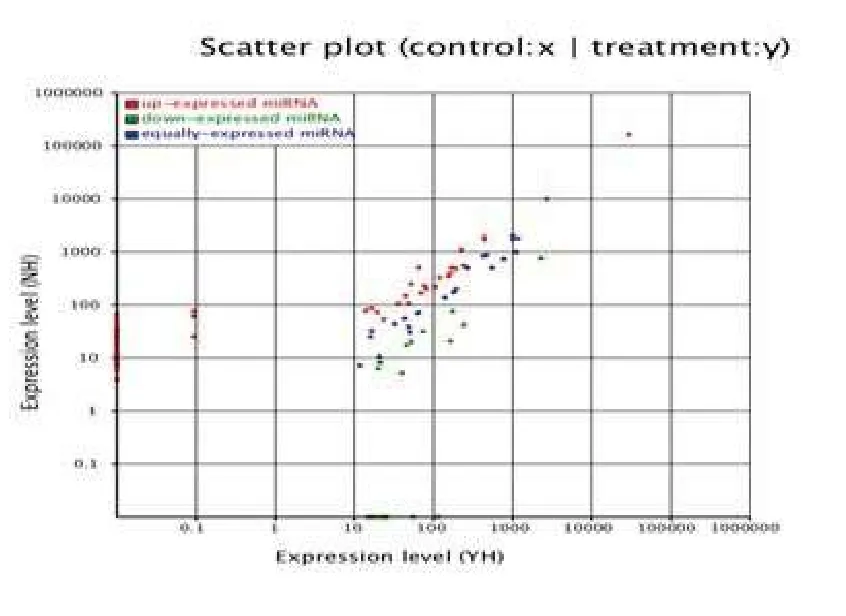
图1 耐药性癫痫与非耐药性癫痫患儿miRNA谱差异性表达结果
不同病理状态下一些miRNAs的改变可以稳定、特异性地反映体液,尤其是血清中的表达情况。本研究Hiseq测序结果显示,耐药性癫痫患儿较非耐药性癫痫患儿用药后血清中78种miRNA表达上升,22种miRNA表达下降。由于本实验是前瞻性研究,患者随访时间最短3个月,用药前血清在-80℃冰箱保存长达3个月以上,Hiseq测序结果显示用药前的血清miRNA存在较多的降解,故用药前的血清miRNA表达谱有待进一步改进研究。然而RT-qPCR所用的用药前标本是血清及时处理并逆转录为cDNA,其结果是可信的。比较miR-146a-5p、miR-23a-3p在耐药性癫痫用药前后的表达水平及非耐药性癫痫用药前后的表达水平,本研究发现二者在用药前后的表达水平无明显统计学差异性,推测抗癫痫药物可能对血清miR-146a-5p、miR-23a-3p的表达无明显作用。与非耐药性癫痫用药前比较,RT-qPCR结果显示miR-146a-5p、miR-23a-3p在耐药性癫痫用药前血清中表达水平明显升高,表明在初诊断癫痫时,这两种miRNA可能成为耐药性癫痫的早期诊断生物标记物和癫痫预后的评价指标。
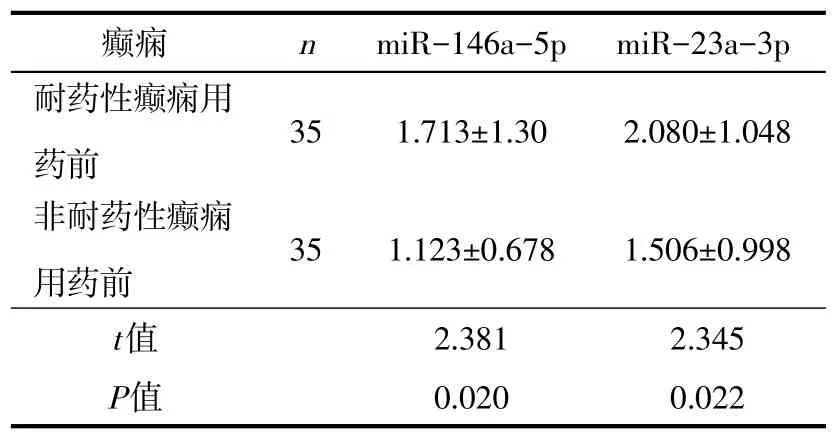
表1 耐药性癫痫患儿与非耐药性癫痫患儿用药前血清中miR-146a-5p、miR-23a-3p表达比较
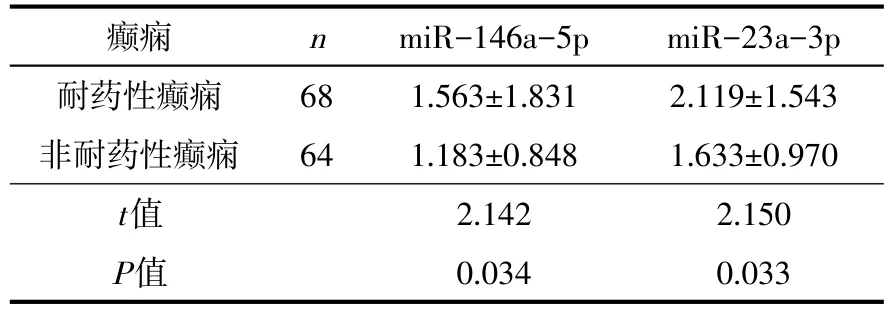
表2 耐药性癫痫与非耐药性癫痫用药后血清miR-146a-5p、miR-23a-3p表达比较
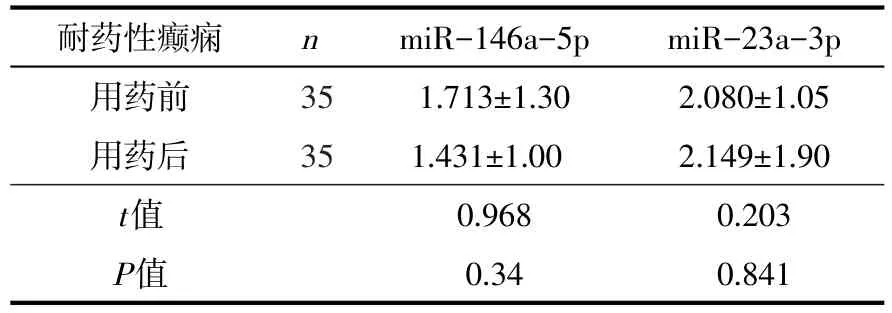
表3 耐药性癫痫用药前后血清中miR-146a-5p、miR-23a-3p表达量的比较
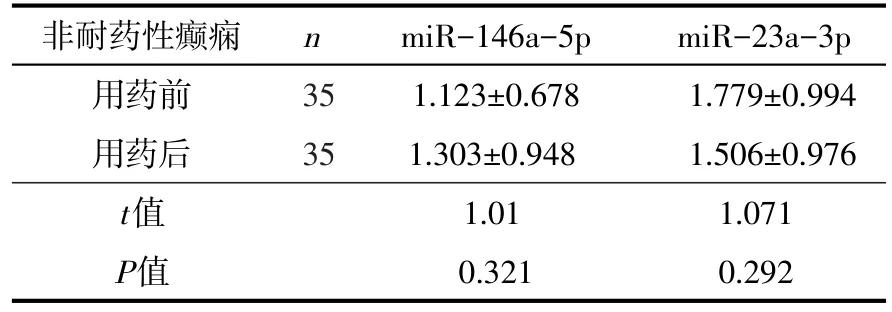
表4 非耐药性癫痫用药前后血清中miR-146a-5p、miR-23a-3p表达量的比较
miRNA参与了神经系统的生理学过程及信号通路的基因表达调控,如神经干细胞分化、神经系统发生和发育、树突棘形成、突触联系和神经保护等[7]。目前多数研究认为,血清miRNA来源主要从患者组织细胞中主动分泌进入血循环,血清miRNA表达水平可以反映病变组织内的情况。Hu等[8]研究发现,大鼠癫痫模型中大脑组织与外周血中的miRNA表达的变化趋势一致,二者有高度的相关性。
miR-146a是一种调节Toll样受体(TLR)信号通路和细胞因子受体信号通路的内源性调节因子,miR-146a与炎症性疾病有着密切关系[9]。Vezzani等[10]研究发现,在啮齿类动物癫痫模型的神经胶质细胞内炎症因子(如IL-1b和TNF-α)表达量明显升高,表明炎症反应对癫痫的发生发展有着重要的作用。Aronica等[11]研究发现,在大鼠癫痫模型和癫痫患者海马区的miR-146a均表达升高。Ahmed等研究[3]显示,在儿童颞叶内侧癫痫病变区的炎症因子IL-1β及miR-146a的表达升高。本研究结果表明,miRNA-146a-5p在耐药性癫痫患儿血清的表达量明显高于非耐药性癫痫,推测miR-146a-5p过调节炎症反应从而调控耐药性癫痫的发生、发展。
miR-23a在胶质瘤Ⅱ、Ⅲ级中表达逐渐上调,以在胶质瘤Ⅲ级中表达水平最高,由此表明miR-23参与调控神经胶质细胞的增生分化。Song[4]等研究发现,匹罗卡品所致颞叶癫痫大鼠模型的癫痫持续状态后24 h海马中的miR-23a表达量上升,同期大鼠海马中的突触重建活跃。大量研究表明耐药性癫痫耐药机制与胶质细胞增生、突触重建密切相关。本研究结果显示,miR-23a-3p在耐药性癫痫患儿血清中表达较非耐药性癫痫上升,表明miR-23a-3p可能是调节神经胶质细胞的增生以及突触重建调控着耐药性癫痫的形成。
总之,本研究首次对耐药性癫痫血清miR-146a-5p、miR-23a-3p表达水平进行探讨,二者可能通过调节神经胶质细胞增生、突触重建、炎症反应等参与调控耐药性癫痫的发生发展。为我们研究耐药性癫痫提供一个新的研究方向和思路,但具体作用机制有待进一步研究。
[1]汪作为,禹顺英,方贻儒.微小RNA及其在精神疾病研究中的应用[J].中国神经精神疾病杂志,2010,36(8):508-510.
[2]Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other disease[J].Cell Res,2008,18(10):997-1006.
[3]Ahmed O,Jing P,Ciliu Z,et al.Interleukin-1b and microRNA-146a in an immature rat model and children with mesial temporal lobe epilepsy[J].Epliepsia,2012,53(7):1215-1224.
[4]Song YJ,Tian XB,Zhang S,et al.Lobe epilepsy induces differential expression of hippocampal miRNAs including let-7e and miR-23a/b[J].Brain Res,2011,28(1387):134-140.
[5]Kwan P,Arzimanoglou A,Berg AT,et al.Definition of drug resistant epilepsy:Consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies[J].Epilapsia,2010,51(6):1069-1077.
[6]Li X,Chen J,Hu X,et al.Comparative mRNA and microRNA Expression Profiling of Three Genitourinary Cancers Reveals Common Hallmarks and Cancer-Specific Molecular Events[J].PLoS One,2011,6(7):e22570.
[7]Wienholds E,Kloosterman WP,Miska E,et al.MicroRNA expression in zebrafish embryonic development[J].Science,2005,309(5732):310-311.
[8]Hu K,Zhang C,Long L,et al.Profile of microRNAs in rat hippocampus following lithium-pilocarpine-induced status epilepticus[J].Neurosci,2011,488(3):252-257.
[9]Oteaqui D,Baranzini SE,Calvo B,et al.Differential micro RNA expression in PBMC from multiple sclerosis patients[J].PLoS One,2009,4(7):e6309.
[10]Vezzzani A,Ravizza T,Baiosso S,et al.Glia as a source of cytokines:implications for neuronal excitability and survival[J].Epilepsia,2008,49(2):24-32.
[11]Aronica E,Fluiter K,Lyer A,et al.Expression pattern of miR-146a,an inflammation-associated microRNA,in experimental and human temporal lobe epilepsy[J].Eur J Neurosci,2010,31(6):1100-1107.
