几种实验小鼠骨髓染色体和中国仓鼠不同组织同工酶分析
2013-09-11周华山胡火珍
周华山 陈 祥 赵 明 胡火珍
(四川大学生命科学学院 生物资源与生态环境教育部重点实验室,四川 成都 610064)
染色体是遗传物质的载体,生物的染色体非常稳定,不同物种的染色体都有各自特定的形态结构(包括染色体的长度、着丝点位置、臂比、随体大小等)特征。染色体组型分析是细胞遗传学研究的基本方法,是研究物种演化、分类以及染色体结构、形态与功能之间的关系不可缺少的重要手段。其研究已成为动物遗传、育种、病理、繁殖等学科中的一个非常重要的课题。染色体的制备最常用的途径是从骨髓细胞中制备染色体,此法不需无菌操作,设备简单,所用时间较短,适于大多数的动物体。鼠四肢骨内骨髓细胞中的造血干细胞是生成各种血细胞和原始细胞,具有高度的分裂能力。本实验采用这一材料,通过前处理,低渗,固定,制片,染色等步骤制得染色体标本,可观察到许多处于分裂中期的染色体,进行染色体组型分析。
同工酶是指同一种属中不同基因位点或同一位点的复等位基因编码的多肽链所组成的单体、纯聚体或杂交体。同工酶存在同一个体或同一组织中,在生理上、免疫学上、理化性质上都存在差异。由于酶是基因编码的产物,它在电场中迁移率的改变反映了酶蛋白的大小构形和肽链氨基酸的序列变化,即编码DNA顺序上的变化,所以可通过分析酶谱的变化来获得我们所需要的遗传信息。同工酶在临床医学应用上可能在细胞癌变过程中有多种同工酶谱发生变化。细胞同工酶分析可用来鉴定细胞种属,此外,因同工酶谱有脏器特异性,故同工酶常可较特异地反映某一脏器的病变。同工酶有多种类型,通常以乳酸脱氢酶(LDH)、核苷磷酸化酶(NP)、葡萄糖-6-磷酸脱氢酶(G6PD)、苹果酸脱氢酶(MD)等几种酶谱作为常用分析指标。由于同工酶的研究是从基因产物认识基因的存在,由生化表现型反映基因型,因此,同工酶已广泛应用到生物的遗传育种,动植物的分类及进化,临床检验以及诊断某些疾病等研究领域中〔1〕。本文通过优化的聚丙烯酰胺凝胶电泳分离供试细胞株和仓鼠四种不同脏器同工酶,对仓鼠及几种小鼠染色体组型及仓鼠不同组织同工酶进行了分析,初步探讨仓鼠与C57小鼠和ICR小鼠间的差异。同时揭示了同工酶在不同脏器组织中的表达情况。
1 材料与方法
1.1 材料 中国仓鼠购于中国医学科学院中国协和医科大学实验动物研究所;C57小鼠和ICR小鼠由四川省医学科学院实验动物研究中心提供;常用试剂均购于成都奥克生物技术有限公司。
1.2 方法
1.2.1 鼠骨髓细胞染色体制备方法 本文染色体制备操作方法参照四川大学生命科学学院编写的实验指导〔2〕及部分文献报道的实验方案〔3~6〕。
1.2.1.1 收集骨髓有核细胞 实验前4~5 h,将鼠称重后按100 μg/10 g体重从腹部注入适量体积的秋水仙素溶液,断颈处死,用剪刀剥取后腿股骨和胫骨,纱布去除表面肌肉,再用骨钳剪去两端,用注射器抽取PBS缓冲液冲洗骨髓腔,细胞收集于离心管中。反复冲洗几次至骨腔变白为止;离心1 000 r/min 8 min,去上清。
1.2.1.2 低渗处理 向离心管中加入8 ml于39℃预热的0.075 mol/L KCl低渗液,置于39℃水浴锅中35 min;离心1 000 r/min 8 min。
1.2.1.3 固定 低渗结束前1 min,向离心管中加入1 ml固定液行预固定,然后经1 000 r/min离心8 min,吸去上清液,加入3∶1甲醇-冰醋酸固定液至8 ml刻度,用吸管轻轻吹散细胞沉淀块,放入39℃水浴锅中20 min。
1.2.1.4 滴片 固定结束后,离心1 000 r/min 8 min,去上清,在留有细胞沉淀的离心管内加入1 ml固定液将细胞吹打均匀,取冰水预冷的湿玻片滴片(距离玻片上方至少30 cm高处),每片滴3~4滴后迅速吹散细胞,置酒精灯上微烤,放玻片架自然晾干。
1.2.1.5 染色 晾干后的玻片置1∶9 Giemsa染液染色10~15 min,取出后用蒸馏水或自来水冲片,自然晾干。
1.2.1.6 镜检 将破片置于显微镜下观察染色体制备情况,找出分裂相比较好的视野拍照,并计数染色体数目。
1.2.2 中国仓鼠肝、肾、心、脾四种组织及CHO细胞同工酶分析
1.2.2.1 细胞及组织蛋白提取 取中国仓鼠肝、肾、心、脾四种脏器,保存于液氮中。提取总蛋白时从液氮中取出脏器,放入匀浆器内,加入少许细胞裂解液并充分匀浆。冷冻离心机中14 000 r/min离心15 min收集上清备用。生长于培养瓶中的CHO细胞收集于离心管中,用PBS缓冲液清洗几遍后转移入1.5 ml EP管中,向其中加入1 ml细胞裂解液。然后用液氮反复冻融3~5次,使细胞完全破碎,完毕后于冷冻离心机中14 000 r/min离心15 min收集上清用于后续电泳分析。
1.2.2.2 电泳及显色 凝胶制备:采用聚丙烯酰胺凝胶电泳,由于不能让蛋白变性,所以电泳系统中不允许变性剂的存在。PAGE配方与SDS-PAGE配方相同,但需将其中的变性剂SDS去掉〔7〕。采用8%和12%的凝胶就能达到较好的分离效果。电泳条件也与SDS-PAGE相同,具体操作步骤可查阅相关文献〔8〕。显色:电泳结束后,关闭电源,取出胶板用清水冲洗几遍,放入染色盒内,然后倒入预先配制的显色液淹没整个胶片。之后将染色盒置于37度培养箱中显色。各个酶的染色液配方见下表〔8,9〕。
1.2.2.3 固定照胶 当凝胶片上出现染色条带后即可停止染色,小心取出胶片放入培养皿中,加入酶固定液作用一定时间,然后可在凝胶成像仪上拍照存档。

表1 各个酶系统染色液配方
2 结果
2.1 经滴片染色后可于显微镜下观察到染色体分型情况 本实验所用中国仓鼠,经骨髓细胞染色体制备观察到其染色体数为2n=28,中着丝粒染色体,近中着丝粒染色体和端着丝粒染色体均存在于细胞分裂相中(见图1)。而C57小鼠和ICR小鼠的染色体为2n=40,均为端着丝粒染色体(见图2和图3)。
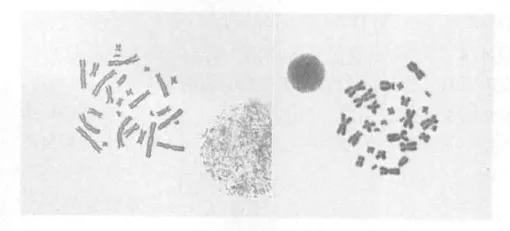
图1 仓鼠骨髓细胞染色体制备(2n=28)
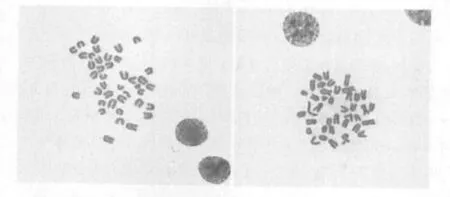
图2 C57小鼠骨髓细胞染色体制备(2n=40)

图3 ICR小鼠骨髓细胞染色体制备(2n=40)
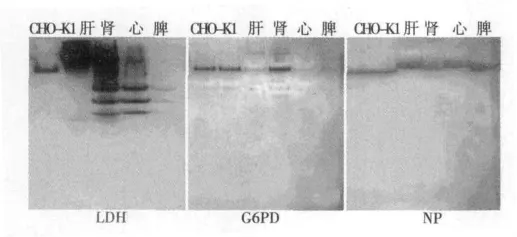
图4 细胞株及四种脏器组织同工酶显色条带
2.2 同工酶分析显示不同组织三种酶表达情况 从CHO细胞和四种组织中提取的总蛋白经聚丙烯酰胺凝胶电泳分离后,浸于对应的酶系统染色液中染色,即可在胶片上出现特异条带。LDH表达量高,出现条带的时间稍快,2 min便出现条带。LDH在四种脏器组织中均有表达,且在肾、心和脾脏中有较高含量,并出现了四条带,表现不同的同工酶亚型;G6PD和NP显带时间较长,需要30 min左右,在各个组织中也有不同程度的表达(图4)。
3 讨论
动物的染色体稳定,不同物种的染色体都有各自特定的形态结构(包括染色体的长度、着丝点位置、臂比、随体大小等)特征,而且这种形态特征是相对稳定的。染色体组型分析是研究物种演化、分类以及染色体结构、形态与功能之间的关系不可缺少的重要手段。
在生物学中,同工酶可用于研究物种进化、遗传变异、杂交育种和个体发育、组织分化等。同工酶的特征为属内种的分类和亲缘演化关系可提供更多的证据。在医学方面,同工酶是研究癌瘤发生的重要手段,癌瘤组织的同工酶谱常发生胚胎化现象,即合成过多的胎儿型同工酶。此外,因同工酶谱有脏器特异性,故同工酶常可较特异地反映某一脏器的病变。
本课题采用染色体及同工酶分析探讨几种常用实验小鼠细胞遗传特性及同工酶的组织特异性。
本实验发现中国仓鼠、C57小鼠和ICR小鼠虽然都是小鼠,但是染色体组型不同,中国仓鼠是2n=28,后两种小鼠则是2n=40,染色体组中染色体的形态也不一样,中国仓鼠染色体呈“X”形,可见明显的着丝粒,中着丝、近中着丝粒及近端着丝染色体均存在。而C57和ICR鼠均为端着丝粒染色体,呈“U”形,染色体较小,分散均匀。从该实验结果可以看出,小鼠不同种属染色体数目并不相同,因此表现出不同的表型。
同工酶分析发现,LDH含量较其他两种酶高,染色时出现条带的时间也稍短,2 min便出现。LDH在四种脏器组织中均有表达,且在肾、心和脾脏中含量较高,并出现了四条带,表现不同的同工酶亚型;G6PD和NP显带时间较长,需要30 min左右,在各个组织中也有不同程度的表达。其中G6PD在肾脏中含量较高,且与细胞株内表达情况相似。NP在四种脏器组织中的表达情况与细胞株的也很相似,几乎出现在同一大小范围内。
在实验过程中,我们作了多项改良,使实验效果更好。我们制备染色体的方法是以教研室之前优化方案为基准,并在此基础上做了适当改进。秋水仙素的量尽量控制在10 μg/g体重效果较好,也有文献报道5 μg/g体重为宜〔10〕;低渗时间比一般处理时间有所延长,本实验处理35 min能达到较好的制备效果;混匀细胞时注意吹打不能用力过猛,避免使细胞破碎,染色体提前释放而影响实验结果;滴片时保证一定的高度以便染色体能充分散开而不互相重叠;最后需要注意离心速度不宜太高以免使细胞提前破碎,太低则可能损失细胞。染色体制备过程虽然比较简单,但每一步的操作都必须小心谨慎,需要注意的事项也很多,造成失败的原因也很多〔11,12〕,所以需要牢记实验步骤按部就班的操作。
同工酶分析亦可用于体外培养细胞间交叉污染的鉴定。同工酶分析实验过程中,保证蛋白质的活性是关键。因此电泳系统中必须去除变性剂等可能使蛋白变性的因素以及提取蛋白过程中应尽量在低温环境下进行。保持蛋白的活性是同工酶特异染色的基础,否则电泳后的胶片将无法在染色液的作用下显示相应的条带。本实验的酶系统染色液配方综合了文献报道的几种染色方案,最终也证明仍然能够达到较好的效果,此染色方案可以作为其他实验室同工酶分析实验者的参考。
1 王志宏,曾科文.鸽子组织LDH同工酶电泳分析〔J〕.哈尔滨师范大学自然科学学报,1998;14(2):86-8.
2 李 虹.医学生物学与医学细胞生物学实验指导〔M〕.北京:科学出版社,2007:56-9.
3 林 颖,姜 芬.动物细胞染色体制备实验的改进〔J〕.福建医科大学学报,2006;36(2):228-9.
4 唐桂容,石红艳.两栖动物骨髓细胞染色体标本制备方法的改进〔J〕.绵阳师范学院报,2008;27(8):78-81.
5 赵淑娟,庞有志,白俊艳,等.禽类骨髓细胞染色体标本制备实验方法的改进〔J〕.实验动物科学,2010;27(2):17-24.
6 唐慕湘,张兴华,陈家强,等.小鼠染色体制备方法初探〔J〕.解剖学研究,2011;33(2):160-1.
7 陈毓荃编.生物化学试验方法和技术〔J〕.北京:科学出版社,2002:36-7.
8 李 岑,张国荣.动物细胞同工酶检测方法的改良及其应用〔J〕.中国医药生物技术,2007;2(1):54-6.
9 梁裕芬,韦俊彬,运晨霞,等.阴道毛滴虫和口腔毛滴虫5种同工酶谱对比分析〔J〕.第三军医大学学报,2010;32(11):1180-2.
10 谭秀华,梁 磊.秋水仙素对小鼠骨髓细胞有丝分裂的影响〔J〕.中国现代药物应用,2007;1(5):6-7.
11 刘涌涛,马全详,刘慧娟.小鼠骨髓细胞染色体标本制备中的失误与对策.生物学通报,2003;38(6):53-4.
12 黄 燕,赵小平,余 红,等.动物骨髓细胞染色体标本制备失败的原因分析〔J〕.生物学通报,2006;41(1):52-3.
