脐带间充质干细胞源性多巴胺能神经元中脑源性神经生长因子的表达研究
2013-09-10李慧赵璨张华张晓光欧阳溪冯美江
李慧 赵璨 张华 张晓光 欧阳溪 冯美江
帕金森病(Parkinson's disease,PD)是一种以黑质致密部多巴胺能神经元减少为主要病理特征的慢性进行性中枢神经系统退行性疾病。目前临床上主要通过药物或手术控制症状,但并不能阻断PD的病理生理进程,所以仍需寻找针对PD病因的治疗方法[1-2]。近年来研究证实,脐带间充质干细胞(MSCs)能被诱导分化为多巴胺(DA)能神经元,移植入PD模型鼠后症状改善,且中脑酪氨酸羟化酶(tyrosine hydroxylase,TH)表达量增加,因此可以作为PD的理想治疗方案。此外,越来越多的研究表明,分泌脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)可能是干细胞发挥作用的机制之一[3-4]。本研究尝试将人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,HUCMSCs)诱导分化为多巴胺能神经元(dopam-inergic neurons)并对其鉴定,进一步观察细胞中BDNF的表达情况。
1 材料和方法
1.1 材料 荧光二抗(购自武汉博士德公司),碱性成纤维细胞生长因子(bFGF)、音猥因子 (SHH)、成纤维细胞生长因子8(FGF8)、脑源性神经营养因子(BDNF)(购自RD公司),Tryple酶和N2因子(购自GIBCO公司),维生素C(Vit-C)和抗-TH抗体(购自美国Sigma公司),抗-BDNF抗体和抗-β-微管蛋白Ⅲ抗体(购自 abcam公司),抗-神经元核抗原(NeuN)抗体(购自北京中杉金桥公司),DAPI(购自碧云天公司),倒置荧光显微镜(为Olympus公司产品)。
1.2 方法
1.2.1 脐带MSCs的分离培养:本实验遵照伦理学标准及国家有关规范。在无菌条件下收集足月产健康新生儿脐带,用生理盐水充分冲洗并剔除脐动、静脉,剥离出华通氏胶后将其剪碎至1 mm3大小,接种于DMEM培养液(含10%胎牛血清)中,置37℃、5%CO2饱和湿度的孵育箱内培养。16 d时用Tryple酶消化,见胞质回缩时加入DMEM培养液(含10%胎牛血清)终止消化,将细胞悬液放入离心管内,800 r/min离心8 min,生理盐水洗涤2次,原代以1∶2的比例进行再次接种培养,记为P1代。P2代以后按1∶2或1∶3的比例传代培养。倒置显微镜下观察细胞形态并拍照。
1.2.2 诱导分化为多巴胺能神经元:将P3代脐带MSCs以1×104个/孔密度接种24孔细胞培养板。培养24 h后更换神经诱导液[DMEM/F12、50 μg/ml Vitc、250 ng/ml SHH、100 ng/ml FGF8、50 ng/ml bFGF、N2(100×)]。诱导9 d后,再往诱导液中加入50 ng/ml的BDNF(加入BDNF时,24孔板中的诱导液不换),继续诱导3 d,每天观察,拍照,未诱导的脐带MSCs作为对照。
1.2.3 诱导后细胞冻存、复苏与存活率检测:冻存时,采集诱导后细胞加入含10%二甲基亚砜(DMSO)的细胞冻存液,混匀后转入冻存管,放入4℃预冷程序降温盒,-80℃冰箱过夜后转入液氮中保存。复苏时,取出细胞冻存管立即放入37℃水浴箱,轻度摇动令其快速融化,将融化的细胞悬液转入含生理盐水的离心管中,离心去上清。取部分复苏细胞检测存活率:将细胞与台盼蓝混匀,计算细胞存活率(%)=活细胞总数/(活细胞总数+死细胞总数)×100%。
1.2.4 免疫荧光检测β-微管蛋白Ⅲ、NeuN、TH、BDNF蛋白表达:将P3代脐带MSCs以8×103/cm2的密度接种入铺有盖玻片的6孔板中培养24 h。采用上述神经诱导液诱导12 d后开始进行免疫荧光染色鉴定;已诱导的冻存细胞经复苏后,在铺有盖玻片的6孔板中贴壁生长后即可进行免疫荧光检测。4%多聚甲醛室温固定30 min,PBS清洗3次,每次3 min。加入含有0.1%TritonX-100的山羊血清室温孵育30 min后,分别与β-微管蛋白Ⅲ抗体(稀释浓度为1∶500)/TH(1∶1000)/NeuN(1∶100)/BDNF(1∶1500)孵育过夜;行荧光双标时与一抗混合液孵育过夜:鼠抗-TH和兔抗-BDNF/兔抗-TH和鼠抗β-微管蛋白Ⅲ;加入 DAPI(稀释浓度为1∶500)及相应二抗孵育120 min。荧光倒置显微镜观察。随机抽取3个视野进行细胞阳性率计数。
1.2.5 统计学分析:采用SPSS 13.0软件进行统计学分析,数据以±s表示,各实验组间比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 脐带MSCs诱导前后形态学观察 传代培养2~3代后,可见细胞形态较为一致,为细长梭形细胞,呈克隆样生长。见图1。
2.2 UCMSCs诱导后分化为多巴胺能样神经元
2.2.1 细胞形态观察:经诱导分化后可见细胞胞体变大,逐渐伸出突起并伸长,表现出神经细胞样形态。见图1。

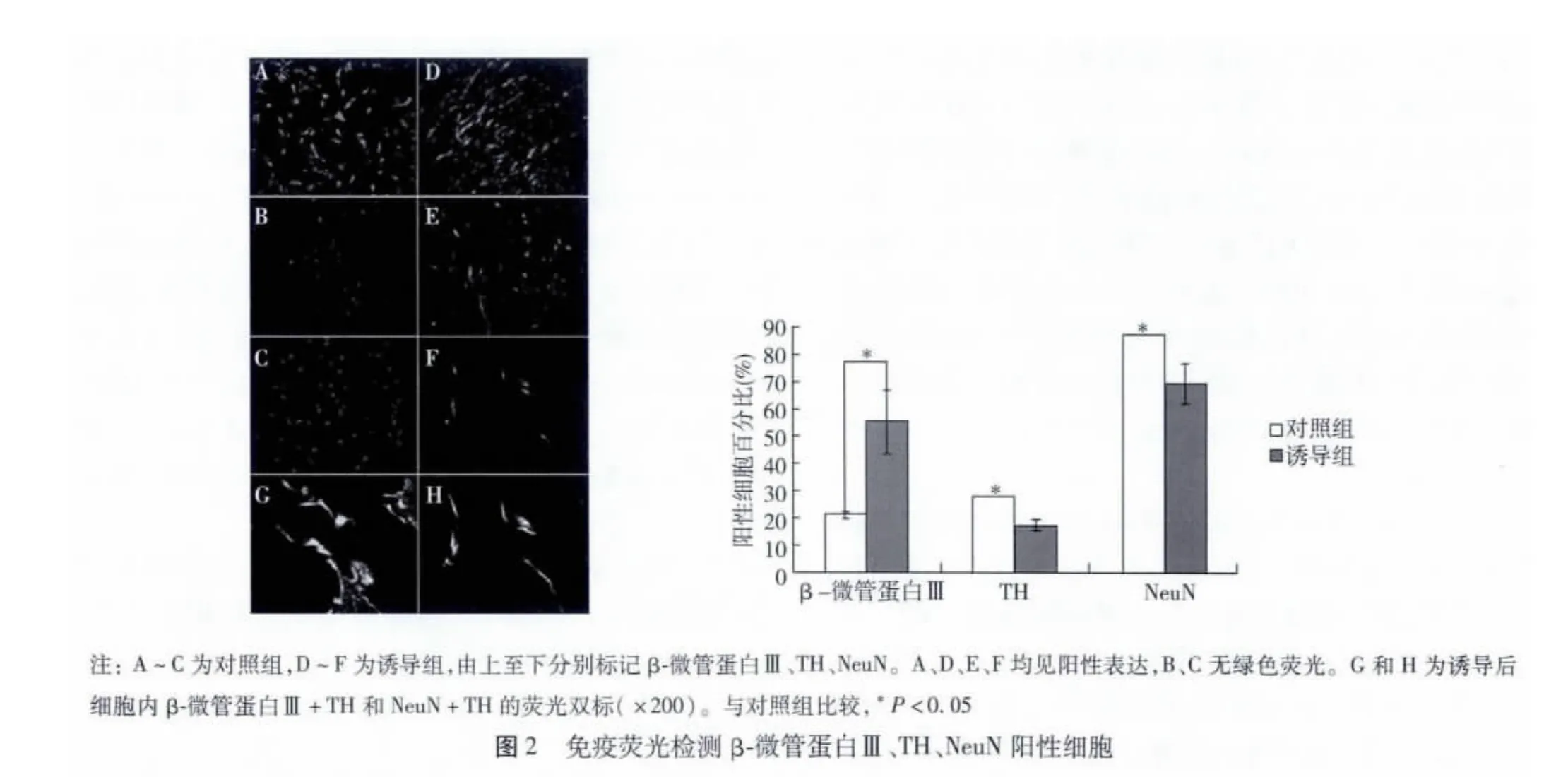
图1 脐带MSCs诱导前后形态学观察(×200)
2.2.2 免疫荧光鉴定神经细胞标记蛋白:对照组免疫荧光检测结果表明,未诱导的MSCs可表达β-微管蛋白Ⅲ,阳性率为(21.24±0.97)%,但NeuN、TH和BDNF均无表达。诱导组免疫荧光检测DA能神经元的特异性标志,TH阳性细胞表达率为(17.65±1.91)%;神经元标记物β-微管蛋白Ⅲ及NeuN阳性细胞比率分别为(55.54±11.67)%和(70.00±7.52)%,均较对照组明显升高(P<0.05)。用免疫荧光分别检测2组细胞内BDNF表达情况,对照组中无BDNF表达,而诱导组细胞中可见BDNF表达,阳性细胞比率为(14.15±3.04)%。复苏后的诱导细胞仍可稳定检测到β-微管蛋白Ⅲ、TH和NeuN的表达(图 2,3)。

2.2.3 已诱导细胞复苏后细胞存活率检测:细胞存活率为(92.5±1.83)%,复苏后状态良好,可在培养剂中正常生长。
3 讨论
PD患病率在>60岁老年人神经退行性疾病中位居第二,仅次于阿尔茨海默病,临床表现为静止性震颤、肌肉强直、运动迟缓、步态异常。中脑黑质DA能神经元的进行性变性、缺失和死亡是PD的主要病理改变。但是,目前的常规治疗(包括内科及外科治疗)仅能控制症状,并不能延缓、阻止PD病理的进展[1-2]。所以寻找针对PD的病因治疗手段已成为当前该领域临床研究的重点与难点。
干细胞是一类具有自我更新和多向分化潜能的细胞,能在体内存活,分泌细胞因子,并替代死亡或者衰老的细胞。此外,干细胞源性DA能神经元行移植治疗还可补充脑内TH的不足,促进脑内DA的合成,因此,目前认为PD是最适合进行细胞替代治疗(cell replacement therapy,CRT)的中枢神经系统退行性疾病[5]。目前认为,多种类型的干细胞都可向DA能神经元诱导分化,但脐带MSCs有明显的优越性,其来源广泛、易培养、免疫源性小、无伦理道德争议及移植后能够长期存活,从而决定其可作为一种优秀的种子细胞[6]。
本实验采用脐带MSCs行两步诱导法,首先应用SHH、FGF8、bFGF等特定细胞因子使其诱导分化形成成熟的神经元,分化比例约为70%,并可明显表达β-微管蛋白Ⅲ及NeuN等神经元特异性标志物;再应用BDNF使其定向诱导分化形成多DA神经元,比例约为17.65%,并可明显表达特异性TH,诱导效率良好。诱导细胞可通过低温保存,复苏后细胞存活率高达(92.5±1.83)%,且能够稳定表达TH、β-微管蛋白 Ⅲ和NeuN。
本实验检测了诱导前后细胞中BDNF的表达,发现诱导前无BDNF表达,而诱导后细胞中可见明显BDNF表达,且BDNF与TH共定位。大量研究表明,BDNF对DA能神经元有营养、促分化和保护作用,应用反义核酸阻断BDNF表达可导致黑质内DA能神经元缺失[7-8],提示 BDNF可能与 PD的发生和发展有关。同时有实验证明,在PD模型鼠黑质内行人MSCs移植治疗后,脑内BDNF含量明显增高[9]。另外,在其他中枢神经系统疾病的细胞替代治疗研究中发现BDNF与干细胞移植联合治疗效果优于单纯干细胞移植治疗[10]。目前普遍认同胶质细胞源性神经营养因子(glial cell line-derived neurotrophic factor,GDNF)在干细胞治疗PD时发挥了一定的作用,而近期的研究表明,在PD小鼠模型中,GDNF对DA能神经元的保护作用可能是通过上调Pitx3介导的细胞内BDNF合成而实现的[11]。上述研究均提示,BDNF能提高干细胞移植的疗效并且可能是该疗法的作用机制之一。我们对比了诱导前后细胞内BDNF的表达,HUCMSCs无表达,而诱导后细胞表达比率为(14.15±3.04)%。该结果提示,诱导后含部分DA能神经元的细胞可能较HUCMSCs更适合PD的细胞替代治疗。
综上所述,脐带MSCs经特定的诱导剂作用后可部分定向分化为PA能神经元,此类DA能神经元内不仅能有效表达TH,还可表达BDNF,因此不仅有可能补充脑内DA的生成不足,还可能发挥神经营养与保护作用。我们的研究结果可能为今后应用此类细胞进行PD的细胞替代治疗提供一定的理论基础。然而,PD细胞替代治疗的疗效不仅取决于干细胞供体,可能还与其体内存活率、分化潜能以及微环境与干细胞的相互影响等因素有关。所以,仍需在今后的在体实验中进一步观察,以明确此类来源于HUCMSCs的DA能神经元在PD细胞替代治疗中的真正作用。
[1]张艳玲,苏炳银,陈康宁.帕金森病发病免疫机制的研究进展[J]. 实用老年医学,2009,23(2):150-152.
[2]华智强.普拉克索治疗帕金森病非运动症状的疗效观察[J]. 实用老年医学,2010,24(6):498-500.
[3]Somoza R,Juri C,Baes M,et al.Intranigral transplantation of epigenetically induced BDNF-secreting human mesenchymal stem cells:implications for cell-based therapies in Parkinson's disease [J].Biol Blood Marrow Transplant,2010,16(11):1530-1540.
[4]Jin GZ,Cho SJ,Choi EG,et al.Rat mesenchymal stem cells increase tyrosine hydroxylase expression and dopamine content in ventral mesencephalic cells in vitro[J].Cell Biol Int,2008,32(11):1433-1438.
[5]Brundin P,Kordower JH.Neuropathology in transplants in Parkinson's disease:implications for disease pathogenesis and the future of cell therapy [J].Prog Brain Res,2012,200:221-241.
[6]Shetty P,Thakur AM,Viswanathan C,et al.Dopaminergic cells,derived from a high efficiency differentiation protocol from umbilical cord derived mesenchymal stem cells,alleviate symptoms in a Parkinson's disease rodent model[J].Cell Biol Int,2013,37(2):167-180.
[7]Baydyuk M,Xie Y,Tessarollo L,et al.Midbrain-derived neurotrophins support survival of immature striatal projection neurons[J].J Neurosci,2013,33(8):3363-3369.
[8]Porritt MJ,Batchelor PE,Howells DW,et al.Inhibiting BDNF expression by antisense oligonucleotide infusion causes loss of nigral dopaminergic neurons [J].Exp Neurol,2005,192(1):226-234.
[9]Cova L,Armentero MT,Zennaro E,et al.Multiple neurogenic and neurorescue effects of human mesenchymal stem cell aftertransplantation in an experimentalmodelof Parkinson's disease[J].Brain Res,2010,1311:12-27.
[10]王海燕,朱晓峰,王丽敏,等.神经营养因子与神经干细胞移植联合治疗缺氧缺血性脑损伤的实验研究[J].中国新生儿科杂志,2007,22(6):340-345.
[11]Peng C,Aron L,Klein R,et al.Pitx3 is a critical mediator of GDNF-induced BDNF expression in nigrostriatal dopaminergicNeurons [J].JNeurosci, 2011, 31(36):12802-12815.
