TGFβ1和CD4+CD2 5+调节性T细胞表达在系统性红斑狼疮发病中的意义
2013-09-07孙保东蔡文虹洪小平刘冬舟谭艳红
孙保东 蔡文虹 洪小平 刘冬舟 黄 勤 谭艳红
暨南大学第二附属医院 深圳市人民医院风湿科,广东深圳 518020
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种典型的异质性自身免疫病,主要表现为自身反应性T、B淋巴细胞过度激活以及多种自身抗体(主要是抗核抗体)的产生,循环免疫复合物沉积或形成,导致多个系统器官损伤等。但SLE病因和免疫耐受紊乱机制等尚未阐明。
转化生长因子 β(transforming growth factorβ,TGFβ)是一种重要的负性免疫调节细胞因子,在人类中可分为TGFβ1~3,其中最重要的是 TGFβ1[1]。 CD4+CD25+调节性 T 细胞(Treg)是一种参与自身抗原外周耐受和外来抗原免疫应答调节的主要调节T细胞亚群,对维持外周免疫耐受有重要意义[2]。研究表明两者功能上存在着密切联系,如TGFβ可以促使幼稚T细胞向调节性T细胞分化成熟,调节性T细胞可通过分泌TGFβ发挥免疫抑制作用等[3]。因此,TGFβ和CD4+CD25+调节性T细胞分别在细胞因子和细胞水平上对维持机体免疫平衡、免疫耐受等起重要作用,两者数量或功能缺陷均可能导致或加重自身免疫病的发生发展[1-2]。
已有研究显示,SLE患者TGFβ和CD4+CD25+调节性T细胞表达和功能异常[4~8],但结果不统一。为探索SLE免疫紊乱机制,本文对SLE患者血清TGFβ1和外周血CD4+CD25+调节性T细胞表达进行检测,并结合临床资料进行分析。
1 对象和方法
1.1 研究对象
选择2011年6月~2012年9月本院风湿科门诊及住院SLE患者,均符合1997年美国风湿病学会(ACR)修订的SLE分类标准。据SLEDAI积分法分为活动组(≥10分)和稳定组(<10分)。正常对照组为本院体检女性,体检结果无明显异常且年龄与SLE组患者相匹配。
1.2 血清 TGFβ1检测
所有受试者晨起空腹干燥管抽取静脉血2 ml,离心取血清,-80℃保存。采用ELISA法集中检测血清TGFβ1水平,采用美国R&D公司TGFβ1检测试剂盒,操作按说明书。
1.3 CD4+CD25+调节性T细胞检测
采用流式细胞术检测法,取受试者100 μl抗凝静脉血,分别加入10 μl PE标记鼠抗人CD25单抗和FITC标记鼠抗人CD4单抗(均美国BD公司),室温避光放置30 min,再加入红细胞裂解液2 ml,室温避光10 min,2000 r/min低温离心5 min,弃上清,PBS 2 ml洗涤2次后再加入0.5 ml PBS重悬,EPILS-ALTRA型流式细胞分析仪(美国库尔特公司)检测,EXPO2软件分析。据前向散射光和侧向散射光以淋巴细胞群设门,测定标本CD4+CD25+调节性T细胞占总淋巴细胞百分率;以单个细胞抗CD25荧光强度≥10设为CD25high细胞,计算CD4+CD25high调节性T细胞占总淋巴细胞的百分率。
1.4 其他抗体检测
抗核抗体(ANA)采用间接免疫荧光法测定,抗可抽提核抗原抗体(ENA)采用免疫印迹法测定,抗双链DNA抗体(ds-DNA抗体)采用放射免疫法测定,血清补体C3、C4采用免疫比浊法测定等。
1.5 统计学处理
2 结果
2.1 SLE患者血清TGFβ1的表达水平
SLE活动组患者TGFβ1表达明显低于正常对照组和稳定组患者(P<0.01),而稳定组和正常对照组TGFβ1表达差异无统计学意义(P>0.05)(表 1)。
表1 SLE患者与对照组血清TGFβ1表达水平的比较(±s)
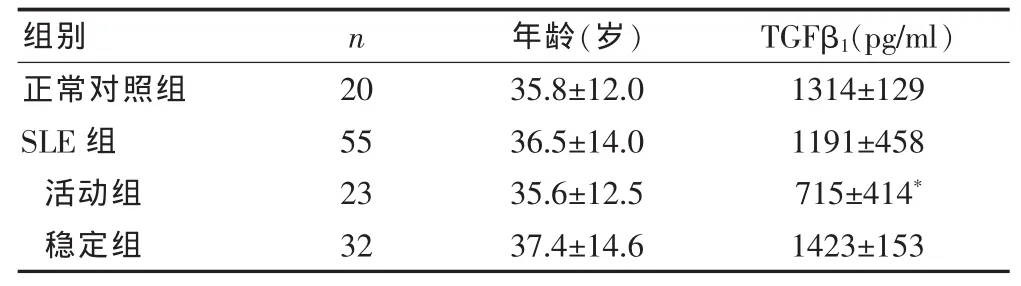
表1 SLE患者与对照组血清TGFβ1表达水平的比较(±s)
与正常对照组和稳定组比较,*P<0.01
组别 n年龄(岁) TGFβ1(pg/ml)正常对照组SLE组活动组稳定组20 55 23 32 35.8±12.0 36.5±14.0 35.6±12.5 37.4±14.6 1314±129 1191±458 715±414*1423±153
2.2 SLE患者CD4+CD25+、CD4+CD25high调节性T细胞的表达
活动SLE患者CD4+CD25+调节性T细胞、CD4+CD25high调节性T细胞和CD4+T细胞占总淋巴细胞的百分率均低于正常对照组和稳定组患者(均P<0.05),而稳定组SLE与正常对照组差异无统计学意义(P>0.05)(表2)。
表2 SLE患者外周血CD4+CD25+、CD4+CD25high调节性T细胞百分率(%,±s)

表2 SLE患者外周血CD4+CD25+、CD4+CD25high调节性T细胞百分率(%,±s)
与正常对照组和SLE稳定组比较,*P<0.05
组别 n年龄(岁,±s)CD4+CD25+ CD4+CD25high CD4+ CD4+中CD25+正常对照组SLE组活动组稳定组20 38 15 23 36.0±8.5 36.4±9.4 35.3±6.5 37.1±8.4 8.78±2.87 8.5±3.4 4.53±0.85*10.89±1.41 1.88±0.64 1.63±1.2 0.87±0.5*2.09±1.28 34.75±6.35 29.68±8.03 21.5±5.13*34.58±4.64 18.53±4.6 18.59±6.0 16.13±4.47 20.06±6.53
2.3 相关性分析
SLE患者TGFβ1表达、CD4+CD25+调节性T细胞和CD4+CD25high调节性T细胞数均与狼疮活动度SLEDAI积分成负相关(P<0.05),与病程、免疫球蛋白、补体、抗ds-DNA量等未见明显相关性(均P>0.05)(表3)。15例患者同时检测TGFβ1和CD4+CD25+调节性T细胞数,两者之间未见明显相关性(r=0.51,P=0.113)。 此外,SLE 患者血清 TGFβ1表达与外周血小板数量和血红蛋白量成正相关(r=0.71,P=0.001 和 r=0.44,P=0.042)。
3 讨论
TGFβ是一种重要的负性免疫调节因子,可作用于免疫系统的各个环节,如抑制免疫活性细胞的增殖和分化,抑制细胞因子和抗体产生等。TGFβ表达或功能异常与自身免疫病的发生发展有关,如敲除TGFβ1基因老鼠临床表现与人SLE、干燥综合征极其类似[1]。本文检测结果显示,活动SLE血清TGFβ1水平明显下降,并且与疾病活动度呈负相关,而稳定期患者表达水平不低,这与多数报道结果一致[4-6],提示TGFβ1表达可能参与SLE发病或促进病情活动,并可能有助于临床判断疾病活动度等。然而TGFβ1表达与其他临床指标如抗ds-DNA量、24 h尿蛋白定量、补体等未见明显相关性,提示TGFβ可能只是SLE发病的一个因素。活动SLE患者血清TGFβ1表达减少可能主要与外周血单个核细胞尤其是NK细胞产生TGFβ能力下降有关[1,4]。其次,发现患者TGFβ1水平与血小板数量成正相关,而活动SLE患者血小板常减少,这可能也是血清TGFβ1减少的一个原因。
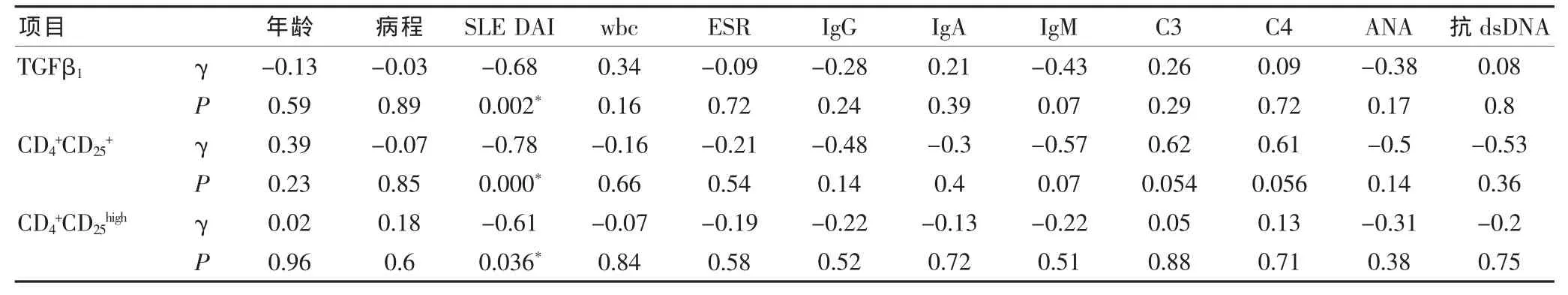
表3 SLE患者TGFβ1、CD4+CD25+调节性T细胞与临床指标的相关性分析
CD4+CD25+调节性T细胞是近年来发现的一种最主要的调节性T细胞,即高表达CD25和Foxp3的CD4+调节性T细胞亚群。研究显示,CD4+CD25+调节性T细胞可对多种免疫细胞发挥抑制效应,如调控B细胞产生抗体等[9],在维持机体自身耐受和自身免疫疾病发生发展中具有重要意义[2]。近期研究显示,多发性硬化[10]、哮喘[11]、特发性血小板减少性紫癜[12]等发病均与调节性T细胞异常有关。本研究显示,活动SLE患者CD4+CD25+调节性T细胞表达减少,而稳定期患者与正常对照无差别,这与国内外报道结果基本一致[6-8]。有研究认为在人类外周血有免疫抑制活性的主要是CD4+CD25high调节性T细胞,本文以荧光强度≥10定义CD25high细胞,发现活动性患者CD4+CD25high也是降低的,并且与SLEDAI积分负相关,这均提示CD4+CD25+调节性T细胞可能参与SLE发病,并且可能和病情活动有关。但相关分析未发现外周血CD4+CD25+和CD4+CD25high调节性T细胞数与其他临床指标的相关性,说明它们可能没有直接参与SLE临床病理和临床表型等。不过,国内有学者报道CD4+CD25+调节性T细胞等与狼疮肾炎[13]、狼疮中医辨证分型[14]等相关,但本文并未发现狼疮患者蛋白尿或血尿与CD4+CD25+调节性T细胞相关性。活动期SLE患者CD4+CD25+调节性T细胞减少的原因有待进一步阐明。早期有研究表明,SLE患者外周血CD4+细胞减少与病情活动相关,其减少可能与抗体所致破坏和凋亡过多有关[15]。本研究发现SLE患者CD4+CD25+调节性T细胞占CD4+T细胞比率与正常对照无差异,并且与CD4+T细胞数呈正相关,提示CD4+CD25+调节性T细胞减少可能主要是由于CD4+T细胞减少所致。因此,设法提高调节性T细胞数量和功能可能是SLE治疗的重要新方法。已有研究发现,雷帕霉素可以促进TGFβ1诱导分化的调节性T细胞增殖,且具有免疫抑制功能,这为体外回输调节性T细胞治疗自身免疫病提供了可能[16]。
TGFβ和CD4+CD25+调节性T细胞功能可能存在密切联系,已有研究表明,TGFβ1不仅是调节性T细胞的分泌因子,它更能调控调节性T细胞分化和功能[2-3],而SLE患者CD4+CD25+调节性T细胞分泌TGFβ异常[5,8]。本文对部分患者同时检测TGFβ1和CD4+CD25+调节性T细胞数,但未发现两者之间明显相关,这与陈伟等[4]报道一致,提示其表达可能受多种因素影响,功能上可能存在相对独立性。当然,也不排除例数少对统计结果的影响,必要时扩大样本数等深入研究其相互作用。此外,Foxp3基因表达对CD4+CD25+调节性T细胞形成和功能维持起重要作用,SLE患者CD4+CD25+调节性T细胞功能有无异常以及与TGFβ表达调控的关系等有待进一步研究。
[1]阎衡.转化生长因子β与自身免疫性疾病[J].国外医学免疫学分册,2002,25(1):25-27.
[2]Vila J,Isaacs JD,Anderson AE.Regulatory T cells and autoimmunity[J].Curr Opin Hematol,2009,16(4):274-279.
[3]夏桃林,吴振权,杨明,等.TGFβ1和 COX-2对CD4+CD25+调节性 T细胞的调控作用[J].医学综述,2010,16(22):3390-3392.
[4]陈伟,李向培,翟志敏,等.系统性红斑狼疮患者外周血调节性T细胞与 TGF-β 水平变化及其意义[J].山东医药,2006,46(32):11-13.
[5]Lu LY,Chu JJ,Lu PJ,et al.Expression of intracellular transforming growth factor beta1 in CD4+CD25+cells in patients with systemic lupus erythematosus[J].J Microbiol Immunol Infect,2008,41(2):165-173.
[6]姜有金,陈兴国,潘玉琴,等.SLE患者血中调节性T细胞及TGF-β1 的表达[J].放射免疫学杂志,2010,23(6):605-608.
[7]Habibagahi M,Habibagahi Z,Jaberipour M,et al.Quantification of regulatory T cells in peripheral blood of patients with systemic lupus erythematosus[J].Rheumatol Int,2011,31(9):1219-1225.
[8]赵宏丽,赵俊芳,李孟娟,等.系统性红斑狼疮患者CD4+CD25+调节性T细胞及其细胞因子的改变[J].中国皮肤性病杂志,2012,12(7):581-583.
[9]Crispin JC.Regulatory T cells as modulators of B cell antibody production[J].Clin Immunol,2011,140(3):216-217.
[10]于周,李作孝.CD4+CD25+调节性T细胞、Foxp3与多发性硬化的关联[J].中华神经医学杂志,2009,8(1):98-100.
[11]Langier S,Sade K,Kivity S.Regulatory T cells in allergic asthma[J].Chest,2012,14(3):180-183.
[12]郭新红,范佳鑫,阿依姆妮萨·阿卜杜热合曼,等.CD4+CD25+CD127low调节性T细胞及相关细胞因子与慢性特发性血小板减少性紫癜的研究[J].中国免疫学杂志,2011,27(1):73-75.
[13]郑京,郑春盛,陈雪兰,等.Treg、TGF-β、IL-17对狼疮性肾炎的影响及相互关系[J].中华风湿病学杂志,2010,14(1):25-28.
[14] 王菊霞, 郑京.调节性 T 细胞、TGF-β、IL-6、IL-10、IL-17 对系统性红斑狼疮的影响及其与中医证型的关系[J].山东中医药大学学报,2012,36(2):120-122.
[15]Amasaki Y,Kobayashi S,Takeda T,et al.Up-regulated expression of fas antigen(CD95)by peripheral naive and memory T cell subsets in patients with systemic lupus erythematosus (SLE):a possible mechanism for lymphopenia[J].Clin Exp Immunol,1995,99(2):245-250.
[16]刘华,何敏,刘建胜,等.雷帕霉素对TGF-β1诱导的Treg细胞的体外影响[J].中南药学,2010,8(6):437-441.
