心房黏液瘤的多层螺旋CT表现
2013-09-07李佩玲赵一冰黎庶李红
李佩玲,赵一冰,黎庶,李红
(中国医科大学附属第一医院放射科,沈阳 110001)
心房黏液瘤是常见的心脏原发肿瘤,约占所有原发肿瘤的50%[1]。以往该病的术前诊断主要依靠心脏超声检查,近年来随着冠状动脉CT血管造影(computed tomography angiography,CTA)的广泛临床应用,通过CT冠状动脉血管造影检查发现和诊断心房黏液瘤的病例数量逐渐增多。本文对经CT冠状动脉血管造影检查发现并经手术证实的心房黏液瘤患者的CT资料进行回顾性分析,以提高对该病的诊断水平。
1 材料与方法
1.1 病例资料
收集2009年6月至20011年10月期间经手术病理证实的17例心房黏液瘤患者的临床资料,其中男10例,女7例。年龄36~71岁,平均44.3岁。8例疑诊冠心病行冠状动脉CTA检查发现;5例自觉胸闷、气短,行心脏超声检查发现;1例因慢性缩窄性心包炎住院治疗,术前超声检查发现右心房占位;l例因反复血尿诊断慢性肾小球肾炎而住院治疗,常规检查心脏超声偶然发现左心房占位;1例心脏听诊发现杂音拟诊断风心病二尖瓣狭窄,拟行瓣膜置换术,入院后完善心脏超声检查时发现左心房占位;1例因左下肢疼痛,行下肢血管超声发现左侧髂动脉闭塞,行主动脉CTA检查时发现左心房占位。所有患者均接受手术治疗。
1.2 CT检查方法
检查前准备:(1)检查前 4 h 禁食水;(2)控制心率在75次/min以下,并应保持平稳,心率不齐者给予药物控制;(3)正确安放心电门控电极;(4)扫描前对患者进行屏气训练。
CT扫描方法:使用飞利浦Brilliance256 iCT(荷兰生产)机进行扫描,先行正侧位双向定位,然后行全心脏平扫,采用轴扫模式,层厚3 mm,间隔3 mm。增强扫描使用自动追踪技术,动态监测层面确定在升主动脉,触发阈值100 HU,延迟6 s后自动启动扫描。造影剂使用碘比乐(含碘量为370 mg/mL),用量75~85 mL,流速5.5~6.0 mL/s,使用双筒高压注射器团注。造影剂注射结束后,连续追加生理盐水40 mL冲洗。怀疑外周血管有肿物栓塞者,扩大扫描范围加做主动脉及外周动脉CTA。
扫描条件:(1)平扫选择前瞻性心电门控扫描方法,采用Stepshot扫描模式,管电压120 kV,管电流200 mAs,重建层厚 3 mm,重建间隔 3mm;心率>70次/min时,选择采集40%R-R间期数据重建图像,心率<70次/min时,则选择75%R-R间期数据重建。(2)增强扫描选择回顾性心电门控扫描,采用螺旋扫描方式,管电压120 kV,管电流798 mAs,重建层厚0.9 mm,重建间隔0.9 mm,机架转速每周0.27 s,准直宽度 128×0.625 mm,扫描时间 4~5 s。(3)延迟期扫描于注射造影剂后120 s,扫描条件同增强扫描。(4)扩大扫描范围行外周动脉CTA检查,不加用心电门控,扫描范围包括覆盖目标血管,大范围扫描程序为Runoff大螺距扫描,监测层面在扫描野的近心侧,监测区域(ROI)设定在主动脉,阈值为150 HU,自动触发扫描的延迟时间调整为18 s;对比剂注射部位为前壁肘静脉,药量100~150 mL(依患者体质量调整),盐水用量40 mL,注射速度为5.0 mL/s。
1.3 图像后处理方法及观察内容
图像后处理方法包括多平面重建、曲面重建等。观察内容包括:(1)肿物的形态、密度、部位、大小等;(2)增强后肿物的强化程度;(3)肿物与心房壁的关系及活动度;(4)有无外周动脉种植转移。
2 结果
2.1 手术及病理表现
17例心房黏液瘤中,左心房14例,右心房3例。17例心房肿物均行手术切除。1例右心房黏液瘤合并慢性缩窄性心包炎者,手术中一并行增厚心包剥脱术。1例合并左侧髂动脉种植栓塞者,切除左心房肿物后,一并将左侧髂动脉内肿物切除。
大体观察:肿物质脆,3例瘤内可见出血,5例明显钙化,3例细小钙化灶。3例表面不光整的肿物表面可见绒毛样外观,部分绒毛间隙较深在,其内见血栓形成。镜下病理:主要为黏液瘤细胞,呈梭形或星芒状,瘤细胞稀少,分布于大量黏液样基质中,7例病理肿瘤内见血管结构,3例于肿物蒂附着处有新生肿瘤血管结构,7例肿瘤内未见血管结构。
2.2 CT表现
所有肿瘤在CT平扫图像上呈低密度或等密度影,平均 CT值约为(21.39±10.63)HU,CT值范围在18.58~43.03 HU,边缘难以分辨。5例瘤体可见钙化,呈絮状、斑片状或弧线状钙化(图1A)。增强扫描动脉期心房明显均匀强化,肿物边界相对清晰,瘤体呈圆形或椭圆形。8例边缘光整,6例有分叶(图1B),发生在左心房中,3例表面不光整呈菜花状。肿物大小范围不等,直径范围在1.8~9.5 cm之间,3例发生在右心房者肿瘤体积相对较小,直径在1.2~3.4 cm之间。动脉期瘤体无强化,延迟期10例瘤体呈轻度强化,7例无明显强化,延迟期平均CT值约为(29.88±14.51)HU,CT 值范围在 19.12~47.95 HU,与平扫 CT值比较无统计学差异(t=1.96,P>0.05)。3例肿物边缘区可见斑点状高密度强化,局部CT值接近周围心房密度。
多平面重建后处理图像显示17例肿物均与心房壁间有蒂相连,宽窄不等,10例蒂较短而宽,5例蒂较长,起自房间隔区10例,其余6例起自心房壁其他部位,1例CT图像未见到明显的蒂状结构;2例发生在左心房者肿物活动度较大,于舒张期可见肿物脱入二尖瓣口(图1C、1D)。1例左心房黏液瘤合并左侧髂动脉种植,管腔闭塞,形成瘤栓,增强后亦无强化表现(图2)。
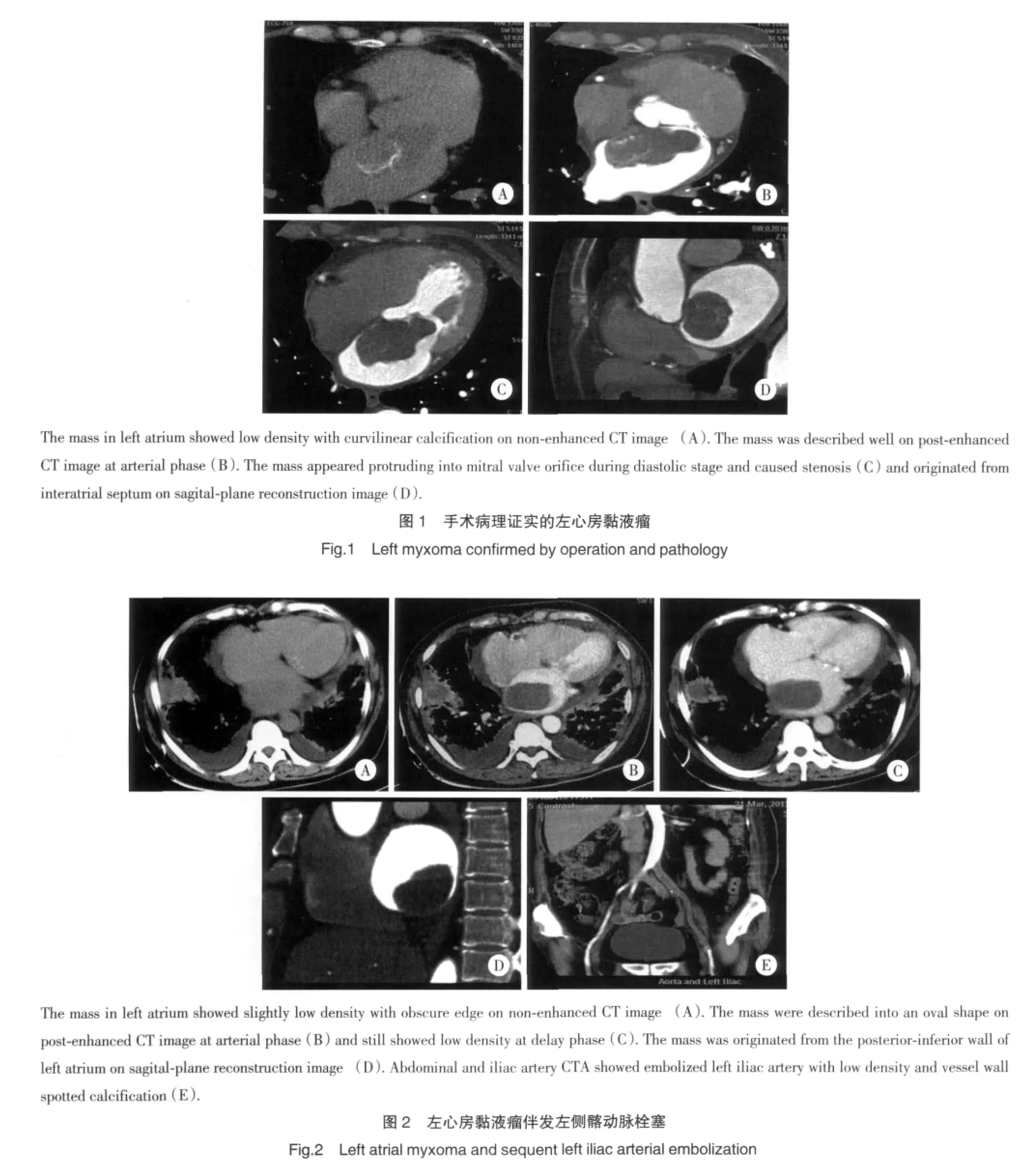
3 讨论
3.1 心房黏液瘤的临床特点
心房黏液瘤在心脏各房、室均可发生,多发生于左心房(约占75%~80%),其次右心房(占15%~20%),最常见的部位是靠近房间隔卵圆窝及其周围区域[2,3]。患者多以心悸、气短、晕厥等血流受阻和栓塞等症状就诊,容易误诊为风心病、二尖瓣狭窄等其他心脏疾病。临床上女性多见,发病年龄30~60岁,少数患者有家族史。该瘤质脆易碎,其碎屑脱落后进入血循环可引起肺动脉或体循环动脉栓塞,部分病例以动脉栓塞为首发症状就诊[4]。实验室检查多为阴性,多数病例经心脏超声检查发现。近年来随着多层螺旋CT冠状动脉造影技术的提高及其广泛的临床应用[5,6],经CT检查发现的病例越来越多。因此,认识该病的CT表现特点非常重要,有利于该病的尽早诊断和及时手术治疗。
3.2 心房黏液瘤的CT表现
有关心脏黏液瘤的影像表现多数采用超声检查[3,7]。通过本研究中17例患者资料的总结分析,心房黏液瘤的CT表现特征有:(1)CT平扫呈稍低密度或等密度,伴有絮状、斑片状或弧线状钙化;(2)边界清楚、轮廓光整,呈圆形或卵圆形,可有分叶或呈菜花状;(3)肿瘤均有蒂与心房壁相连,蒂宽窄不等,蒂较长者可见肿物活动范围较大,于舒张期可脱入房室瓣口或心室内;(4)增强扫描动脉期无强化,延迟期肿物可轻度强化或无明显强化,增强扫描肿瘤周边可见明显强化灶,CT值接近心腔密度,经手术证实是由于肿物表面不光整、存在较深的间隙、增强后造影剂进入所致;(5)除了心脏本身的检查外,应注意检查主动脉及周围血管有无种植瘤栓塞。本研究中3例病理显示细小钙化存在,CT平扫图像未能显示,表面CT对于细小钙化灶识别尚有限度。关于肿瘤的强化程度,文献报道尚存在分歧。梁坚豪等[8]报道黏液瘤增强扫描有不同程度强化,且强化原因为肿瘤内有不同程度的新生血管所致。刘颖等[9]分析22例肿瘤的MR增强表现,结果19例轻度至中度强化,3例无强化,病理提示肿瘤增强是由于瘤内可见小血管分布。本研究中虽增强前后CT值均值间无统计学差异,但病理证实瘤体内除黏液基质及少数黏液细胞外,在部分肿瘤内或瘤体的心房壁附着处观察到新生肿瘤血管,表明增强后有强化效应具有病理学依据。但由于CT值测量多种因素的影响,如肿瘤周围心房高密度造影剂、瘤体内的钙化、出血等,CT值测量误差较大,应采用多层面多部位的反复测量,避开影响测量准确性的区域。体积小的肿瘤因容积效应的影响易误认为有强化效应,这也是CT检查导致误诊的主要原因之一。
3.3 多层螺旋CT的优势
多层螺旋CT心脏扫描加用心电门控技术,可获得收缩期及舒张期图像。多层螺旋CT对于该病诊断的优势在于:(1)利用图像后处理技术可准确观察肿物与心房壁的关系,甚至可发现非常细小的蒂;(2)CTA检查方便快捷,除了检查心脏外,还可以增加扫描范围,同时行外周动脉CTA的检查,对于检测肿瘤种植引起的外周血管栓塞具有重要价值;(3)通过收缩期及舒张期肿物位置的变化可观察肿物的活动度,既有助于该病的诊断,又有助于判断病情。上述影像信息对临床治疗具有重要指导价值,可避免术中操作失误导致肿瘤破损、碎屑脱落引起的外周动脉栓塞。本研究中2例肿物蒂长脱入左心室,经手术证实术前诊断正确,术中采用保护措施避免了肿瘤碎屑脱落。另1例左心房黏液瘤患者,通过全腹主动脉及双下肢动脉CTA检查发现伴有左侧髂动脉种植栓塞,术中将动脉种植瘤与心房肿物一并切除,提高了临床疗效。
3.4 鉴别诊断
心房黏液瘤应注意与风心病二尖瓣狭窄、心房内血栓、心房内转移瘤相鉴别。黏液瘤堵塞二尖瓣口时,临床表现与风心病二尖瓣狭窄相似,但前者无风湿热病史、心脏超声检查心房内有占位病变可供鉴别。心房内血栓形成形态上类似黏液瘤,靠近心房壁存在,陈旧血栓可伴有钙化,但其密度较黏液瘤高,临床上多有房颤病史,结合实验室检查不难鉴别。心房内转移瘤有原发肿瘤病史,增强后转移瘤有明显强化。
总之,多层螺旋CT可多平面观察心房黏液瘤的CT表现特点及强化程度,具有一定特征性,结合临床表现、实验室检查结果阴性等临床资料,可以对该病作出初步诊断,但确诊还依赖于病理组织学检查。
[1]Parissis JT,Zezas S,Sfiras N,et al.An atypical left atrial myxoma causing intracavitary pressure gradient and typical diastolic transmitral flow of severe mitral stenosis[J].Int J Cardiol,2005,102(1):165-167.
[2]Duran NE,Ozkan M.Left atrial myxoma with atypical localization[J].Turk Kardiyol Dern Ars,2008,36(4):256-258.
[3]Charokopos NA,Rouska E,Pliakos C,et al.Atypical atrial myxomas in two asymptomatic patients:a case report[J].Cardiovasc Ultrasound,2009,7(9):45.
[4]Hong S,Park KT,Choe H,et al.Total occlusion of the abdominal aorta caused by detachment of cardiac myxoma[J].Korean J Thorac Cardiovasc Surg,2012,45(3):183-185.
[5]胡斌,徐文坚,张通,等.心率及重建时相对64层CT冠状动脉成像图像质量的影响[J].首都医科大学学报,2008,29(6):778-783.
[6]陈少源,苏又苏,谢培益,等.双源CT成像评价冠状动脉病变的临床价值[J].南方医科大学学报,2010,30(9):2125-2127.
[7]张棣,龙伟吟,朱性威,等.心脏黏液瘤的超声诊断[J].中华超声影像学杂志,2001,10(2):103.
[8]梁坚豪,朱新进,赵继文,等.16层螺旋CT对左房黏液瘤的诊断价值[J].中国 CT 和 MR 杂志,2010,8(5):38-39.
[9]刘颖,孔祥泉,王振平,等.心脏黏液瘤MRI与手术病理对照研究[J].中华放射学杂志,2009,43(10):1043-1046.
