紫外分光光度法测定薯蓣皂甙元含量的研究
2013-09-05沈晖赵丛丛刘曾曾凡骏
沈晖,赵丛丛,刘曾,曾凡骏
(四川大学轻纺与食品学院,四川成都 610065)
薯蓣皂甙元又称皂素,可溶于石油醚等有机溶剂,自上世纪30年代日本生化学家从薯蓣属的山箄中分离出第一个薯蓣皂甙元,开创了利用植物原料进行甾体药物合成的先河以来[1],已有约400多种药物以薯蓣皂甙元为原料或中间产物,通过衍生、合成而制得。我国作为薯蓣皂甙元主要生产国,年产量占世界总产量的60%,其中2/3直接用于出口[2]。目前薯蓣皂甙元的检测方法有气相色谱、高效液相色谱法等,而一般薯蓣皂甙元生产企业条件设备有限,因此一种简单、有效、快速的薯蓣皂甙元含量的测定方法在实践应用中具有重要价值。
1 仪器与试剂
1.1 仪器
752紫外光栅分光光度仪:上海精密科学仪器有限公司;TG628A分析天平;DSY-1-4孔电热恒温水浴锅:北京爱琦霞商贸有限公司;烧杯、比色管、移液管、比色皿、洗瓶、胶头滴管若干等。
1.2 试剂
薯蓣皂素标准品:成都普思生物科技有限公司;乙醇、高氯酸、冰乙酸均为分析纯;蒸馏水。
5%香草醛-冰醋酸溶液:称取5 g香草醛,加冰乙酸溶解并定容至100 mL。
薯蓣皂甙元标准溶液:20 mg薯蓣皂甙元标准品溶于石油醚中,定容于50 mL容量瓶中。
薯蓣皂甙元样品溶液:准确称取菊叶薯蓣干粉20 g,加入80 mL浓度为3 mol/L的硫酸溶液酸解4 h,之后过滤,用水洗至中性,滤渣烘干,用400 mL石油醚抽提8 h,回收溶剂,待烧瓶中提取液体积50 mL左右停止加热,提取液冷却后倒入150 mL容量瓶中,石油醚定容,移液管移取10 mL至100 mL容量瓶中,用石油醚定容至100 mL。
2 检测方法
2.1 检测条件的确定
2.1.1 吸收光谱的确定
取皂甙元标准溶液0.1 mL,样品溶液0.1 mL于10 mL比色管中,挥干,再分别加5%香草醛-冰醋酸溶液0.2 mL和高氯酸0.8 mL混匀、密塞,置70℃恒温水浴中显色15 min,取出后立即以冰水冷却5 min,加入冰醋酸定容至10 mL,摇匀,静置20 min,以试剂空白为参比,用分光光度计于波长400 nm~700 nm处扫描,确定最大吸收波长。
2.1.2 5%香草醛-冰醋酸溶液的加量
取标准皂甙元溶液0.1 mL于10 mL比色管中,挥干溶剂,分别加5%香草醛-冰醋酸溶液0.1、0.15、0.2、0.25、0.3 mL和高氯酸0.8 mL混匀、密塞,置70℃恒温水浴中显色15 min,取出后立即以冰水冷却5 min,加入冰醋酸定容至10 mL,摇匀,静置20 min,以试剂空白为参比,用紫外分光光度计于薯蓣皂甙元最大吸收波长处测定吸光度。
2.1.3 高氯酸溶液的加量
分别加高氯酸 0.6、0.7、0.8、0.9、1.0 mL 和 0.2 mL 5%香草醛-冰醋酸溶液混匀,按2.1.2进行实验。
2.1.4 水浴温度
按 2.1.2 实验,分别置于 50、60、70、80、90 ℃恒温水浴中显色15 min。
2.1.5 水浴时间
按2.1.2实验,分别置于80℃恒温水浴中显色5、10、15、20 、25 min。
2.1.6 放置时间
按2.1.2实验,摇匀后分别静置 10、20、30、40、60min。
2.2 检测方法评价
2.2.1 薯蓣皂甙元标准曲线的绘制
分别吸取 0、0.1、0.2、0.3、0.4、0.5、0.6 mL 标准溶液于具塞比色管中,以上述实验所得的最优检测条件按2.1.2进行实验,绘制薯蓣皂甙元标准曲线。
2.2.2 精密度实验
取1 mL薯蓣皂甙元样品溶液以实验确定的最佳检测条件按2.1.2中操作进行检测,重复测定吸光度,计算相对标准偏差(RSD)。
2.2.3 加标回收率实验
取已知浓度的薯蓣皂甙元样品溶液5份(每份体积皆为0.1mL,同时取0.1mL样液经测定当中薯蓣皂甙元浓度为0.206 mg/mL),分别加入非等量的薯蓣皂甙元标准溶液(0.1、0.2、0.3、0.4、0.5、0.6 mL),以实验确定的最佳检测条件按2.1.2进行实验操作并计算加标回收率。
3 结果与分析
3.1 检测条件的确定
3.1.1 吸收光谱的确定
薯蓣皂素检测波长扫描图,见图1。
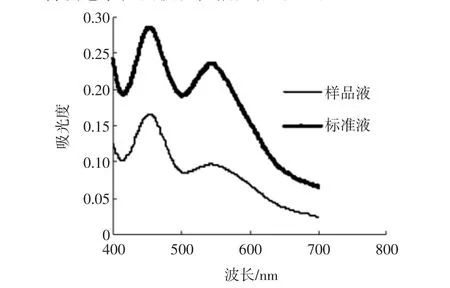
图1 薯蓣皂素检测波长扫描图Fig.1 Wavelength scan of diosgenin
由图1可知薯蓣皂甙元的最大吸光度在452 nm处,因此选择452 nm作为薯蓣皂甙元的检测波长。
3.1.2 5%香草醛-冰醋酸溶液加量对吸光度的影响
5%香草醛-冰醋酸溶液加量对吸光度的影响,见图2。

图2 5%香草醛-冰醋酸溶液加量对吸光度的影响Fig.2 Effect of 5%vanillin-glacial acetic acid solution dosage on absorbance
由图2可以看出,随着香草醛-冰醋酸加量的增大,吸光度增大,当其加量到0.2 mL后,吸光度趋于稳定,确定5%香草醛-冰醋酸的加量为0.2 mL。
3.1.3 高氯酸溶液加量对吸光度的影响
高氯酸溶液加量对吸光度的影响见图3。

图3 高氯酸加量对吸光度的影响Fig.3 Effect of high acid solution dosage temperature
图3表明随着高氯酸溶液的加量的增加吸光度先增大后减小,当用量在0.7 mL时,吸光度达到最大,因此确定高氯酸的加量为0.7 mL。
3.1.4 水浴温度对吸光度的影响
水浴温度对吸光度的影响见图4。

图4 水浴温度对吸光度的影响Fig.4 Effect of water bath temperature
由图4知水浴温度在70℃以下时,吸光度较为稳定,温度在80℃时,吸光度达到最大,之后随着温度的增加吸光度急剧下降,故确定反应温度为80℃。
3.1.5 水浴时间对吸光度的影响
水浴时间对吸光度的影响见图5。
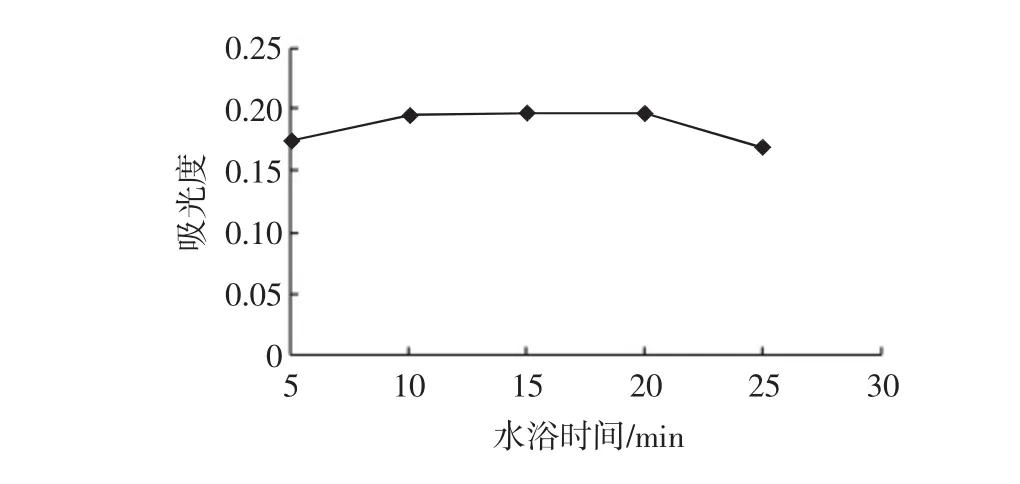
图5 水浴时间对吸光度的影响Fig.5 Effect of water bath time on absorbance
由图5可知一定的反应时间内,反应充分,吸光度也较为稳定,随着反应时间的延长,副反应的发生会影响显色效果,导致吸光度下降。所以确定反应时间为15 min。
3.1.6 放置时间对吸光度的影响
放置时间对吸光度的影响,见图6。
由图6看出,当放置时间大于20 min时,吸光度趋于稳定。因此确定放置时间为20 min。

图6 放置时间对吸光度的影响Fig.6 Effect of storage time on absorbance
3.2 实验方法评价
3.2.1 薯蓣皂甙元标准曲线的绘制
薯蓣皂甙元标准曲线如图7所示,结果表明薯蓣皂甙元在0.04 mg~0.24 mg范围内,吸收度呈良好线性关系,其回归方程为y=4.237 1x+0.007 1,r=0.999 2。
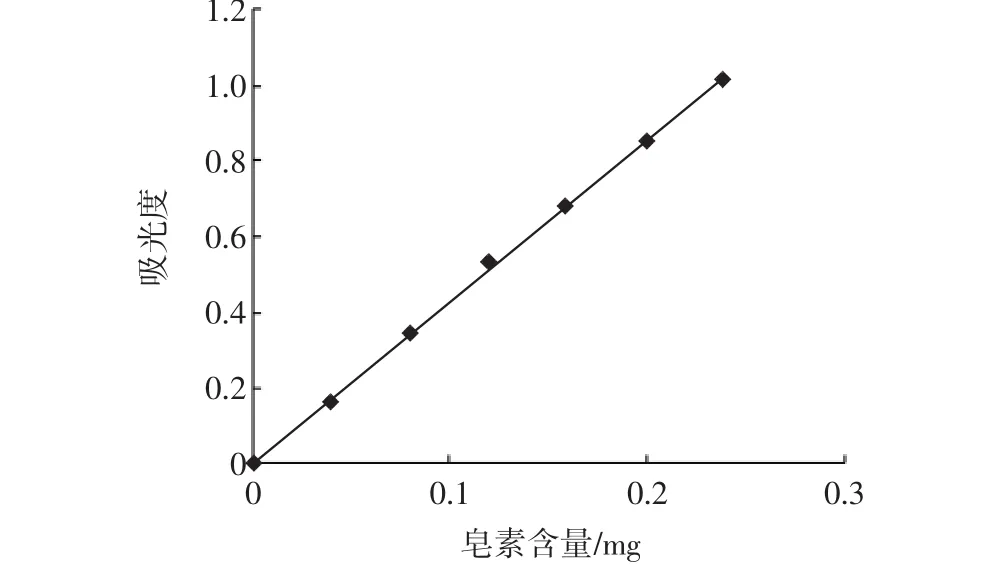
图7 薯蓣皂甙元标准曲线Fig.7 Concentration-absorbency curve of diosgenin
3.2.2 精密度实验
精密度实验结果如表1所示。

表1 精密度实验结果Table 1 Results of precision experiment
由表1中的实验结果表明,相对标准偏差为1.123%,方法重现性好。
3.2.3 加标回收率实验
加标回收率结果如表2所示。

表2 薯蓣皂甙元加标回收率的计算Table 2 Results of average recovery
由表2中的计算结果表明用此检测方法检测薯蓣皂甙元具有较高的加标回收率。
4 结论
本文对薯蓣皂甙元的检测条件进行了系统分析,得到最佳优化条件为,检测波长:452 nm,5%香草醛-冰醋酸溶液的加量:0.2 mL,高氯酸溶液的加量:0.7 mL,水浴温度:80 ℃,水浴时间:15 min,放置时间:20 min,精密度实验的相对标准偏差(RSD)与加标回收率实验的平均回收率分别为1.123%与99.5%,通过以上分析表明该法具有良好的稳定性、灵敏性与再现性,同时用紫外分光光度计测定薯蓣皂甙元含量操作简单、设备要求低,能够满足一般生产企业的需求。
:
[1]陈新荣,杨天龙,胡世波.菊叶薯蓣产业化发展优势及综合利用前景分析[J].攀枝花科技与信息,2007,11(4):6-8
[2]李辉,倪晋仁.薯蓣皂甙元的研究进展[J].精细化工,2010,27(1):60-65
[3]王俊,杨克迪,陈钧.分光光度法测定薯蓣皂苷元[J].分析实验室,2004,23(1):73-75
[4]Slack S C,MaderW J.Colorimetric assay for diosgenin and related compounds[J].Analytical chemistry,1961,33(4):625
[5]乔春峰,檀爱民,董辉,等.国产闭鞘姜属植物中薯蓣皂甙元的含量测定[J].中国药科大学学报,2000,31(2):156-158
