反复冻融法辅助提取油菜花粉多糖的研究
2013-09-05郭卫芸刘海英白玉敏杨公明
郭卫芸,刘海英,白玉敏,杨公明
(1.许昌学院食品科学与工程学院,河南许昌 461000;2.西华大学生物工程学院,四川成都 610039;3.华南农业大学食品学院,广东广州 510642)
反复冻融法辅助提取油菜花粉多糖的研究
郭卫芸1,刘海英1,白玉敏2,杨公明3,*
(1.许昌学院食品科学与工程学院,河南许昌 461000;2.西华大学生物工程学院,四川成都 610039;3.华南农业大学食品学院,广东广州 510642)
摘 要:通过对加水量、冻结时间、解冻温度、冻融次数等进行单因素试验及正交试验,验证反复冻融法对油菜花粉中多糖的辅助提取效果,确定最佳处理条件为:加水量40 mL/100 g,冻结时间4 h,解冻温度80℃,冻融次数2次,在此条件下,油菜花粉可溶性多糖溶出率可达到21.79%。
关键词:油菜花粉;多糖;反复冻融;提取
油菜为十字花科芸苔属中用于采籽榨油的植物,其花粉呈黄色,多数为近球形或长球形,表面呈颗粒状,形体大且外壁薄、清香、无怪味[1]。花粉营养丰富,碳水化合物占40%~50%,其中绝大多数是多糖,长期合理食用花粉,可明显增强体质、提高免疫力、延缓衰老[2]。我国是世界养蜂大国,蜂花粉年产量约1 500 t,居世界首位,但花粉资源利用率却很低,开发花粉食品具有广阔的市场前景和巨大的潜在价值[3]。由于花粉壁结构复杂,组织致密,对花粉营养物质的溶出起到较强的阻碍作用[4-6]。因此,研究合适的破壁工艺,对于提高多糖的得率意义重大。本研究主要验证反复冻融法对花粉破壁的有效性,并试验确定合适的处理条件。
1 材料与方法
1.1 材料与设备
油菜花粉:许昌地区市售;葡萄糖(标准品);苯酚(分析纯);硫酸(分析纯);95%的乙醇(分析纯);YP2002型电子分析天平、BlueStar型紫外-可见分光光度计:莱伯泰科有限公司;TG16-WS台式离心机:湘仪离心机仪器有限公司。
1.2 方法
1.2.1 流程及操作要点
1.2.1.1 流程
油菜花粉→加水溶胀→慢速冷冻→水浴中快速解冻→加水→搅拌→静置1 h→离心→取上清液→定容[7]→测定多糖
1.2.1.2 操作要点
1)油菜花粉
要求油菜花粉籽粒饱满,色泽金黄,无虫蛀,无霉斑,并去除砂粒等杂质。各组取5 g花粉置于准备好的保鲜袋上。
2)加水溶胀
按照各组试验要求快速准确的加一定量水,用保鲜袋将花粉包住密封,并轻轻揉揉之后室温下放置30 min,使水分充分渗入到花粉中。
3)反复冻融
按照各组试验要求在冰箱中缓慢冷冻一定时间后,取出,迅速放在水浴锅中溶解,如此反复。
4)可溶性糖的溶出
将反复冻融后的花粉全部取出置于离心管中,加水15 mL并将花粉用玻璃棒轻轻捣碎,使溶液充分混合,室温下放置1 h。
5)离心
以3 000 r/min的速度对上述溶液离心20 min。
6)定容
取离心后的上清液,定容至250 mL。
1.2.2 多糖含量的测定
利用苯酚-硫酸法测定多糖[7-9]。
1.2.2.1 标准曲线的绘制
准确吸取葡萄糖标准溶液(0.1 mg/mL)0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL,分别置于试管中,各加入蒸馏水,使其体积为2.0 mL,再加入6%苯酚1.0 mL,并迅速滴加浓硫酸5.0 mL,静置10 min,充分振荡摇匀之后静置20.0 min。另外以蒸馏水2.0 mL,加苯酚和浓硫酸,同上述操作做空白对照,于波长490 nm处测吸光度值,得标准曲线,如图1。

图1 标准曲线Fig.1 Standard curve
1.2.2.2 可溶性多糖溶出率测定
按1.2.1工艺处理样品后,将得到的花粉上清液进行100倍稀释,取稀释后的样品2.0 mL,经上述处理后测定吸光值,并计算可溶性多糖溶出率。

式中:A为试样的吸光度;V为样液的体积,mL;M为样品质量,g。
2 结果与分析
2.1 加水量对油菜花粉可溶性多糖的溶出率的影响
共设 5个加水量处理,分别为 10、20、30、40、50 mL/100 g,每个处理重复2次。并在冻结时间3 h、冻结温度-30℃、解冻温度80℃、溶解时间20 min及反复冻融3次的条件下冻融,测定可溶性多糖溶出率,结果如图2。

图2 加水量对油菜花粉可溶性多糖溶出率的影响Fig.2 Effect of water addition to content of soluble polysaccharides
由图2可以看出,可溶性多糖的溶出率随加水量的增加先呈快速上升,后趋于平缓的趋势。这主要是因为花粉中的水冻结形成冰晶体,加热融化可以产生张力,从而破坏花粉壁的组织结构,而细胞内外的水分直接关系到冰晶体量的大小。当加水量为30 mL/100 g时可溶性多糖达到20.55%,加水量再继续增加,可溶性多糖溶出率变化不大,说明在加水量为30 mL/100 g时水分完全填充了细胞内部间隙,导致在冻融过程中冰晶体对细胞的机械作用发挥到最大。
2.2 解冻温度对油菜花粉可溶性多糖的溶出率的影响
共设5个解冻温度处理,分别为60、70、80、90、100℃,每个处理重复2次。在加水量为20mL/100 g、冻结时间3 h、冻结温度-30℃、溶解时间20 min及反复冻融3次的情况下冻融,测定可溶性多糖溶出率,结果如图3。
由图3可知,解冻温度对油菜花粉可溶性糖溶出率影响较显著。在温度低于80℃时,可溶性多糖溶出率随着温度的升高而升高。当温度超过了80℃后,可溶性多糖溶出率急剧减少,有人在进行乌龙茶多糖提取研究时也得到了相似的结果[10]。分析认为,温度过高时,可能会使花粉多糖降解。而温度太低,细胞破壁率低,多糖溶出不完全。可以认为油菜花粉破壁的解冻温度在80℃较为合适。

图3 解冻温度对油菜花粉可溶性多糖溶出率的影响Fig.3 Effect of defrosted temperature to content of soluble polysaccharides
2.3 冻融次数对油菜花粉多糖溶出率的影响
共设 5个冻融次数处理,分别为 0、2、3、4、5次,每个处理设2个重复。在加水量为20 mL/100 g、冻结时间3 h、冻结温度-30℃、溶解时间20 min及解冻温度80℃的条件下进行冻融,测定可溶性多糖溶出率,得结果如图4。

图4 冻融次数对油菜花粉可溶性多糖溶出率的影响Fig.4 Effect of repeated freezing and melting times to content of soluble polysaccharides
根据图4可知,随着冻融次数的增多,油菜花粉可溶性多糖的溶出率逐渐增大。但开始时油菜花粉可溶性多糖的溶出率增大的幅度较大,在超过3次后,其多糖溶出率增大的幅度较缓慢。分析认为,经过3次冻融,大部分油菜花粉的细胞结构已被破坏。
2.4 冻结时间对油菜花粉多糖溶出率的影响
共设 5 个冻结时间处理,分别为 0、2、3、4、5 h,每个处理设2个重复。在加水量为20 mL/100 g、冻结温度-30℃、溶解时间20 min、解冻温度80℃及反复冻融3次、的条件下冻融,测定可溶性多糖溶出率,结果如图5。
根据图5可知,在试验条件下,随着冻结时间的增多,油菜花粉可溶性多糖的溶出率逐渐增大,当冻结时间超过3 h后,多糖溶出率增大的幅度开始缓慢。分析原因可能是在冻结3 h时,油菜花粉的细胞壁已被破坏,致使大部分可溶性多糖可以突破细胞壁三维网状结构的束缚而溶出。冻结时间加长,花粉多糖溶出率增加也缓慢。

图5 冻结时间对油菜花粉可溶性多糖溶出率的影响Fig.5 Effect of freezing time to content of soluble polysaccharides
2.5 正交试验
为选择反复冻融法破壁油菜花粉的最佳工艺条件,设计以加水量、解冻温度、冻融次数、冻结时间为考察因素,以油菜花粉可溶性多糖的溶出率为考查目标的L9(34)正交试验,因素水平见表1。
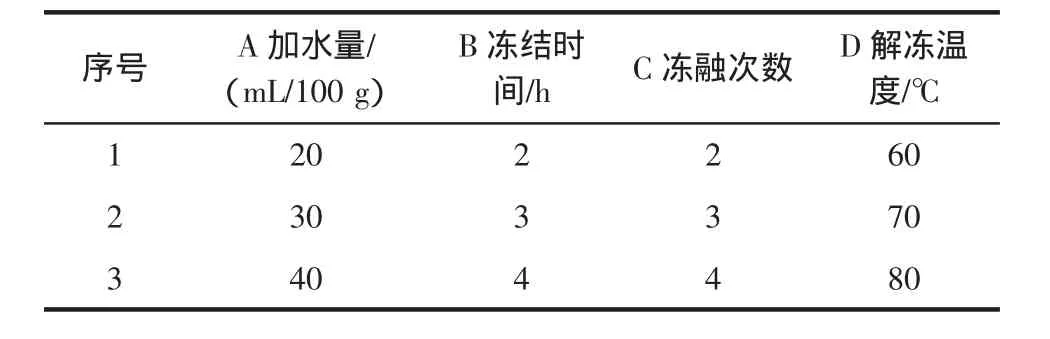
表1 正交试验因素水平表Table 1 Factors and levels of the orthogonal test
经过试验,结果见表2。

表2 正交试验结果Table 2 Result of orthogonal test
由表2可知各因素对油菜花粉可溶性多糖溶出率的影响作用是不同的,4个因素对油菜花粉可溶性多糖溶出率的影响大小顺序依次为:B>C>A>D。经过极差分析发现,反复冻融法对油菜花粉破壁的最佳工艺组合为A3B3C1D3,即:加水量40 mL/100 g,冻结时间4 h,解冻温度80℃,冻融次数2次时,油菜花粉可溶性多糖溶出率较高。在此工艺条件下做验证试验,得到3组数据:21.82%、21.75%、21.80%,验证的平均值为21.79%。
3 结论
1)各因素对油菜花粉可溶性多糖溶出率的影响顺序为:冻结时间>冻融次数>解冻温度>加水量。
2)反复冻融法破壁油菜花粉最佳的工艺组合是:加水量40 mL/100 g,冻结时间4 h,冻融次数2次,解冻温度80℃,在此条件下,油菜花粉可溶性多糖溶出率可达到21.79%。
:
[1]王娟,余少文.花粉的营养成分、结构及破壁方法[J].食品研究与开发,2007,28(8):7
[2]何余堂,解玉梅,赵丽红,等.玉米花粉功能食品的研究与开发[J].食品科学,2007,28(9):617-621
[3]朊征,邓择元,吴龙耀,等.HPLC测定油菜花粉中黄酮含量及六种破壁方法对黄酮提取的影响[J].食品科学,2008,29(10):455-458
[4]唐维,张星海.花粉破壁方法的进展[J].食品与发酵工业,2003,29(2):86-92
[5]何余堂,孟良玉,张丽华,等.破壁方法对玉米花粉多糖提取的影响[J].食品工业科技,2005,26(7):133-134
[6]杨晓萍,余志勤.油菜花粉破壁方法研究[J].华中农业大学学报,2004,23(6):671-672
[7]罗毅,潘细贵,刘刚,等.苯酚-硫酸法测定多糖含量显色方式的优选[J].中国中医药信息杂志,2005,12(1):45-46
[8]徐爱列.海娜中多糖的提取及含量测定[J].安徽农业大学学报,2007,34(4):527-529
[9]刘晔玮,邸多隆,葛斌,等.锁阳多糖提取工艺的研究[J].天然产物研究与开发,2006(18):1007-1009
[10]周向军,高义霞,袁毅君,等.乌龙茶多糖提取工艺及抗氧化作用研究[J].中国酿造,2011,233(8):80-84
Technics of Extracting Polysaccharides from Rapeseed Pollen with Repeated Freezing and Thawing Method
GUO Wei-yun1,LIU Hai-ying1,BAI Yu-min2,YANG Gong-ming3,*
(1.College of Food Chemistry and Engineering,XuChang University,Xuchang 461000,Henan,China;2.School of Bioengineering ,Xihua Ucniversity,Chengdu 610039,Sichuan,China;3.College of Food Science,South China Agricultual University,Guangzhou 510642,Guangdong,China)
Abstract:Rapeseed pollen was taken as the main raw material and repeated freezing and thawing method was adopted to break the wall of the pollen.The effects on the wall-broken of the rapeseed pollen made by the water content, freeze time, defrosting degree, freezing-thawing times was studied.Through the orthogonal test, the water content was 40 mL/100 g,the freeze time was 4 hours,the defrosting was 80℃,the freezing-thawing was twice.Under the optimal conditions,the dissolving rate of soluble polysaccharide of the rapeseed pollen was 21.79%.
Key words:rapeseed pollen;polysaccharides;repeated freezing and thawing method;extracting
DOI:10.3969/j.issn.1005-6521.2013.13.007
许昌学院优秀青年骨干教师资助项目;许昌学院科研基金(2013063)
郭卫芸(1981—),男(汉),讲师,硕士,研究方向:农产品贮藏与加工。
2012-10-29
