替吉奥联合吉西他滨治疗转移性胰腺癌的疗效观察
2013-09-05刘为军王昆华郭世奎陈贤玉孙若飞
刘为军,王昆华,郭世奎,雷 毅,徐 玉,陈贤玉,孙若飞
(昆明医科大学附属云南省第一人民医院、云南省肠外肠内营养学研究中心,昆明 650032)
胰腺癌是临床最常见且恶性程度极高的肿瘤之一,居恶性肿瘤死因的第4位,消化系统恶性肿瘤的第2位[1]。胰腺癌患者早期症状不明显,多数确诊时已属中晚期[2]。目前,吉西他滨(GEM)单药化疗是转移性胰腺癌的一线标准治疗,但其对确诊为Ⅳ期及手术根治切除后复发转移者的疗效尚不令人满意。替吉奥(S-1)是氟尿嘧啶衍生物口服抗癌剂,是治疗晚期胰腺癌的常用药物,但它尚未在我国推广使用。2010年4月~2012年8月,我们采用鲁南制药集团山东新时代药业研发的S-1胶囊联合GEM治疗转移性胰腺癌,取得较好疗效。现报告如下。
1 资料与方法
1.1 临床资料 选择同期在云南省第一人民医院住院治疗的转移性胰腺癌患者41例,男28例、女13 例,年龄(54.5 ±4.2)岁,病程(1.1 ±0.2)年。患者均经病理学检查确诊为胰腺癌,临床分期为Ⅲ~Ⅳ期,既往未接受过放化疗,至少有1个以上可测量病灶,KPS评分≥60分,预计生存期>3个月。随机将患者分为观察组21例、对照组20例。两组临床资料有可比性。
1.2 治疗方法 两组均采用抗肿瘤综合治疗,在此基础上,对照组给予 GEM 1000 mg/m2,第 1、8、15天静滴;观察组给予 GEM 1000 mg/m2,第1、15天静滴,同时给予S-1胶囊80 mg/(m2·d)分早晚2次口服、第1~14天。4周为1个疗程。治疗2个疗程后比较疗效,并观察药物的毒副反应。
1.3 疗效和药物毒副反应评价 疗程结束后,参照1981年WHO制定的实体癌近期临床疗效标准评价疗效,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),以CR+PR计算有效率(RR),CR+PR+SD计算疾病控制率(DCR)。参照1981年WHO制定的抗肿瘤药物急性与亚急性毒性反应分度标准评价毒副反应,分为0~Ⅳ度。
1.4 统计学方法 采用SPSS14.0统计软件,结果比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 临床疗效 疗程结束后,观察组CR 2例、PR 4例、SD 9 例,PD 6 例,RR 为28.6%,DCR 为71.4%;GEM组CR 0例、PR 4例、SD 5例、PD 11例,RR为20.0%,DCR为45.0%。两组DCR比较差异有统计学意义(P <0.05)。
2.2 毒副反应 两组毒副反应主要为骨髓抑制、消化道反应,观察组毒副反应轻于对照组(P<0.05)。见表1。
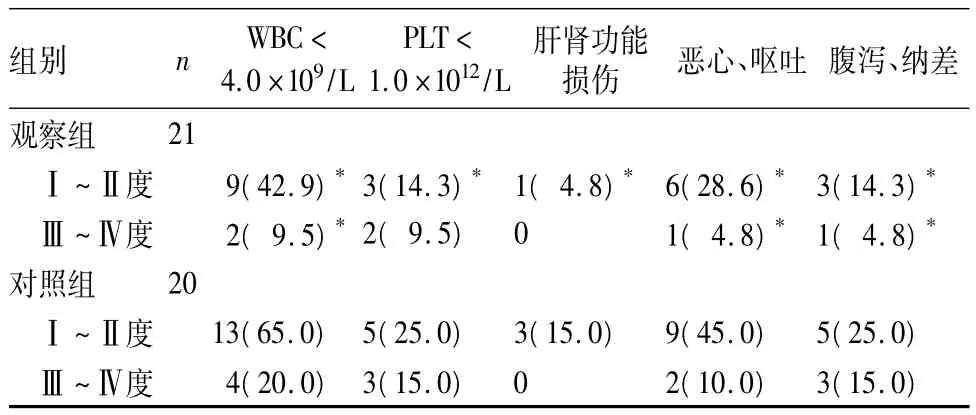
表1 两组主要毒副反应比较[例(%)]
3 讨论
胰腺癌起病隐匿,恶性程度高,患者生存期短,预后差。近年流行病学调查显示,我国胰腺癌发病率呈上升趋势。因多数患者就诊时已为局部晚期或有远处转移,无法行手术根治治疗;故其生存期短,生活质量严重下降,多伴有重度疼痛、恶心、食欲下降等表现。GEM是目前治疗晚期胰腺癌的一线标准治疗方案,但其1年生存率不足20%,RR仅为23%。因此,探索耐受性好、疗效可靠的姑息性治疗方案,对减轻患者痛苦、提高其生活质量、延长生存期非常必要。
S-1是新型的口服氟脲嘧啶制剂,包括替加氟(FT)和吉美嘧啶(CDHP)、奥替拉西(OXO)两类调节剂。FT是5-Fu的前体药物,具有优良的口服生物利用度,能在活体内转化为5-Fu。CDHP能抑制在二氢嘧啶脱氢酶作用下从FT释放的5-Fu分解代谢,有助于长时间维持血中和肿瘤组织中的5-Fu有效浓度,具有与5-Fu持续静注类似的疗效。OXO能阻断5-Fu磷酸化,口服给药后在胃肠组织中的分布浓度很高,从而影响5-Fu在胃肠道的分布,降低其毒性作用。Mende等[3]研究了普通食物对S-l药代动力学的影响,发现消化道恶性肿瘤患者在空腹状态下,OXO的最大浓度和血药浓度—时间曲线下面积明显升高;提示受试者空腹条件下给予S-1,可增加OXO的生物利用度,减轻5-Fu引起的胃肠道毒副作用。2012年,美国临床肿瘤学会研究的最新数据表明,S-1单药治疗晚期胰腺癌的疗效不低于GEM[4];Ku 等[5]等荟萃分析770 例晚期胰腺癌患者的疗效分析也得出同样的结论。
本研究采用S-1胶囊联合GEM治疗晚期胰腺癌患者,与对照组比较,其DCR高,毒副反应少,生活质量好。因此认为,S-1联合GEM方案治疗晚期胰腺癌安全、有效,值得临床应用。
[1]AhmedinJ,Freddil B,Melissa M,et al.Global Cancer Statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Zhang D,Ma Q,Shen S,et al.Inhibition of pancreatic cancer cell proliferation by propranolol occurs through apoptosis induction[J].Pancreas,2009,38(1):94-100.
[3]Mende B,Krauss J,Thyssen D,et al.Pharmaeokinetic study of S-1[J].Int J Clin Pharmacol Ther,2009,47(1):65-67.
[4]Fukutomi A,Okusaka T,SugimoriK,et al.Updated results of the GEST study:randomized phaseⅢ study ofgemcitabine plus S-1(GS)versus S-1 versus gemcitabine(GEM)in unresectable advanced pancreatic cancer in Japan and Taiwan[J].J Clin Oncol,2012,30(Suppl):4035.
[5]Ku GY,Haaland B,Ioka T,et al.Meta-analysis of randomized phaseⅡand phaseⅢtrials of gemcitabinewith/without S-1 in Asian patients with advanced pancreatic cancer[J].J Clin Oncol,2012,30(Suppl):311.
